DNMT3a对胰腺癌细胞吉西他滨敏感性的影响
2018-10-15荆薇宋娜车晓芳侯科佐杨向红
荆薇,宋娜,车晓芳,侯科佐,杨向红
(中国医科大学1. 附属盛京医院第一肿瘤科,沈阳 110022;2. 附属第一医院肿瘤内科,沈阳 110001;3. 附属第一医院辽宁省肿瘤药物及生物治疗重点实验室,沈阳 110001;4. 附属盛京医院病理科,沈阳 110004)
胰腺癌是一种疗效较差的恶性肿瘤,在恶性肿瘤致死率中排第4位[1]。据报道[2]近80%患者无明显临床症状及体征,在诊断时已处于局部晚期或伴随远处转移,从而失去手术机会。据统计[3]2015 年美国共有 48 960 例患者确诊为胰腺癌,而5年生存率低于5%。以吉西他滨 (gemcitabine,GEM) 为基础的单药或联合方案化疗是目前晚期胰腺癌患者的常用治疗方案,在胰腺癌的综合治疗和同步放化疗中占有重要地位[4]。然而,包含GEM在内的多种化疗药物效果并不令人满意[5-6],近30年来胰腺癌的治疗效果及总体预后未见明显改善。
胰腺癌的发生及发展与多种信号通路的异常活化及多种基因的改变密切相关[7]。研究[8]显示这种复杂通路及分子异常与胰腺癌的药物敏感性相关。DNA甲基转移酶3a (DNA methyltransferase-3a,DNMT3a) 属 于DNA甲 基 转 移 酶(DNA methyltransferases,DNMTs)家族成员之一,负责DNA链的重新甲基化。前期研究[9]发现,DNMT3a在包含胰腺癌在内的多种恶性肿瘤中存在过表达,且过表达DNMT3a患者往往具有更差预后。由于DNMT3a对多种基因起甲基化作用,作用范围较广泛,因此认为DNMT3a可能通过多种机制影响胰腺癌细胞对GEM的敏感性。本研究在人胰腺癌Panc-1细胞中应用siRNA下调DNMT3a表达,观察DNMT3a对GEM敏感性的影响,同时探讨DNMT3a 影响胰腺癌细胞GEM敏感性的相关机制。
1 材料与方法
1.1 材料
人胰腺癌Panc-1细胞 (中科院研究所上海细胞库) ,RPMI1640培养液 (美国Gibco 公司) ,优质胎牛血清 (天津灏洋生物制品科技有限责任公司) ,p-STAT3、STAT3一抗 (美国Cell Signaling Technology 公司) ,DNMT3a、GAPDH一抗 (美国 Santa Cruz 公司) ,胞苷脱氨酶(cytidine deaminase,CDA)一抗 (美国Sigma公司) ,羊抗兔 (辣根过氧化物酶标记) 二抗(北京中杉金桥生物技术有限公司) 。siRNA DNMT3a由上海Genepharma公司设计,序列 5’-GCGUCACACAGAAGCAUAUTTAUAUGCUUCUGUGUGA CGCTT-3’。Lipofectamine2000及Annexin V-FITC/PI 凋亡检测试剂盒 (美国Invitrogen公司) 、BD Accuri C6 流式细胞仪 (美国BD公司) 、ECL 发光仪 (美国PIERCE 公司) 、Micro Chemi 4.2成像分析照相系统(以色列 DNR 公司) 。
1.2 方法
1.2.1 细胞培养:胰腺癌Panc-1细胞培养于含有10%胎牛血清的RPMI 1640 培养液中,培养于饱和湿度、37 ℃及含有5% CO2培养箱中。约3 d传代1次,采用进入对数生长期的细胞进行相关实验。
1.2.2 Lipofectamine2000介导 siRNA 瞬时转染:胰腺癌Panc-1细胞接种在 6 孔板内,贴壁后应用lipofectamine 2000按照说明书指示将siRNA NC和siRNA DNMT3a进行转染,将6孔板置于培养箱 6 h后更换含有 10%胎牛血清的RPMI 1640培养液。
1.2.3 MTT法检测细胞增殖能力:胰腺癌Panc-1 细胞或转染后的Panc-1 细胞按 5×103/孔接种于 96 孔板,贴壁生长24 h后每孔更换 含10% 胎牛血清培养液 (180 μL) ,分别加入各浓度GEM (20 μL ) 至终浓度为0、1、5、25 μmol/L。每个浓度实验组设 3 个复孔,48 、72 h后收样。每孔加入 MTT 溶液 (20 μL) ,继续培养箱内孵育 4 h,吸除上清,随后每孔加入 DMSO 200 μL,充分溶解结晶后,按570 nm 波长酶标仪测定吸光度值,并计算对应的增殖率。
1.2.4 Western blotting 检测蛋白表达:收集各实验组细胞裂解于RIPA裂解液中,超声后冰上裂解40 min,13 000 r/min 4 ℃离心30 min,留上清。G-250法行蛋白定量及3×上样缓冲液混合煮沸 5 min。8%或12%的SDS-PAGE电 泳,转 印 至PVDF膜,5%脱脂牛奶封闭 1 h。剪裁转印膜分别封入STAT3、p-STAT3、DNMT3、CDA和 GAPDH 抗体4 ℃冰箱过夜。TTBS 洗膜 4 次后加入二抗室温孵育40 min,ECL法显色,GelCapture照相及图片分析处理。
1.2.5 流式细胞仪检测细胞凋亡:收集各实验处理组细胞及上清,4 ℃PBS 洗2次,按 Annexin V-FITC/PI 双染凋亡检测试剂盒说明,1×结合缓冲液调整至单个悬浮细胞,密度约(2~5)×105/mL,每组 (195 μL细胞液) 加入5 μL Annexin V-FITC,避光静置 10 min,再次离心,加入 190 μL 1×结合缓冲液稀释后加入10 μL PI,室温避光 5 min,用 BD Accuri C6 流式细胞仪判定细胞凋亡比例。
1.3 统计学分析
采用SPSS 17.0 软件进行统计分析,数据为3次独立实验结果,采用±s表示。组间差异比较采用单因素方差分析或t检验。P < 0.05为差异有统计学意义。
2 结果
2.1 GEM对胰腺癌Panc-1细胞增殖的影响
结果显示,随着GEM作用时间延长及药物浓度增加,Panc-1细胞增殖率逐渐下降。与0、1、5 μmol/L浓度比较,25 μmol/L GEM并没有明显增加对Panc-1 细胞增殖抑制 (表1) ,提示Panc-1对GEM存在一定程度耐药。
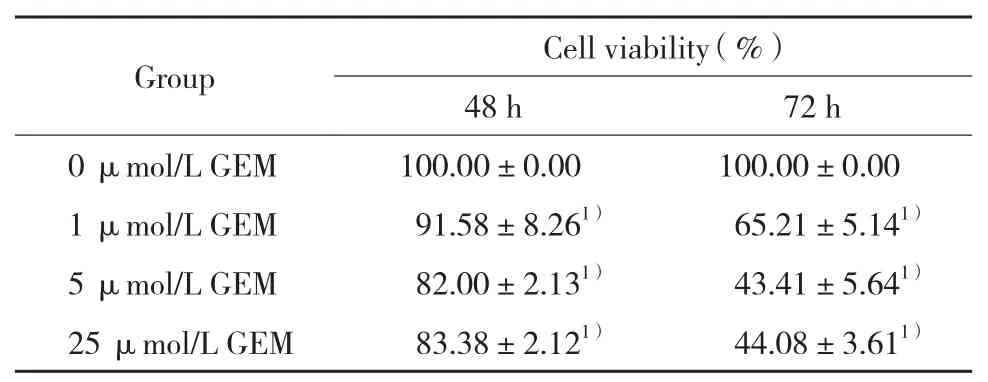
表1 不同浓度GEM对胰腺癌细胞的增殖抑制作用Tab.1 Effects of varying concentrations of GEM on the proliferation of Panc-1 cells
2.2 DNMT3a对胰腺癌细胞GEM敏感性的影响
结果显示,siDNMT3a能够明显降低Panc-1细胞中DNMT3a蛋白表达,见图1A。下调DNMT3a蛋白表达能够使GEM引起的Panc-1细胞增殖抑制率增高,见图1B。说明siDNMT3a可以增加Panc-1细胞对GEM的敏感性。因siDNMT3a增加5 μmol/L GEM敏感性明显,以下实验选择GEM浓度5 μmol/L,观察时间48 h。
2.3 GEM对CDA表达及信号转导与转录因子3(signal transducer and activator of transcription-3,STAT3)通 路的影响
选择5 μmol/L GEM作用于胰腺癌细胞1、6、24 h,Western blotting方法对CDA蛋白及STAT3通路进行检测。结果显示,GEM作用于Panc-1细胞1 h出现轻度p-STAT3抑制,6 h后出现p-STAT3水平明显活化。同时GEM作用于Panc-1细胞6 h后出现CDA蛋白表达上调,见图2。以上结果提示GEM可以诱导CDA蛋白表达,引起STAT3通路活化。
2.4 下调DNMT3a表达对GEM诱导STAT3通路和CDA的影响
应用siRNA DNMT3a瞬时转染Panc-1细胞下调DNMT3a 表达,Western blotting检测GEM作用6 h后对CDA表达及p-STAT3的影响。下调DNMT3a表达可以明显抑制GEM引起的p-STAT3活化,见图3A;同时下调DNMT3a表达可以明显降低GEM引起的CDA表达,见图3B。提示siRNA DNMT3a下调DNMT3a 表达后Panc-1细胞对GEM增敏作用可能是通过下调CDA表达,增加胰腺癌细胞内GEM活化形式来实现的。另外STAT3信号通路一过性活化抑制也可能是GEM增敏的机制之一。
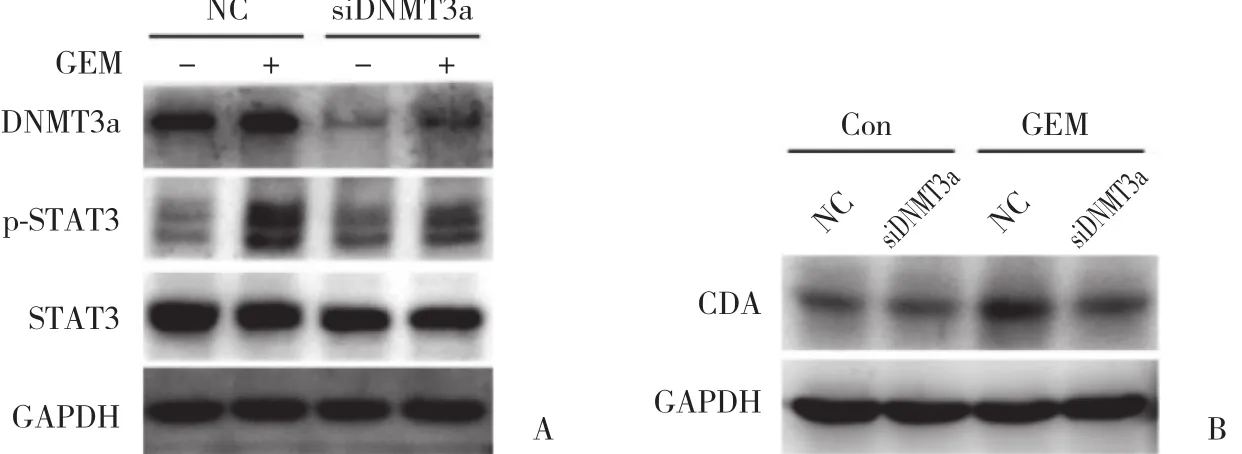
图3 下调DNMT3a对GEM诱导p-STAT3活化及CDA表达的影响Fig.3 Effect of downregulation of DNMT3a expression on GEM-induced expression of CDA and p-STAT3 in Panc-1 cells
2.5 下调DNMT3a表达增加GEM诱导Panc-1细胞凋亡
下调 Panc-1 细胞 DNMT3a 表达24 h后5 μmol/L处理 48 h,Annexin V-FITC/PI 双染检测细胞凋亡。结果显示,下调 DNMT3a 表达增加GEM诱导的细胞凋亡率,对照 (NC) 组、 siDNMT3a组 、 NC+GEM组、 siDNMT3a+GEM 组细胞凋亡率分别为 (4.87±1.21) %、(9.37±0.95) %、 (12.10±1.85) %、 (20.63±3.76) %。NC 组与siDNMT3a组比较具有统计学差异 (P =0.002 0);NC+GEM组与siDNMT3a+GEM组比较具有统计学差异 (P = 0.024 4) ,见图4。提示下调DNMT3a表达可以协同GEM诱导胰腺癌Panc-1细胞凋亡。
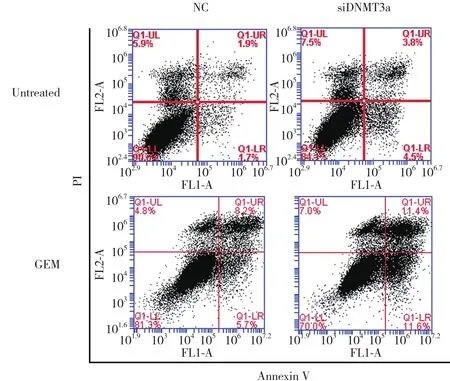
图4 下调DNMT3a增加GEM诱导Panc-1细胞凋亡Fig.4 Downregulation of DNMT3a expression enhanced apoptosis induced by GEM
3 讨论
DNMTs广泛存在于真核生物中,其作用是将甲基转移至启动子的CpG岛胞嘧啶上 5’碳端进行修饰,影响启动子的甲基化状态,进而在转录水平调控靶基因的表达。目前研究[10-11]认为DNA甲基化状态与多种疾病及恶性肿瘤的发生密切相关。启动子甲基化状态的改变具有可逆性,因而被用于恶性肿瘤的治疗。DNMT3a是DNMTs家族的成员之一,与DNMT1维持基因甲基化状态不同,它负责基因重新甲基化。在胰腺癌中存在DNMT3a过表达[12]。前期研究[13]发现DNMT3a可以通过CHK1及AKT通路影响胰腺癌化疗药物敏感性。鉴于DNMT3a从头甲基化作用广泛,因此推测DNMT3a对胰腺癌GEM敏感性的调控还可能存在其他机制。
GEM是一种广泛用于多种实体恶性肿瘤治疗的药物。BURRIS等[14]发现,与氟尿嘧啶比较,GEM在晚期胰腺癌治疗中具有更好的治疗效果。然而,GEM疗效却受到了原发或继发耐药限制。有研究[15]指出胰腺癌中多种信号通路的异常活化可能与GEM耐药相关。STAT3是STAT家族的重要成员之一,与肿瘤增殖、迁移、耐药等密切相关。STAT3通路受到细胞外细胞因子激活,作用于细胞核内靶基因,调控靶基因转录。VENKATASUBBARAO等[16]发现抑制STAT3通路活化可以增加胰腺癌GEM敏感性。本实验发现GEM可以诱导胰腺癌Panc-1细胞出现一过性STAT3通路活化,即p-STAT3表达上调。而下调DNMT3a表达可以明显抑制GEM诱导的p-STAT3蛋白表达。说明DNMT3a可能通过维持STAT3通路活化状态降低胰腺癌细胞对GEM的敏感性。
除此之外,胰腺癌细胞中对GEM转运及活性形式的转化水平也可能影响GEM敏感性。GEM需要进入细胞后在脱氧胞苷激酶作用下变成单磷酸核苷,后者在嘧啶核苷单磷酸激酶和核苷二磷酸激酶的分别作用下形成二磷酸核苷及三磷酸核苷,影响DNA合成,从而起到细胞毒性作用。其中,在脱氧胞苷激酶作用下变成单磷酸核苷过程被认为是GEM活性代谢过程中的重要限速过程[17]。而CDA能够使大部分进入细胞内的GEM去氨化,形成高浓度低活性的代谢产物双氟脱氧尿苷 (difluoro deoxyuridine,dFdU) ,进一步降低GEM细胞毒性,增加GEM耐药[18]。本实验发现GEM作用于胰腺癌Panc-1细胞6 h开始出现CDA蛋白表达上调,说明GEM可以自身引起内源性耐药产生。而下调DNMT3a表达可以明显抑制GEM诱导的CDA表达上调,促进GEM有效活化形式产生,并抑制胰腺癌细胞DNA合成。因此推测DNMT3a可能促进GEM发生细胞内非活性形式转化,进而降低胰腺癌细胞对GEM的敏感性。因此认为下调DNMT3a可以抑制STAT3通路活化并抑制CDA表达,抑制DNA合成导致胰腺癌细胞发生凋亡,从而抑制胰腺癌细胞增殖。
综上所述,DNMT3a在人胰腺癌Panc-1细胞中存在显著表达,且与GEM药物敏感性密切相关。下调DNMT3a表达能够明显增加GEM导致的胰腺癌细胞增殖抑制,并诱导细胞发生凋亡。下调DNMT3a一方面通过抑制GEM诱导的STAT3通路活化,另一方面通过抑制CDA蛋白表达,即促进胰腺癌细胞内GEM活性产物形成,来实现对GEM增敏作用。DNMT3a可能成为评判胰腺癌患者GEM敏感性的标志物,有望为胰腺癌的综合治疗提供新的策略。
