运动对动脉粥样硬化斑块逆转机制的研究进展
2018-10-15王帝之张培珍
王帝之,张培珍
《中国心血管病报告2017》显示,中国心血管疾病患病率及死亡率仍处于上升阶段,现患病人数约2.9亿人,心血管疾病死亡占居民疾病死亡构成40%以上,居首位[1]。目前,心血管疾病已成为重大的公共卫生问题,而动脉粥样硬化的控制与心血管疾病的防治息息相关。动脉粥样硬化是心血管疾病的主要病理基础,高血压、吸烟和高同型半胱氨酸血症等危险因素均会引起机体产生动脉粥样硬化[12],甚至由于母体的高胆固醇血症,最早在胎儿主动脉中就能观察到动脉粥样硬化的初级状态“脂质条纹”[28]。研究表明,动脉粥样硬化的发病机制是多因素的,因此,其治疗方法和斑块逆转能力是复杂的,动物模型和临床研究的数据表明,适度运动和补充抗氧化剂可以缓解动脉粥样硬化斑块发展的风险[11]。适当的运动可以减少心血管疾病和动脉粥样硬化的危险因素,预防疾病的发生,稳定疾病的发展趋势甚至逆转疾病发病状态。因此,研究运动对动脉粥样硬化的干预非常重要。
1 动脉粥样硬化的发病机制
研究表明,动脉粥样硬化是人体高氧化应激反应、炎症反应、免疫反应、脂质沉积和基因特质综合作用而引发的疾病[10,23],因此对动脉粥样硬化的发病机制和病理特点的研究十分重要,其发病机制可以总结为:1)由于低密度脂蛋白及其氧化形式(oxidized low density lipoprotein,oxLDL)在动脉内皮细胞层的沉积而引起炎症反应。2)多种类似于巨噬细胞集落刺激因子(macrophage colonystimulating factor,M-CSF)的趋化因子,吸引携带血管细胞粘附分子(vascular cell adhesion molecule,VCAM)、细胞间粘附分子-1(intercellular adhesion molecular-1,ICMA-1)和P选择素(P-selectin)的循环单核细胞和T淋巴细胞进入内皮细胞层,并渗透进入血管内膜。3)单核细胞分化为巨噬细胞,并进一步极化为M1或M2亚型,同时,它们通过表面清道夫受体(surface scavenger receptors)吞噬oxLDL,由于不能通过正常通路分解oxLDL,载满脂质的巨噬细胞最终变为泡沫细胞,在血管壁形成脂质条纹。4)平滑肌细胞(smooth muscle cells,SMCs)迁移进入细胞内膜,繁殖并产生炎症,形成最初的可肉眼看到的动脉粥样硬化斑块。5)随着斑块的生长,斑块细胞、泡沫细胞和平滑肌细胞凋亡,导致细胞外脂质沉积和细胞碎片共同形成坏死核心。在此之后,持续循环的细胞迁移,未解决的细胞炎症、细胞增殖和细胞凋亡共同导致斑块扩大。6)巨噬细胞为了减轻斑块负担,释放基质金属蛋白酶(matrix metalloproteases,MMPs)降解斑块组成成分,并降解纤维帽的组成成分之一胶原纤维。7)随着纤维帽的变薄和纤维帽中胶原-弹性蛋白比失衡,动脉粥样硬化斑块产生破裂。8)斑块破裂常发生于血管交界地带,导致血栓形成,从而阻塞血管,引发心血管疾病[5,10,11,23,28]。
随着科技的发展,将血管内超声(intravascular ultrasound,IVUS)用于临床监测冠状动脉粥样硬化程度和病理特点已越来越普及,IVUS可用于评估动脉粥样硬化的进程和逆转。根据美国心脏协会组织学分类,动脉粥样硬化斑块可分为以下几种:内膜内侧增厚、病理性内膜增厚、纤维化或纤维钙化、纤维粥样硬化或钙化纤维粥样硬化、薄帽状纤维粥样硬化(thin-capped fibroatheroma,TCFA)或钙化薄帽状纤维粥样硬化(calcified thin-capped fibroatheroma,CaTCFA),其中TCFA或CaTCFA是最高风险斑块[46]。
2 运动与动脉粥样硬化斑块逆转
临床上动脉粥样硬化病灶与血管出血、钙化、阻塞和血栓形成相关,动脉粥样硬化会引发包括心绞痛、急性心肌梗塞和心源性猝死在内的突发性临床事件。因此,研究不同干预手段对病情的影响十分重要。最初在1981年,Kramsch等[19]发现,运动可预防并减少摄入动脉粥样硬化饮食猴子的冠状动脉粥样硬化程度,他认为适度锻炼可以预防或延缓灵长类动物的冠心病,随后的其他动物研究也支持运动具有抗动脉粥样硬化作用的观点[4]。随着科学诊断技术不断发展,人们对冠心病有了更加深入的了解,科学家们开始使用冠状动脉造影技术研究动脉粥样硬化,并且不仅想要探索冠心病和动脉粥样硬化病情的预防和稳定,还想通过一些干预手段来逆转病情,使动脉粥样硬化斑块逆转。
1990年,Ornish等人[30]进行了第一个探讨单纯生活方式改变是否引起冠状动脉粥样硬化逆转的临床随机对照试验,研究非药物干预下的斑块逆转的状态。受试者进行了为期12个月的全面多因素生活方式改变,包括低脂素食、中等强度有氧运动、压力管理训练、戒烟和团体支持,实验要求受试者在目标心率内锻炼,每周至少3 h,每次至少30 min。一年后,通过定量冠状动脉造影测量,82%的实验组受试者动脉粥样硬化病灶有逆转改善的趋势。因此,全面的生活方式改变可以在不使用降脂药物的前提下,在仅1年时间内逆转动脉粥样硬化病灶。
实验证明,运动可以阻止斑块生长,并且诱导冠状动脉管壁狭窄程度得到逆转,运动具有抗动脉粥样硬化作用[42]。但是早期大部分研究对象是发生心血管疾病、肥胖和2型糖尿病的患者,所以,在给予运动干预的时候难以避免要使用药物干预。因此,大部分干预手段都是研究运动与药物治疗、或生活方式改变(主要是有氧运动)与药物治疗对动脉粥样硬化斑块逆转的影响,主要的药物有抗氧化剂和脂质/脂蛋白改善药物,包括槲皮素[11]、普伐他汀[43]、L-精氨酸[29]等。大量研究结果表明,运动与药物共同干预是动脉粥样硬化病灶发生逆转的有效途径,但是Ornish等人[30]的研究提出,生活方式改变引起的血脂水平变化与降胆固醇药物具有相似的效果,但生活方式干预更安全和可接受。这为相关的研究提供了一个新的角度,药物治疗可能带来一系列的副作用,导致有害物质在身体内的堆积,而适度运动本身就具有与大部分药物相似的作用,例如,抗氧化、抗炎症和降血脂的作用。因此,研究运动是如何影响机体的动脉粥样硬化斑块发生改变,通过哪些机制改变就成为了新的研究热点。
从近20年的实验研究中可以看出,运动对动脉粥样硬化斑块逆转的影响,主要集中于运动对血脂改善、氧化应激反应、炎症反应、斑块扩大和破裂的影响,以及运动与斑块逆转的“剂量-反应关系”这5方面,探讨了运动在斑块逆转过程中,对机体产生了哪些正面的影响,以及运动干预后斑块的形态学和组成成分都发生了哪些逆转。
2.1 血脂改善与斑块逆转
早些年,由于病理知识和诊断技术的匮乏,人们认为心外膜冠状动脉狭窄程度主要决定于心肌营养和氧气供应,因此降低血脂水平从而逆转动脉狭窄程度,一直被认为是治疗冠状动脉粥样硬化的目标。规律的运动可以调节人体的血脂水平,人们最初对运动和动脉粥样硬化逆转的探索,只是简单地从运动改善人体血脂水平的角度出发。早在1996年,Franklin等人[8]指出,使用脂质/脂蛋白改善药物、运动训练、低脂低胆固醇饮食、减轻压力或以上几种干预的组合,会推迟动脉粥样硬化的进展,甚至逆转动脉粥样硬化病灶,运动在协调葡萄糖和脂质代谢过程中起着核心作用。因此,血脂管理是动脉粥样硬化治疗、预防和逆转病情中必不可少的一步。
大量证据支持药物和运动干预后,人体内的血脂水平和脂代谢会得到不同程度上的改善并趋于正常水平,这些证据包括:干预后人体血清总胆固醇含量和低密度脂蛋白水平下降,高密度脂蛋白水平升高,载脂蛋白AI(apoAI)增加,载脂蛋白B(apoB)降低,apoB/apoAI降低,胆固醇逆转运脂蛋白基因和抗炎因子基因激活引发脂质代谢改善[43]等。
由于诊断技术的限制,早期对于动脉粥样硬化斑块逆转机制的探讨,大多局限于管腔狭窄的逆转和血脂水平的改善。1999年,Gabriel等人[9]在文章中探讨了运动对动脉粥样硬化的影响,在前人研究的基础上,创新性地讨论了运动的抗动脉粥样硬化斑块病灶能力以及运动诱导斑块病灶逆转的能力。他认为富含脂质的巨噬细胞聚集形成脂质条纹,是动脉粥样硬化最早在显微镜下可见的状态,运动可以通过调节单核细胞和T淋巴细胞对脂质条纹产生影响。但是由于技术限制,并没有充足的证据可以支撑他的观点,他建议今后的研究从细胞学和分子学角度更深一步地研究运动与动脉粥样硬化的关系,打破了以往研究对于运动和动脉粥样硬化的认知,提供了一个新的研究角度。
随着人们对动脉粥样硬化发病机制的进一步了解,以及诊断技术的不断发展,斑块逆转的研究变得更加成熟。动脉粥样硬化逆转包括两个方面:1)斑块面积缩小,2)斑块的稳定性增加[2]。斑块逆转不仅存在于动脉管腔和斑块大小的改变,更存在于动脉粥样硬化形成的每一步中,是斑块形态学和组成成分的共同改变,是斑块从较容易破裂的表现型,向较不容易破裂的表现型发展的一个过程。
2.2 氧化应激反应与斑块逆转
众所周知,作为维持血管稳态的主要调节因子,内皮细胞维持着血管依赖性收缩功能和舒张功能的平衡,抑制和刺激平滑肌细胞增殖和迁移,以及血栓形成和纤维蛋白溶解,当这种平衡紊乱时,会发生内皮功能障碍,从而导致动脉血管壁受损[6]。人们普遍认为,动脉粥样硬化发病机制中的早期病变特征就是内皮细胞功能障碍,表现为:1)内皮介导的血管舒张功能降低;2)内皮细胞更新增强;3)内皮细胞的粘附分子和其他炎症基因的表达增加;4)氧化应激增加;5)内皮屏障的渗透特性增加等等[21]。
研究表明,正常健康的内皮细胞自身就有抗动脉粥样硬化的调节机制[45]。但是不运动或者静坐少动的生活方式被认为是导致动脉粥样硬化和心血管并发症中代谢紊乱发生的独立危险因素,会刺激内膜过度氧化[3]。随着年龄的增加,人的内皮依赖性血管舒张功能会逐渐下降,而规律的有氧运动可以维持并减缓内皮依赖性血管舒张功能下降的趋势[7]。研究表明,在患有冠状动脉疾病的人中,运动训练逆转了内皮细胞功能障碍[14]。运动也可以减少动脉壁中的超氧化物产生,增强抗氧化能力并逆转胶原含量,降低oxLDL形成和动脉内膜中巨噬细胞积聚的可能性[5,38]。总而言之,运动通过调节机体的氧化应激反应,逆转失衡的内皮依赖性收缩和舒张功能,减少内皮细胞功能障碍的程度,从而逆转动脉粥样硬化。
在运动过程中,心输出量增加,血液在动脉壁的内皮细胞表面上产生纵向应力,并诱导内皮依赖性血管舒张,流向骨骼肌的血液增加,这种纵向应力称为内皮细胞剪切应力(endothelial shear stress,ESS)。运动诱导内皮细胞产生高剪切应力,通过降低细胞表面粘附分子,激活内皮型一氧化氮合酶(endothelial NO synthase,eNOS)磷酸化通路产生一氧化氮(nitric oxide,NO)以及降低血管紧张素II的1型受体3条途径来产生有益的心血管效应,从而达到抗动脉粥样硬化的作用。
细胞粘附分子(cell adhesion molecules,CAMs)是单核细胞附着于内皮细胞的关键参与者[33]。血流紊乱或低剪切应力会诱导粘附分子(细胞内粘附分子-1,血管细胞粘附分子-1)增加,趋化因子(单核细胞趋化蛋白-1、白细胞介素)增加,白细胞募集和浸润增加,这是斑块形成的早期过程[37]。研究表明,细胞粘附分子的粘附性可以通过增加剪切压力和运动训练来降低,运动可以降低细胞内皮素-1(endothefin,ET-1)和血管细胞粘附分子-1(VCAM-1)[21]、粘附分子MAC-1和VLA-4[33]、细胞间粘附分子-1(ICMA-1)的表达[38],从而保护内皮功能,减少单核细胞粘附和趋化性。
大量研究表明,剪切应力引起的血管舒张主要是围绕着NO和氧化应激之间的平衡展开的。剪切应力通过机械感受器刺激内皮细胞膜,高剪切应力会引起机体的蛋白激酶B(protein kinase B,又称Akt)含量增加,Akt通过Akt/eNOS通路,诱导eNOS磷酸化,增加eNOS活性,增加NO生物利用度[20,45]。而冠状血管舒张功能主要依赖于一氧化氮的生物利用度,NO作为一种重要的内源性血管扩张剂,还可以抑制血管平滑肌细胞增殖和血栓形成[38],抑制低密度脂蛋白的氧化[6],同时有利于内皮细胞存活。运动产生的高剪切应力,通过NO调节内皮依赖性舒张功能,从而稳定和逆转动脉粥样硬化斑块。
由久坐的生活方式引起的低剪切应力不能刺激Akt/eNOS通路产生足够的NO,并促进烟酰胺腺嘌呤二核苷酸磷酸(nicotinamideadeninedinucleotidephosphate,NADPH)氧化酶亚基的上调,增加p47亚基转移至膜,导致NADPH氧化酶活性增加[42],在不活动的小鼠体内[20]和冠状动脉疾病患者的冠状动脉中[40]均可发现,NADPH氧化酶的活性增加,从而增加了血管活性氧簇(reactive oxygen species,ROS)的产生,ROS引起机体氧化应激,产生的氧自由基影响NO合成酶的活性并与NO反应,快速使NO失活从而降低NO的生物利用度,导致血管的舒张功能降低。氧自由基生成和分解之间的微妙平衡受到酶促抗氧化系统(超氧化物歧化酶和过氧化氢酶等)的调节,该系统可以降低机体的氧化应激反应,保护细胞免受ROS的侵袭[22]。当ROS和NO之间的平衡被破坏,就会引起内皮细胞功能紊乱,加速动脉粥样硬化病灶的形成。大量临床和实验研究证明了规律的体力活动通过增加血管剪切应力使eNOS磷酸化,增加脉管系统中NO释放和超氧化物歧化酶活性,降低NADPH氧化酶和ROS,重新调整了NO产生和NO失活之间的平衡,使冠状动脉内皮的抗氧化作用增加并产生内皮依赖性舒张,有效地改善机体氧化应激,从而逆转动脉粥样硬化[13,15,20,45]。
内源性血管紧张素II(angiotensin II,AngII)是机体内促进血管收缩的主要物质。在血管壁中,血管紧张素II不仅在平滑肌细胞表面通过与AngII的1型受体(angiotensin II type 1 receptors,AT1R)结合直接产生血管收缩作用,而且通过激活NADPH氧化酶而增加ROS的数量,促进炎症和动脉粥样硬化。运动激活剪切应力,降低内皮细胞AT1R表达,减少内皮依赖性血管收缩功能,起到抗动脉粥样硬化作用[2,28,22,33]。
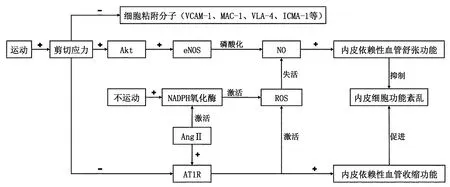
图1 运动对氧化应激的影响Figure 1 Effect of Exercise on Oxidative Stress
2.3 炎症反应与斑块逆转
大量研究表明,慢性全身性炎症促进动脉粥样硬化和内皮功能障碍的发生。动脉粥样硬化是由巨噬细胞介导的炎症性病变,静坐少动的生活方式引起代谢紊乱,导致脂肪组织与浸润性巨噬细胞聚集在动脉斑块中,并释放导致损伤的肿瘤坏死因子α(tumor necrosis factor α,TNF-α)。循环中的TNF-α会直接对机体产生多种影响,如胰岛素抵抗、氧化应激、内皮功能紊乱、血管损伤和斑块破裂[34,39]。研究表明,12周的高强度有氧训练可减少健康成人血液中由脂多糖(lipopolysaccharide,LPS)刺激单核细胞引发的TNF-α释放[39],运动可通过阻止TNF-α过量释放而起到抗动脉粥样硬化作用。
另一方面,单核细胞在与特定刺激物(如Th1和Th2细胞因子)接触后可分化为两种巨噬细胞亚型。Th1细胞因子诱导单核细胞分化成促炎M1型巨噬细胞,M1型巨噬细胞杀死微生物和肿瘤细胞,并产生TNF-α等促炎症细胞因子。Th2细胞因子诱导单核细胞分化成抗炎M2型巨噬细胞,M2型巨噬细胞产生抗炎介质如IL-10、IL-1ra和转化生长因子-β(transforming growth factor-β,TGF-β)来抑制炎症和适应性Th1反应,清除组织碎片并促进血管生成、组织重塑和修复。动脉粥样硬化这类炎症性疾病,不仅可能由持续的M1型巨噬细胞促炎症反应引起,还可能由M2型巨噬细胞抗炎症控制机制的失败引起[25,42]。巨噬细胞有一定的功能可塑性,具有在M1和M2型激活状态之间转换的能力[36],所以运动可以调节巨噬细胞的亚型。研究表明,低强度运动,每周3次步行10000步[48],可以促进M2型巨噬细胞极化,增加M2特异性标志物以及减少M1特异性标志物和Th1特异性细胞因子,这表明运动减少了由M1型巨噬细胞引起的促炎症功能,增加了M2型巨噬细胞介导的抗炎症功能,为机体提供了良好的抗炎症环境,从而逆转了由于巨噬细胞亚型引起的动脉粥样硬化的炎症反应。
研究表明,规律运动可以控制慢性低度全身炎症性疾病,可以通过减少内脏脂肪,在运动后诱导机体产生消炎环境来产生抗炎作用。近些年来,运动对动脉粥样硬化逆转的研究更多地转移到对骨骼肌的关注上,运动过程中肌纤维产生细胞因子白细胞介素6(interleukin 6,IL-6)引发的抗炎反应。IL-6在循环系统中刺激其他抗炎细胞因子如IL-1ra和IL-10的产生,并抑制促炎因子TNF-α产生,这些抗炎细胞因子可以增加胰岛素敏感性,增强脂质转换,刺激脂肪分解以及脂肪氧化,并抑制脂肪组织和巨噬细胞产生TNF-α[34]。而Pedersen等人[31]认为,收缩的骨骼肌是一种新的内分泌器官,它释放出具有抗炎作用的“肌动蛋白”激素,肌动蛋白对内脏脂肪和其他异位脂肪沉积物施加特定的内分泌作用,促进脂肪氧化,为运动影响新陈代谢并发挥抗炎作用的机制提供了新的概念。
2.4 运动可有效防止斑块扩大和破裂
内源性血管紧张素II为强效血管收缩剂,能引起小动脉收缩。血管紧张素II可能通过影响促炎性趋化因子的表达,影响巨噬细胞向血管壁的募集和活化,研究表明,AngII通过增加单核细胞趋化蛋白-1的表达,使Th1型淋巴细胞通过激活巨噬细胞并在“损伤”部位募集吞噬细胞参与炎症的调节。在独立于其血流动力学效应的前提下,血管紧张素II通过激活淋巴细胞向促炎性Th1型转化,诱导斑块从比较稳定的状态向破裂转变[26]。较大的斑块负荷和较低的局部内皮剪切应力同样会促进动脉粥样硬化斑块扩大和血管内腔狭窄[41]。巨噬细胞释放过量的TNF-α也会引发动脉壁的炎性反应和斑块破裂[44]。
脆弱的斑块有许多组织学特征,包括胶原蛋白和弹性蛋白含量减少,平滑肌细胞数量少,较大的坏死核心,巨噬细胞过度积累和纤维帽变薄等[17]。而运动通过减少斑块负荷,增厚纤维帽,降低血管膜外层炎症反应,减少主动脉斑块中的炎性巨噬细胞含量,增加平滑肌细胞含量等途径防止动脉粥样硬化斑块破裂[32]。
运动防止动脉粥样硬化斑块扩大和破裂的作用,主要表现在基质金属蛋白酶和胆固醇的逆向转运(reverse cholesterol transport,RCT)两方面。基质金属蛋白酶(MMPs)会降解斑块中的胶原蛋白,导致斑块中胶原-弹性蛋白比失衡,诱导动脉粥样硬化斑块破裂。在自发性高血压大鼠模型中,尽管运动组与安静组之间缺乏显著性,但运动组大鼠比安静组要多40%的弹性蛋白,这表明运动逆转了弹性蛋白的消耗[27]。在小鼠实验中,运动降低了血浆金属蛋白酶MMP-2、MMP-3、MMP-8以及MMP-9活性,增加了血浆基质金属蛋白酶的组织抑制剂(tissue inhibitor of matrix metalloproteinase,TIMP)的活性,显著增加动脉粥样硬化斑块中胶原蛋白和弹性蛋白,降低了斑块中巨噬细胞浓度,增加纤维帽厚度,减少内膜弹性层破裂,减少动脉粥样硬化斑块大小[17,18]。
另一方面,运动可能通过胆固醇逆向转运和脂蛋白清除来达到其抗动脉粥样硬化作用。胆固醇逆向转运[35]是一种抗动脉粥样硬化机制,可以将动脉巨噬细胞中的胆固醇转移到肝脏排泄至胆汁和粪便中,运动加速了胆固醇从巨噬细胞向肝脏的运输。运动2周的小鼠[47]肝脏显示出清道夫受体B1(scavenger receptor B1,SR-B1)和低密度脂蛋白受体急剧增加以及乙酰LDL受体基因表达的降低。因此,运动可以通过胆固醇逆向转运来预防和逆转动脉粥样硬化。
2.5 运动与斑块逆转的“剂量-反应关系”
规律的体力活动在抗动脉粥样硬化过程中(如动脉壁重塑、调节斑块大小和巨噬细胞功能)赋予多种多效性效应。运动干预作用的大小与运动项目、运动强度和运动频率有关。总体而言,规律的低/中等强度有氧运动有助于减少动脉粥样硬化的发病率[5]。早在1993年,Hambrecht等人[16]就开始了对逆转动脉粥样硬化斑块的运动强度的研究,研究结果表明,实现冠状动脉粥样硬化的逆转在体力活动方面要求很高,每周至少花费1 500 kcal才可以控制动脉粥样硬化进程,并且每周5~6 h的大强度运动,运动量达到2 200 kcal时才会诱导动脉粥样硬化斑块狭窄发生逆转。Madssen等人[24]研究了不同运动训练方案对斑块逆转的影响,结果显示在有氧间歇运动和中等强度运动的患者之间,冠状动脉斑块结构或形态的改变没有明显差异,但是常规有氧运动和药物治疗联合干预12周,可诱导血管内超声定义的冠状动脉病灶中的坏死核心和斑块负荷的中度逆转。目前为止,可以肯定的是,运动肯定会在一定程度上逆转动脉粥样硬化斑块,但是对于什么运动类型、强度、频率才能促使动脉粥样硬化斑块逆转还没有定论,值得更深一步的探讨。
3 小结
运动逆转动脉粥样硬化斑块的机制是复杂的,大量的运动和斑块逆转的研究都存在以下这些问题:1)干预手段过多,少有文章单独探讨运动和斑块逆转的直接关系;2)由于诊断技术的限制,大多数分子学机理研究都是以动物为研究对象,并不能直接应用在人体上;3)多数对运动和斑块逆转关系的实验研究,仅从一个或者几个斑块逆转角度进行机制探讨,缺少系统归纳以及对不同生物因子之间相互作用的研究。
随着诊断技术和科学研究的不断发展,人们对于斑块逆转的机制也在不断的完善,运动对动脉粥样硬化斑块逆转产生影响的途径也在不断发展,从最初的调节血脂代谢和逆转动脉狭窄,到调节氧化应激、炎症反应,阻止斑块扩大和破裂,再到至今仍然存有争议的运动与斑块逆转的“剂量-反应关系”,研究内容在不断扩展,促使动脉粥样硬化斑块逆转的运动类型、运动强度、运动频率及其机制,有待进一步的探究。
[1]陈伟伟,高润霖,刘力生,等.《中国心血管病报告2017》概要[J].中国循环杂志,2018,33(1):1-8.
[2]王姗,孙桂波,罗云,等.动脉粥样硬化斑块逆转的研究进展[J].中国药理学通报,2016,32(8):1059-1063.
[3]BOOTH F W,LAVE M J,LEES S J,et al.Reduced physical activity and risk of chronic disease:the biology behind the consequences[J].Eur J Appl Physiol,2008,102(4):381-390.
[4]CESAR L,SUAREZ S V,ADI J,et al.An essential role for diet in exercise-mediated protection against dyslipidemia,inflammation and atherosclerosis in ApoE(-)/(-)mice[J].Plos One,2011,6(2):e17263.
[5]CHERNYAVSKIY I,VEERANKI S,SEN U,et al.Atherogenesis:hyperhomocysteinemia interactions with LDL,macrophage function,paraoxonase 1,and exercise[J].Ann N YAcad Sci,2016,1363(1):138-154.
[6]DAVIGNON J,GANZ P.Role of endothelial dysfunction in atherosclerosis[J].Circulation,2004,109(23 Suppl 1):III27-32.
[7]DESOUZA C A,SHAPIRO L F,CLEVENGER C M,et al.Regularaerobic exercise prevents and restores age-related declines in endothelium-dependent vasodilation in healthy men[J].Circulation,2000,102(12):1351-1357.
[8]FRANKLIN B A,KAHN J K.Delayed progression or regression of coronary atherosclerosis with intensive risk factor modification.Effects of diet,drugs,and exercise[J].Sports Med,1996,22(5):306-320.
[9]GABRIEL H H,HEINE G,KROGER K,et al.Exercise and atherogenesis:where is the missing link?[J].Exe Immunol Rev,1999,5(4):96-102.
[10]GALKINA E,LEY K.Immune and inflammatory mechanisms of atherosclerosis[J].AnnuRevImmunol,2009,27(Suppl1):165-197.
[11]GARELNABI M,MAHINI H,WILSON T.Quercetin intake with exercise modulates lipoprotein metabolism and reduces atherosclerosis plaque formation[J].J Int Soc Sports Nutr,2014,11(1):22-28.
[12]GLASS C K,WITZTUM J L.Atherosclerosis:the road ahead[J].Cell,2001,104(4):503-516.
[13]GREEN D J,MAIORANA A,O'DRISCOLL G,et al.Effect of exercise training on endothelium-derived nitric oxide function in humans[J].J Physiol,2004,561(1):1-25.
[14]HAMBRECHT R,WOLF A,GIELEN S,et al.Effect of exercise on coronary endothelial function in patients with coronary artery disease[J].N Engl J Med,2000,342(7):454-460.
[15]HAMBRECHT R,ADAMS V,ERBS S,et al.Regular physical activity improves endothelial function in patients with coronary artery disease by increasing phosphorylation of endothelial nitric oxide synthase[J].Circulation,2003,107(25):3152-3158.
[16]HAMBRECHT R,NIEBAUER J,MARBURGER C,et al.Various intensities of leisure time physical activity in patients with coronary artery disease:Effects on cardiorespiratory fitness and progression of coronary atherosclerotic lesions[J].J Am Coll Cardiol,1993,22(2):468-477.
[17]KADOGLOU N P,KOSTOMITSOPOULOUS N,KAPELOUZOU A,et al.Effects of exercise training on the severity and composition of atherosclerotic plaque in apoE-deficient mice[J].J Vasc Res,2011,48(4):347-356.
[18]KADOGLOU NP,MOUSTARDAS P,KAPELOUZOU A,et al.Theanti-inflammatory effectsofexercise training promote atherosclerotic plaque stabilization in apolipoprotein E knockout mice with diabetic atherosclerosis[J].Eur J Histochem,2013,57(1):16-23.
[19]KRAMSCH D M,ASPEN A J,ABRAMOITZ B M,et al.Reduction of coronary atherosclerosis by moderate conditioning exercise in monkeys on an atherogenicdiet[J].N Engl J Med,1981,305(25):1483-1489.
[20]LAUFS U,WASSMANN S,CZECH T,et al.Physical inactivity increases oxidative stress, endothelial dysfunction, and atherosclerosis[J].Arterioscler Thromb Vasc Biol,2005,25(4):809-814.
[21]LAUGHLIN M H,EWCOMER SC,BENDER S B.Importance of hemodynamic forces as signals for exercise-induced changes in endothelial cell phenotype[J].J Appl Physiol,2008,104(3):588-600.
[22]LINKE A,ERBS S,HAMBRECHT R.Exercise and the coronary circulation-alterations and adaptations in coronary artery disease[J].Prog Cardiovasc Dis,2006,48(4):270-284.
[23]LUSIS AJ,MAR R,PAJUKANTA P.Genetics of atherosclerosis[J].Annu Rev Genomics Hum Genet,2004,5:189-218.
[24]MADSSEN E,MOHOLDT T,VIDEM V,et al.Coronary atheromaregression and plaque characteristicsassessed by grayscale and radiofrequency intravascularultrasound after aerobic exercise[J].Am J Cardiol,2014,114(10):1504-1511.
[25]MANTOVANI A,SICA A,SOZZANI S,et al.The chemokine system in diverse forms of macrophage activation and polarization[J].Trends Immunol,2004,25(12):677-686.
[26]MAZZOLAIL,DUCHOSALMA,KORBERM,etal.Endogenous angiotensin II induces atherosclerotic plaque vulnerability and elicits a Th1 response in ApoE-/-mice[J].Hypertension,2004,44(3):277-282.
[27]MORAES-TEIXEIRA JDA,FELIX A,FERNANDES-SANTOS C,et al.Exercise training enhances elastin,fibrillin and nitric oxide in the aorta wall of spontaneously hypertensive rats[J].Exp Mol Pathol,2010,89(3):351-357.
[28]NAPOLI C,D'ARMIENTO F P,MANCINI F P,et al.Fatty streak formation occurs in human fetal aortas and is greatly enhanced by maternal hypercholesterolemia.Intimalaccumulation oflow density lipoprotein and its oxidation precede monocyte recruitment into early atherosclerotic lesions[J].J Clin Invest,1997,100(11):2680-2690.
[29]NAPOLI C,WILLIAMS-IGNARRO S,NIGRIS F D,et al.Physical training and metabolic supplementation reduce spontaneous atherosclerotic plaque rupture and prolong survival in hypercholesterolemic mice[J].Proc Natl Acad Sci USA,2006,103(27):10479-10484.
[30]ORNISH D,BROWN S E,SCHERWITZ L W,et al.Can lifestyle changes reverse coronary heart disease?The Lifestyle Heart Trial[J].Lancet,1990,336(8708):129-133.
[31]PEDERSEN B K.The diseasome of physical inactivity-and the role of myokines in muscle-fat cross talk[J].J Appl Physiol,2010,587(23):5559-5568.
[32]PELLEGRIN M,ALONSO F,AUBERT J F,et al.Swimming prevents vulnerable atherosclerotic plaque development in hypertensive 2-kidney,1-clip mice by modulating angiotensin II type 1 receptor expression independently from hemodynamic changes[J].Hypertension,2009,53(5):782-789.
[33]PESCHEL T,SIXT S,BEITZ F,et al.High,but not moderate frequency and duration of exercise training induces downregulation of the expression of inflammatory and atherogenic adhesion molecules[J].Eur J Cardiovasc Prev Rehabil,2007,14(3):476-482.
[34]PETERSEN A M,PEDERSEN B K.The anti-inflammatory effect of exercise[J].JAppl Physiol,2005,98(4):1154-1162.
[35]PINTO P R,ROCCO D D,OKUDA L S,et al.Aerobic exercise training enhancesthe in vivo cholesteroltrafficking from macrophages to theliver independently of changes in the expression of genes involved in lipid flux in macrophages and aorta[J].Lipids Health Dis,2015,14(1):1-12.
[36]PORCHERAY F,VIAUD S,RIMANIO A C,et al.Macrophage activation switching:an asset for the resolution of inflammation[J].Clin Exp Immunol,2010,142(3):481-489.
[37]RAMKHELAWON B,VILAR J,RIVAS D,et al.Shear Stress Regulates Angiotensin Type 1 Receptor Expression in Endothelial Cells[J].Circ Res,2009,105(9):869-875.
[38]SHIMADA K,MIKAMI Y,MURAYAMA T,et al.Atherosclerotic plaques induced by marble-burying behavior are stabilized by exercise training in experimental atherosclerosis[J].Int J Cardiol,2011,151(3):284-289.
[39]SLOAN R P,SHAPIRO P A,DEMEERSMAN R E,et al.Aerobic exercise attenuates inducible TNF production in humans[J].J Appl Physiol,2007,103(3):1007-1011.
[40]SPIEKERMANN S,LANDMESSER U,DIKALOV S,et al.Electron spin resonance characterization of vascular xanthine and NAD(P)H oxidase activity in patients with coronary artery disease: relation to endothelium-dependent vasodilation[J].Circulation,2003,107(10):1383-1389.
[41]STONE P H,SAITO S,TAKAHASHI S,et al.Prediction of progression of coronary artery disease and clinical outcomes using vascular profiling of endothelial shear stress and arterial plaque characteristics:the PREDICTION Study[J].Circulation,2013,127(10):172-181.
[42]SZOSTAK J,LAURANT P.The forgotten face of regular physical exercise:a'natural'anti-atherogenic activity[J].Clin Sci,2011,121(3):91-106.
[43]TANI S,NAGAO K,ANAZAWA T,et al.Coronary plaque regression and lifestyle modification in patients treated with pravastatin.-Assessment mainly by daily aerobic exercise and an increase in the serum level of high-density lipoprotein cholesterol[J].Circ J,2010,74(5):954-961.
[44]UZUI H,HARPF A,LIU M,et al.Increased expression of membrane type 3-matrix metalloproteinase in human atherosclerotic plaque:role of activated macrophages and inflammatory cytokines[J].Circulation,2002,106(24):3024-3030.
[45]VANE J R,ANGGARD E E.Regulatory functions of the vascular endothelium[J].N Engl J Med,1990,323(1):27-36.
[46]VIRMANI R,KOLODGIE F D,BURKE A P,et al.Lessons from sudden coronary death:a comprehensive morphological classification scheme for atherosclerotic lesions[J].Arterioscler Thromb Vasc Biol,2000,20(5):1262-1275.
[47]WEI C,PENUMETCHA M,SANTANAM N,et al.Exercise mightfavor reverse cholesterol transport and lipoprotein clearance: Potential mechanism for its anti-atherosclerotic effects[J].Biochim BiophysActa,2005,1723(1):124-127.
[48]YAKEU G,BUTCHER L,ISA S,et al.Low-intensity exercise enhances expression of markers of alternative activation in circulating leukocytes:roles of PPARγ and Th2 cytokines[J].Atherosclerosis,2010,212(2):668-673.
