高强度间歇训练通过不同部位HSL磷酸化差异性激活减少内脏脂肪积累的机制研究
2018-10-15梅佳顺何玉秀
刘 阳,梅佳顺,何玉秀
肥胖威胁人类健康,腹部内脏脂肪大量蓄积与脂肪肝、高血压、2型糖尿病关系密切[10,20,19]。由于40%~60%摄氧量强度运动的脂肪供能比例较大,传统观点认为,持续较长时间的中等强度持续训练(Moderate-intensity Continuous Training,MICT)是最佳的减肥运动方案。MICT可以降低腹部内脏脂肪重量,但必须达到较高的运动量才能有明显的效果[18]。近年来多项研究表明,完成相同运动量时,90%摄氧量以上强度的高强度间歇训练(high intensity interval training,HIIT)与MICT对皮下脂肪的减少效果没有显著差异,但HIIT能减少更多的腹部内脏脂肪[18,29],其内在机制如何尚无定论。已知腹部内脏脂肪对促脂解类激素的敏感性更高[5],即使在运动量相同的条件下,HIIT由于运动强度较高,对机体的骨骼肌、神经、内分泌和免疫系统会造成极大的应激,在此高应激状态下,如儿茶酚胺、生长激素、鸢尾素等脂解类激素和细胞因子会大量分泌,这可能是HIIT对腹部内脏脂肪的减重效果更明显的内在机制。
脂肪的分解过程分为甘油三酯水解为甘油和游离脂肪酸的“脂肪动员”阶段和彻底氧化成水和二氧化碳的脂肪氧化阶段。其中,HSL是脂肪动员阶段的关键限速酶之一。HSL的脂肪水解活性可以被儿茶酚胺等脂解类激素通过cAMP-PKA通路激活,加速脂肪水解,而AMP依赖蛋白激 酶 (Adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK)可抑制其活性[1]。2017年Nature上的一篇研究指出[3],巨噬细胞向脂肪细胞释放的儿茶酚胺可能是促进脂肪分解的重要因素,同年Nature Medicine上的一篇研究指出[4],脂肪分解产热的主要动力来自交感神经向脂肪组织释放的儿茶酚胺递质。脂解类激素促进机体减肥的作用机制,已经成为当前的研究热点。
Gaidhu研究发现,小鼠经过高脂膳食饲养后,提取腹股沟(皮下)和附睾(内脏)脂肪细胞,加入了儿茶酚胺和cAMP-PKA激动剂forskolin后,附睾脂肪细胞HSL的丝氨酸位点HSLser563和ser660被磷酸化,HSL水解活性升高,但腹股沟脂肪细胞HSL却并没有出现磷酸化现象[6]。这提示腹部内脏脂肪对脂解激素激活的cAMP-PKA磷酸化更为敏感。本研究对c57bl/6小鼠进行高脂膳食饲养,建立肥胖小鼠动物模型,之后对其进行12周的HIIT和MICT训练,观察小鼠皮下和内脏脂肪细胞形态、重量、HSL蛋白表达和ser563、565和660位点磷酸化情况,探讨HIIT与MICT对HSL激活的部位性差异性和磷酸化位点差异性,试图从脂肪水解的角度,揭示HIIT更显著减少内脏脂肪积累的内在机制,为科学制定减肥运动处方提供理论依据。
1 研究对象与方法
1.1 研究对象
2017年关于HIIT训练效果的一篇Meta分析的研究指出,HIIT的减脂效果与性别无关[14],且本研究团队前期进行了大量女性大学生HIIT减肥效果研究,故本研究采用雌性c57bl/6小鼠作为实验对象。3周龄小鼠(体重9.67±1.12g)购买于北京维通利华实验动物技术有限公司。自然光照饲养,温度24.0±2.0℃,湿度45%~55%,自由饮水、摄食,并记录摄食量。
1.2 肥胖动物模型建立
1周适应性喂养后,随机选取10只小鼠作为普通膳食对照组(C组),其余为肥胖建模组(H组)。C组给予标准动物饲料,H组给予高脂饲料(60%标准饲料+白砂糖16%+5%猪油+18%蛋黄粉+1%胆酸钠)。15周饲养后,选取H组体重于C组体重均值10%以上的36只小鼠作为肥胖动物,并随机分为高脂膳食对照组(HFD组,n=6只)、中等强度持续训练组(MICT组,n=6只)和高强度间歇训练组(HIIT组,n=6只)。HFD组高脂饲养,无训练;MICT组和HIIT组在高脂饲养的同时,分别进行12周的MICT训练和HIIT训练。饲养和训练期间严格测量并记录摄食量、体重和身长,根据“(体重1/3)/身长×1000”的公式计算代表小鼠肥胖程度的Lee’s指数(体重单位为g,身长单位为cm)。
1.3 训练方案
MICT和HIIT小鼠采用动物跑台进行25°上坡运动干预。3天适应性训练后进行正式训练,每周训练5天,休息2天。MICT组运动时间45 min,第1周跑速13 m/min。由于小鼠自身的生长发育,同样摄氧量强度下,跑速会有所提升,所以随着训练进展,调整跑速(每周的速度见表1,依据Høydal MA的研究[11],此方案运动强度始终约为60%最大摄氧量)。HIIT组小鼠的训练方案参考据Hoshino D的方案[8]制定,进行数组间歇训练,每组中包括1min高强度运动(约100%最大摄氧量强度)和2min低强度运动(约60%最大摄氧量强度),并通过控制重复组数,保证HIIT组奔跑距离与MICT相等。(注:在比对HIIT和MICT的训练效果时,人体试验常采用功率车计算对外做功[30]。但动物研究无法实现,故本实验控制HIIT组和MICT的奔跑距离相同,尽可能保证一致的运动量。)在5天训练的第1天,进行1次递增负荷测试,以确定HIIT组在此后两周内,100%最大摄氧量强度下的跑速。依据Høydal MA的研究,确定递增负荷试验的初始速度为7 m/min,跑台坡度25°,每2 min递增2 m/min,直到小鼠在驱赶条件下不能完成测试为止。

表1 训练时各组跑动速度Table 1 Running Speed during Training (m/min)

图1 MICT与HIIT组训练方案Figure1.MICT and HIIT Training Programs
1.4 取材
运动组小鼠末次运动后48 h取材,取材前禁食12 h,腹腔注射0.4%戊巴比妥钠(1 ml/100 g)麻醉。摘眼球取血,室温静置30 min,3 000 rpm离心10 min,取血清-80℃冷冻。使用生理盐水进行主动脉灌流后,迅速取出肝脏、子宫周围脂肪(代表内脏脂肪)和腹股沟皮下脂肪(代表皮下脂肪),滤纸吸去表面组织液,取右叶肝组织,多聚甲醛固定。脂肪在称重后部分置于多聚甲醛,其余-80℃冷冻。
1.5 脂肪细胞和肝细胞形态
将肝组织制作石蜡切片,苏木青伊红染色,中性树胶封固。显微镜观察脂滴侵润形态。
1.6 血脂4项测试
血脂4项(甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇)采用比色法进行测试,严格按照试剂盒说明书操作。试剂盒购自南京生物工程研究所,其中甘油三酯(TG)试剂盒货号A110-2、总胆固醇(TC)试剂盒货号A111-2、低密度脂蛋白胆固醇(LDL-C)试剂盒货号A112-2、高密度脂蛋白胆固醇(HDL-C)试剂盒货号A113-2。
1.7 脂肪组织HSL蛋白表达和ser563、565、660磷酸化
1)蛋白提取:脂肪组织置于RIPA裂解液中,加入PMSF和蛋白磷酸酶抑制剂混合,冰上匀浆、超声粉碎;静置30min之后将匀浆液置于离心机中12000rpm、4°C离心20min;取上清,BCA法测定蛋白浓度后煮沸样品。2)Westernblot:每孔30 μg样品,恒压电泳,4%浓缩胶80V恒压30min;12%分离胶150 V恒压60 min。湿转法将蛋白转至PVDF膜,300mA恒流,2h;5%脱脂奶粉室温封闭1 h;一抗孵育过夜(HSL、HSL563、HSL565和HSL660一抗采购自CST公司,货号:#4107,#4139,#4137,#4126),浓度1:2 000;TBST洗膜次每次5 min;二抗(1:5 000,中杉金桥公司,ZB-2301)孵育2 h;TBST洗膜5×5min后发光,暗室曝光呈像。3)结果计算:采用Image J计算蛋白条带灰度值,Westernblot结果以目标蛋白与内参蛋白灰度值比值和磷酸化蛋白与总蛋白灰度值比值表示。
1.8 统计学方法
数据使用平均数±标准差(X±SD)表示。以HFD作为无运动干预的对照组,对MICT和HIIT的训练效果进行分析。由于动物饲养采用自由摄食,摄食量会对体重、Lee’s指数、肾周脂肪重量、腹股沟脂肪重量、HSL总蛋白表达产生影响[8],故将摄食量作为协变量,以训练方案作为固定因子,对以上指标进行协方差分析,以达到在排除摄食量影响的前提下,分析MICT和HIIT对小鼠以上指标造成的差异。采用LSD法进行主效应比较,以分析每两组间差异。由于HSL磷酸化位点ser563、ser565、ser660主要受细胞内cAMP-PKA和AMPK信号调节,摄食量对其无直接作用,故对上述指标进行以训练方案作为主因子的单因素方差分析。用事后检验多重比较LSD法分析不同取材时间点训练组与对照组的差异。统计软件为SPSS24.0。取P<0.05为具有显著性差异,P<0.01具有非常显著性差异。
2 实验结果
2.1 HIIT和MICT对小鼠体重、Lee’s指数和不同部位脂肪重量的影响
将膳食量作为协变量,不同训练方案作为固定因子,分别对体重、lee’s指数和脂肪重量进行协方差分析发现,总摄食量对体重无显著主体间效应,MICT与HFD之间无显著差异,两者都非常显著低于HFD(P<0.01)。总摄食量对Lee’s指数无显著主体间效应,HFD与HIIT之间有显著差异(P<0.05),说明去除摄食量的影响后,MICT与HIIT都能够降低小鼠体重,HIIT能有效改善小鼠体型。HFD、MICT和HIIT总摄食量、体重、Lee’s指数和腹股沟与子宫周脂肪重量见图2。
总摄食量对子宫周围脂肪有显著的主体间效应,(P<0.05),对腹股沟脂肪无显著的主体间效应。HIIT的子宫周围脂肪非常显著的低于HFD组与MICT组(P<0.01),HIIT和MICT的腹股沟脂肪重量都显著低于HFD组(P<0.05)。说明HIIT和MICT都能够有效的减少皮下脂肪积累,两者之间差异不显著,但HIIT较MICT能够减少更多的内脏脂肪积累。
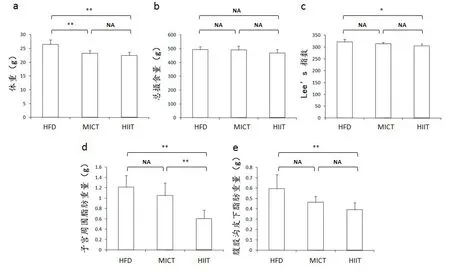
图2 不同训练组小鼠体重、Lee’s指数和不同部位脂肪重量Figure 2.Body Weight,Lee’s Index,and Different Parts of theFat Weight in Different Mice Groups
2.2 HIIT和MICT对小鼠肝细胞组织形态的影响
相比普通饲料饲养小鼠,高脂膳食饲养的HFD小鼠肝细胞出现了弥散性的脂肪小泡分布,并在某些位置出现了较大的脂滴空泡(箭头所示);MICT组与HFD类似;HIIT组肝细胞内脂肪小泡依然存在,但无论是脂肪小泡的密度或者较大脂滴空泡的数量(箭头所示),都明显低于HFD组和MICT组。HIIT可以更明显的改善小鼠肝细胞脂肪侵润程度。各组小鼠肝细胞HE染色组织形态见图3。
2.3 HIIT和MICT对小鼠血脂的作用
TC、TG和HDL-C在3组间无显著性差异;HIIT组LDLC显著低于HFD与MICT组(P<0.05),HFD与MICT之间无差异。说明12周HIIT训练可以显著降低小鼠血清LDL-C水平。各组小鼠血脂4项(总胆固醇TC、甘油三酯TG、高密度脂蛋白胆固醇HDL-C、低密度脂蛋白胆固醇LDL-C)12周训练后血清浓度见图4。

图3 不同训练组小鼠肝细胞形态Figure 3 Morphology of Liver Cells in Mice of Different Training Groups
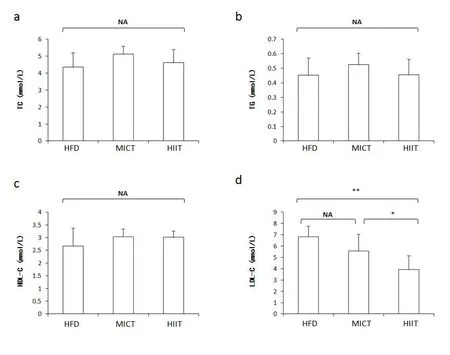
图4 不同训练组小鼠血脂变化Figure 4 Blood Lipid Changes in Mice in Different Training Groups
2.4 HIIT和MICT对小鼠不同部位脂肪组织HSL蛋白表达与磷酸化的作用
协方差分析显示,总摄食量对HSL蛋白表达无显著的主体间效应,HFD、MICT和HIIT组之间,HSL表达也没有显著性差异。3组腹股沟脂肪ser563磷酸化没有显著差异,但HIIT的子宫周围脂肪ser563磷酸化相比HFD和MICT显著升高(P<0.05)。3组间HSL-ser565磷酸化水平没有显著性差异。MICT组腹股沟脂肪ser660磷酸化显著高于HFD与HIIT组(P<0.05),MICT组子宫周围脂肪ser660显著高于HFD组,有高于HIIT组的趋势,但不著性(P=0.102)。说明HIIT可以激活内脏脂肪HSL-ser563磷酸化位点,MICT相比HIIT能够更明显的促进HSL-ser660磷酸化。各组小鼠子宫周围和腹股沟脂肪中,HSL蛋白表达与ser563、ser565、ser660磷酸化水平见图5。

图5 不同训练组小鼠HSL蛋白表达和磷酸化水平Figure 5 HSL Protein Expression and Phosphorylation Levels in Different Training Groups
3 讨论
3.1 HIIT比MICT更显著减少内脏脂肪积累
近年来HIIT作为一种减肥训练方案越来越受到人们的重视,相比MICT,其在具有同样的安全性[11]的前提下,能够节省更多的运动时间[14]。本团队前期的研究[29]和国外的相关研究[15]都表明,在运动量相同的前提下,虽然HIIT和MICT在减少皮下脂肪量方面效果相似,但HIIT可以更多的减少内脏脂肪。已有Meta分析指出,能降低内脏脂肪含量的运动,存在着强度阈,而此阈值在45%~70%最大摄氧量之间[26],高于阈值才能显著性降低内脏脂肪。虽然MICT的训练也高于强度阈,但为何在完成相同运动量时,更高强度的HIIT训练能够降低更多的内脏脂肪呢?目前比较合理的解释是:内脏脂肪相比皮下脂肪由于具有更多的β肾上腺素能受体[3],其对儿茶酚胺类的脂解激素的敏感性更高。儿茶酚胺是机体的应激激素,具有较强烈的脂解作用,可以通过cAMP-PKA通路激活脂肪细胞内多条脂肪分解途径。研究显示,当运动强度大于65%最大摄氧量时,儿茶酚胺的分泌量会随着运动强度的增加而显著增加[31]。HIIT由于极高的运动强度,可以促使机体释放更多的儿茶酚胺类激素,所以对内脏脂肪的减少效果更明显。
本研究用高脂膳食饲养建立肥胖小鼠模型,并分别给予小鼠相同运动量(奔跑距离)的MICT和HIIT训练,在训练12周后发现,两种运动训练都能有效降低小鼠体重,相比MICT,HIIT能够明显的降低小鼠内脏脂肪,HIIT有比MICT降低更多皮下脂肪的趋势,但不显著。说明强度更高的HIIT方案对内脏脂肪的减少效果更高。由于内脏脂肪与2型糖尿病、脂肪肝、高血压等疾病密切相关,所以,相同运动量的HIIT相比MICT训练虽然在降低体重方面没有显著优势,但可能在更加节省运动时间的基础上,能够更好地减少内脏脂肪,改善相关的代谢性疾病。
3.2 HIIT对肝细胞形态作用和血脂的改善作用更明显
Verrijken通过对数百人进行肝功能各指标与内脏脂肪重量间的多元回归分析显示,内脏脂肪含量与丙氨酸转氨酶和γ-谷氨酰转移酶水平密切相关[25],说明内脏脂肪堆积是诱发非酒精性脂肪肝的重要因素。2018年Nature上的一篇最新研究显示,肝脏可以通过向血液中分泌DPP4,进而促进内脏脂肪的炎症反应[7]。这些研究都说明,内脏脂肪与肝脏病变存在着重要的联系。本研究显示,高脂膳食饲养的HFD组肝细胞出现了明显的脂肪病变,而MICT虽然能够减少皮下脂肪含量,但并不能缓解肝脏脂肪病变,而HIIT小鼠虽然肝细胞内也存在脂肪病变,但脂滴大小和数量都较MICT少,说明HIIT在能够更显著的减少内脏脂肪的同时,对于缓解肝脏脂肪病变也具有一定的作用。
肥胖常常伴随着以血脂异常为标志的脂代谢紊乱。运动对血脂异常的改善作用,与运动的强度、时间、方式等要素密切相关。目前,HIIT血脂的作用效果研究普遍显示,高强度运动可以显著降低LDL水平,但不同的运动方案对HDL的作用效果还存在争议。Senthilnathan的研究显示,HIIT可以提高成年男性HDL-C,降低LDL-C水平[22],Taravati的研究却发现,HIIT可降低肥胖女性TG、LDL和极低密度脂蛋白(VLDL)水平,但对HDL没有显著影响[24]。有趣的是,Wilson的研究发现,12周HIIT训练可降低肥胖雌雄小鼠LDL水平,提高雌性小鼠HDL,但对雄性小鼠的HDL和TG没有作用[28]。这些研究显示,HIIT对降低LDL水平具有较为确定的效果,但是否能够改善HDL、TG和TC水平,可能与训练方案和实验对象的性别有关。本研究显示,经过12周相同运动量的MICT和HIIT训练,小鼠血清TC、TG、HDL-C水平没有显著区别,但HIIT相较MICT能够更明显的降低LDL-C水平。由于LDL也是引发心血管疾病的独立危险因素,所以HIIT相较MICT,对于改善机体血脂异常以及预防与肥胖相关的心血管疾病具有更明显的作用。
3.3 HIIT对内脏脂肪HSL的磷酸化的特异性激活
脂肪在体内的分解首先要经历将脂滴内的三酰甘油水解为甘油和游离脂肪酸的“脂肪动员”阶段,之后分解的甘油分子和游离脂肪酸才能逐步氧化分解。其分解过程分为3个阶段:首先甘油三酯被脂肪甘油三脂水解酶(AadiposeTriglyceride Lipase,ATGL)水解,生成二腺甘油和1分子游离脂肪酸;之后二腺甘油被HSL分解为单腺甘油和1分子游离脂肪酸;最后,单腺甘油由单腺甘油脂肪酶(Monoacylglycerol Lipase,MAGL)彻底分解为甘油和游离脂肪酸[12]。其中,ATGL和HSL被认为是脂肪水解过程中的关键限速酶。ATGL本身具备ser404和ser42两个磷酸化位点,可被儿茶酚胺激活的cAMP-PKA通路磷酸化,但是其位点磷酸化后会产生何种功能变化目前尚不清楚。ATGL活性的调节主要途径是儿茶酚胺激活PKA后,磷酸化脂肪细胞内的脂滴结合蛋白(Perilinpin),进而释放比较基因识别物-58(Comparative gene identification-58,CGI-58),进而激活ATGL活性。但ATGL的激活并非意味着机体脂肪含量的降低。虽然有研究表明,长期运动可以刺激正常体重大鼠的ATGL高表达和ATGL与CGI-58的结合[17],但也有研究显示,1次运动不能激活健康男性ATGL基因表达,禁食则能够显著提高其mRNA表达[16]。而在对高脂膳食饲养诱导的肥胖大鼠的研究中,Mandeep发现,肥胖大鼠ATGL表达显著高于普通大鼠[6]。Renate的研究显示,脂肪组织特异性敲除ATGL后的小鼠,进食普通饲料时,体重相比野生型小鼠高,然而在高脂膳食饲养后,其体重较高脂膳食饲养的野生型小鼠体重显著降低[21],这是由于ATGL敲除影响了小鼠的进食量和PPARs信号而造成的。这些研究提示,普通饲料饲养的正常体重小鼠,ATGL的高表达可促进脂肪水解,降低体重;而对于高脂膳食饲养的肥胖小鼠,ATGL升高只是对过量甘油三脂堆积的代偿,并不能减轻脂肪重量和体重。故本研究将重点关注HIIT是否能够通过儿茶酚胺和cAMP-PKA通路激活HSL途径,而非ATGL途径,进而达到促进脂解的效果。
目前已知HSL可被脂解类激素(如儿茶酚胺、生长激素、钠尿肽等)激活cAMP-PKA通路,磷酸化ser563和ser660,加速甘油三酯分解。AMPK则可通过磷酸化ser565,抑制HSL的水解能力。Andrea的研究显示,大鼠在应激状态下,儿茶酚胺诱导脂肪细胞HSL-ser660磷酸化是具有部位差异性的:肠系膜脂肪细胞在儿茶酚胺的诱导下出现了ser660磷酸化的增加,并伴随着脂肪重量降低,而附睾脂肪并没有出现显著的磷酸化和脂肪重量降低[23]。这提示,脂解激素诱导的HSL脂肪水解酶活性升高,是具有部位的特异性的。Silvia在使用去甲肾上腺素(Norepinephrine,NE)和cAMP激动剂诱导肥胖女性人群皮下脂肪HSL磷酸化的研究中发现,安静状态下皮下脂肪的脂解水平与和HSL-ser552(对应鼠的ser563)磷酸化相关,而NE和cAMP激动剂的作用主要通过抑制AMPK活性,继而解除对ser554(对应鼠的ser565)的磷酸化来提升脂肪水解水平,ser563磷酸化程度与皮下脂肪细胞NE介导的脂解无相关性[13]。这提示,激素激活皮下脂肪水解主要是依靠抑制ser565,而非激活ser563磷酸化完成的。Mandeep的研究[8]显示,高脂膳食饲养的肥胖小鼠,其内脏脂肪细胞在儿茶酚胺或cAMP激动剂的诱导下,可以出现ser563和ser660磷酸化的增加,且其甘油三酯水解能力也获得了提高,而皮下脂肪虽然经过了相同浓度的儿茶酚胺或cAMP激动剂诱导,ser563和ser660未出现磷酸化,脂解水平虽也有提高,但较内脏脂肪细胞提高幅度低。上面两个研究表明,皮下脂肪和内脏脂肪的HSL虽然都能被激素通过cAMP-PKA激活,但具体的机制和磷酸化位点不同。
本研究对高脂膳食饲养造成的肥胖小鼠进行12周跑台训练,发现HIIT和MICT对降低小鼠皮下脂肪的效果相似,但HIIT能够更明显的减少内脏脂肪积累。12周HIIT训练可以促使安静状态下内脏脂肪HSL-ser563磷酸化的升高,而MICT并不能显著提高ser563磷酸化水平,提示HIIT对内脏脂肪减少更显著,与内脏组织HSL-ser563磷酸化特异性升高有关。
MICT在减少内脏脂肪的效果方面不如HIIT明显,在减少皮下脂肪的效果方面效果与HIIT类似。MICT不能显著升高ser563,但能明显升高皮下和内脏脂肪ser660磷酸化。Matthew的研究可对这个结果做出一定的解释:当对离体脂肪细胞只加入儿茶酚胺后,ser563和ser660磷酸化升高,但如果在加入儿茶酚胺30min后,又加入AMPK激动剂AICRA,则ser563原本应该出现的磷酸化现象会被抑制,而Ser660则不受AMPK影响,无论是否加入AIACR,儿茶酚胺都能引起其磷酸化程度的增加[27]。这提示,MICT可能激活了AMPK途径,进而抑制了ser563的磷酸化,由于ser660的磷酸化不受AMPK的抑制,所以出现了MICT组ser563不升高,但ser660升高的现象。
众所周知,AMPK是细胞的能量感受器,cAMP-PKA途径则是细胞的应激感受器。HIIT可造成机体较大的应激,分泌大量脂解激素和细胞因子,由于内脏脂肪对这些信号的敏感性更高,所以HIIT可特异性提高内脏脂肪ser563的磷酸化水平,进而促进其水解。MICT由于长时间中等强度的运动,对机体能量代谢状态的影响更高,可能产生激活AMPK途径抑制ser563的现象,此时即使皮下和内脏脂肪ser660都在较高水平,但其特异性促进内脏脂肪水解的效果仍低于HIIT。不同强度的训练减少内脏脂肪积累的效果并不相同,可能正是由于MICT与HIIT对脂肪细胞内不同信号通路的激活造成的。当然,AMPK和PKA的上下游调控过程是极其复杂的,不同的运动强度,如何通过不同的信号,协调HSL磷酸化位点的相互抑制?相对于MICT,HIIT小鼠内脏脂肪HSL-ser563的特异性升高,究竟是由于HIIT能更强的促进HSL磷酸化,亦或是由于MICT运动伴随着AMPK激活,进而抑制了ser563的磷酸化,相关深入的细胞信号变化,需要更加深入的研究进一步阐明。
4 结论
HIIT训练能明显缓解肝脏脂肪病变、改善血脂,提高机体健康水平。在完成同样的运动量时,HIIT能更明显的减少内脏脂肪积累,这与HIIT训练时,内脏脂肪组织的HSL-ser563磷酸化特异性升高,进而促进内脏脂肪水解密切相关。MICT对HSL激活的途径与HIIT不同,可同时提高皮下与内脏脂肪的HSL-ser660磷酸化,但不能特异性促进内脏脂肪水解,减少内脏脂肪积累的效果低于HIIT。
[1]ARNER P.Human fat cell lipolysis:biochemistry,regulation and clinical role[J].Best Pract Res Clin Endocrinol Metab,2005,19(4):471-482.
[2]CAMELL C D,SANDER J,SPADARO O,et al.Inflammasomedriven catecholamine catabolism in macrophages blunts lipolysis during ageing[J].Nature,2017,7674(550):119-123.
[3]DAVIES C T,FEW J,FOSTER K G,et al.Proceedings:Plasma catecholamine concentration during exercise involving different muscle groups[J].Eur J Appl Physiol OccupatPhysiol,1974,32(3):195-206.
[4]FISCHER K,RUIZ H H,JHUN K,et al.Alternatively activated macrophages do not synthesize catecholamines or contribute to adipose tissue adaptive thermogenesis[J].Nature Medicine,2017,23(5):623-630.
[5]FREDA P U,SHEN W,HEYMSFIELD S B,et al.Lower visceral and subcutaneous but higher intermuscular adipose tissue depots in patients with growth hormone and insulin-like growth factor I excess due to acromegaly[J].Journal of Clin Endocrinol Metab,2008,93(6):2334-2343.
[6]GAIDHU M P,ANTHONY N M,PATEL P,et al.Dysregulation of lipolysis and lipid metabolism in visceral and subcutaneous adipocytes by high-fat diet:role of ATGL,HSL,and AMPK[J].Am J Physiol Cell Physiol,2010,298(1):C961-C971.
[7]GHORPADE D S,OZCAN L,ZHENG Z,et al.Hepatocytesecreted DPP4 in obesity promotes adipose inflammation and insulin resistance[J].Nature,2018,7698(555):673-677.
[8]HOSHINO D,YOSHIDA Y,KITAOKA Y,et al.High-intensity interval training increases intrinsic rates of mitochondrial fatty acid oxidation in rat red and white skeletal muscle[J].ApplPhysiol Nutr Metab,2013,38(3):326-333.
[9]HØYDAL M A,WISLØFF U,KEMI O J,et al.Running speed and maximaloxygen uptake in ratsand mice:practical implicationsforexercise training[J].EurJCardiovasc Prev Rehabil,2007,14(6):753-760.
[10]JANG S,CHANG H L,CHOI K M,et al.Correlation of fatty liver and abdominal fat distribution using a simple fat computed tomography protocol[J].World J Gastroenterol,2011,17(28):3335-3341.
[11]KESSLER H S,SISSON S B,SHORT K R.The Potential for high-intensity interval training to reduce cardiometabolic disease risk[J].Sports Medicine,2012,42(6):489-509.
[12]LAFONTAN M,LANGIN D.Lipolysis and lipid mobilization in human adipose tissue[J].ProgLipid Res,2009,48(5):275-297.
[13]LORENTECEBRIÁN S,KULYTÉ A,HEDÉN P,et al.Relationship between site-specific hsl phosphorylation and adipocyte lipolysis in obese women[J].ObesFacts,2011,4(5):365-371.
[14]MAILLARD F,PEREIRA B,BOISSEAU N.Effect of highintensity interval training on total,abdominal and visceral fat mass:a meta-analysis[J].Sports Med,2017,48(1):269-288
[15]MAILLARD F,ROUSSET S,PEREIRA B,et al.High-intensity interval training reduces abdominal fat mass in postmenopausal women with type 2 diabetes[J].Diabetes Metab,2016,42(6):433-441.
[16]NIELSEN T S,VENDELBO M H,JESSEN N,et al.Fasting,but not exercise,increases adipose triglyceride lipase(ATGL)protein and reduces G(0)G(1)switch gene 2(G0S2)protein and mRNA content in human adipose tissue[J].Journal of Clinical Endocrinology&Metab,2011,96(8):1293-1297.
[17]OGASAWARA J,SAKURAI T,KIZAKI T,et al.Higher levels of atgl are associated with exercise-induced enhancement of lipolysis in rat epididymal adipocytes[J].PloSOne,2012,7(7):1-10.
[18]OHKAWARA K,TANAKA S,MIYACHI M,et al.A dose–response relation between aerobic exercise and visceral fat reduction:systematic review of clinical trials[J].Int J Obes,2007,31(12):1786-1797.
[19]PHILIPSENA,JØRGENSENME,VISTISEND,etal.Associations between ultrasound measures of abdominal fat distribution and indices of glucose metabolism in a population at high risk of type 2 diabetes:the addition-pro study[J].PloS One,2015,10(4):1-13.
[20]ROSENQUIST K J,PEDLEY A,MASSARO J M,et al.Visceral and subcutaneous fat quality and cardiometabolic risk[J].JACC Cardiovasc Imag,2013,6(7):762-771.
[21]SCHREIBER R,HOFER P,TASCHLER U,et al.Hypophagia and metabolic adaptations in mice with defective ATGL-mediated lipolysis cause resistance to HFD-induced obesity[J].ProcNat Acad Sci U S A,2015,112(45):13850-13855.
[22]SENTHILNATHAN EN,PUSHPARAJAN A.Isolatedand combined effects of yogic practices and high intensity interval training on cardio vascular risk factors among,adult men[J].Int JInnovat Res Dev,2013,6(2):228-235.
[23]STOFKOVA A,KRSKOVA K,VACULIN S,et al.Enhanced activity of hormone sensitive lipase(HSL)in mesenteric but not epididymal fat correlates with higher production of epinephrine in mesenteric adipocytes in rat model of cachectic rheumatoid arthritis[J].Autoimmunity,2016,49(4):268-276.
[24]TARAVATI F,IRANDOUST K,RAHIMI A.The effects of 8 weeks high intensity interval training(HIIT)with garlic complement on some lipid profiles in obese inactive women[J].ActaMed Mediterranea,2017,33(1):271-274.
[25]VERRIJKEN A,FRANCQUE S,MERTENS I,et al.Visceral adipose tissue and inflammation correlate with elevated liver tests in a cohort of overweight and obese patients[J].Int J Obes,2010,34(5):899-907.
[26]VISSERS D,HENS W,TAEYMANS J,et al.The Effect of exercise on visceral adipose tissue in overweight adults:a systematic review and meta-analysis[J].PLoS One,2013,8(2):1-10.
[27]WATT M J,HOLMES A G,PINNAMANENI S K,et al.Regulation of HSL serine phosphorylation in skeletal muscle and adipose tissue[J].Am J Physiol Endocrinol Metab,2006,290(3):E500-E508.
[28]WILSON R A,DEASY W,STATHIS C G,et al.Intermittent fasting with or without exercise prevents weight gain and improves lipids in diet-induced obese mice[J].Nutr,2018,10(3):1-15.
[29]ZHANG H,TONG T K,QIU W,et al.Comparable Effects of High-intensity interval training and prolonged continuous exercise training on abdominal visceral fat reduction in obese young women[J].J Diabetes Res,2017,2017(2):1-9.
[30]ZHANG H,TONG T K,QIU W,et al.Effect of high-intensity interval training protocol on abdominal fat reduction in overweight chinese women:a randomized controlled trial[J].Kinesiol,2015,47(1):57-66.
[31]ZOUHAL D H,JACOB C,DELAMARCHE P,et al.Catecholamines and the effects of exercise,training and gender[J].Sports Med,2008,38(5):401-423.
