siRNA技术沉默SOCS3对缺氧复氧心肌细胞增殖、凋亡的影响以及作用机制
2018-10-12王文刚杜建峰张晓璐卜秀梅
王文刚 王 静 杜建峰 张晓璐 卜秀梅
(沈阳医学院附属中心医院,沈阳110024)
缺血性心脏病是一种死亡率较高的疾病,严重危害人类的健康,给患者以及家庭、社会带来沉重的经济负担,通常采用溶栓等手段,迅速恢复患者冠动脉血液的循环流动是临床治疗缺血性心脏病的关键[1,2]。研究发现,血流重新灌流缺血心肌组织后会使心脏产生新的损伤,降低心功能、心律失常、心肌顿抑等继发性损伤,称为缺血再灌注损伤(Ischemia-reperfusion injury,IRI)[3]。既往研究表明,心肌IRI与细胞增殖、凋亡以及氧化损伤、心肌线粒体能量代谢等有关[4-6]。探明心肌IRI的发生发展的机制以及如何进行有效的防范措施是心血管领域的研究重点。细胞因子信号转导抑制因子3(Suppressor of cytokine signaling 3,SOCS3)是SOCS家族的成员之一。研究表明,敲除小鼠SOCS3对心肌梗死小鼠左心室功能具有显著影响,提示SOCS3在心脏功能损伤过程中发挥作用[7]。为了探究SOCS3基因在缺氧复氧损伤心肌细胞中的作用,本研究通过小分子干扰RNA靶向沉默SOCS3,采用脂质体转染心肌细胞H9C2,进行缺氧复氧处理[8,9],观察其表达量降低在保护心肌细胞缺氧复氧损伤中的作用,为后续在体探究SOCS3在心肌IRI中的作用机制提供理论基础。
1 材料与方法
1.1材料 大鼠心肌细胞系H9C2由本实验室保存,最初购买于中科院上海细胞库;胎牛血清、青链霉素、Opti-MEM培养基购自美国Gibco公司;DMEM培养基购自美国Hyclone公司;磷酸盐缓冲液(PBS)购自南京生兴公司;Lipofectamine 2000购自美国Invitrogen公司;siRNA NC或siRNA SOCS3、细胞计数法检测试剂盒(Cell Counting Kit-8,CCK-8)购自广州锐博;乳酸脱氢酶(Lactate dehydrogenase,LDH)检测试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、丙二醛(Maleic Dialdehyde,MDA)检测试剂盒购自南京建成有限公司;细胞凋亡检测试剂盒购自南京凯基有限公司;细胞裂解液购自上海申能博彩生物有限公司;核因子-κB(NF-κB)p65单克隆抗体、细胞周期蛋白D1(Cyclin D1)单克隆抗体、c-Myc单克隆抗体购自美国Santa Cruz公司;β肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶标记羊抗兔/鼠IgG二抗购自深圳晶美公司。水平电泳仪、电泳槽购自北京六一工厂;垂直电泳仪、凝胶成像系统购自美国Bio-Rad公司;倒置显微镜、荧光显微镜购自日本Olympus公司;细胞培养箱、酶标仪购自美国Thermo Scientific公司;流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞的培养 H9C2细胞培养于含10%胎牛血清的DMEM培养基,并加入1%的双抗,放入37℃、CO2浓度为5%的细胞培养箱中,显微镜下观察到细胞贴壁生长,其浓度达到80%左右,加入胰酶消化,加入完全培养基终止消化,1 000 r/min离心5 min,弃去上清液,以1∶3或1∶4的比例进行传代。
1.2.2缺氧复氧心肌细胞模型 显微镜下观察H9C2心肌细胞铺满培养皿底80%左右,弃去培养液,PBS缓冲液清洗2次,缺氧溶液预先使用混合气体(含95%N2和5%CO2)饱和处理1 h;吸取适量缺氧溶液加入细胞中,置于95%N2和5%CO2的37℃密闭容器中培养3 h;弃去缺氧溶液,PBS缓冲液清洗2次,复氧灌注液提前使用95%O2和5%CO2饱和处理60 min,置于95%O2和5%CO2的37℃密闭容器中复氧培养3 h。
1.2.3细胞的转染 H9C2心肌细胞常规培养于RPMI1640培养基中,稳定传代后进行转染。将H9C2心肌细胞分为4组,对照组、缺氧/复氧组、缺氧/复氧+siRNA NC组、缺氧/复氧+siRNA SOCS3组。转染前24 h,选取生长状态良好的细胞,加入胰酶消化,显微镜下计数,将细胞调整为5×105个加入6孔板中培养,吸取2 ml完全培养基,待细胞丰度达到80%~90%开始转染。将培养基更换为Opti-MEM,稀释A液:将0.8~1.0 μg质粒溶于50 μl Opti-MEM培养基中,混合均匀;稀释B液:将2 μl Lipofectamine 2000溶于50 μl Opti-MEM培养基中,室温孵育5 min;将A液与B液充分混合,室温下孵育3 min,形成复合物;吸取Opti-MEM培养基清洗细胞3次,每孔细胞中加入100 μl Opti-MEM培养基和上述复合物,轻轻晃动混匀,37℃培养4~6 h,移去转染液,更换为完全培养基继续培养。免疫印迹试验(Western blot)检测转染效果。
1.2.4CCK-8法检测细胞增殖活力 收集各组5×103个细胞接种于96孔板中,每组设置6个平行复孔;置于37℃培养箱中预培养12 h,待细胞贴壁后,弃去旧培养基,PBS液冲洗2次,加入无血清培养基培养6 h,更换为含10%胎牛血清的DMEM培养基,每孔加入10 μl的CCK-8液,置于37℃培养箱继续培养4 h,在酶标仪中检测细胞在450 nm波长下的吸光值(OD值)。
1.2.5细胞中LDH、MDA、SOD的检测 收集各组细胞,超声破碎处理后,根据MDA、SOD检测试剂盒说明书检测细胞中MDA、SOD的水平;收集各组细胞培养液,根据LDH检测试剂盒说明书检测LDH活力。
1.2.6流式细胞仪检测细胞的凋亡 收集各组生长状态良好的细胞接种于6孔板中,去旧培养基,加入2 ml PBS液冲洗2次;采用不含EDTA的胰蛋白酶消化细胞,PBS液冲洗2次,收集3×105个细胞;加入500 μl缓冲液重悬细胞,室温下加入5 μl膜联蛋白V-FITC(Annexin V-FITC)轻轻混合均匀,再加入5 μl碘化丙啶(Propidium iodide,PI)轻轻混合均匀,此过程在避光环境下操作,孵育15 min,1 h内置于流式细胞仪中检测细胞凋亡。
1.2.7Western blot检测细胞中NF-κB相关蛋白水平 取出各组细胞,弃去培养基,PBS液冲洗3次,每孔细胞中加入200 μl预冷的细胞裂解液,采用细胞刮片将细胞以及裂解液集中至培养孔一侧,转移至离心管中,冰上裂解完全后,离心,取上清。测定蛋白质浓度,吸取适量的蛋白上样缓冲液混匀,沸水浴变性10 min。组装凝胶系统,配置5 ml 10%分离胶和5%积层胶,室温下凝固30 min。将凝胶放入电泳槽中,加入等量的蛋白样品,先调整电压为80 V,随后将电压调为120 V,电泳至蓝色条带迁移至玻璃板边缘,切去多余凝胶,准备转膜。选取凝胶大小的PVDF膜先浸泡在甲醛液中10 s,再转移至转膜液中浸泡5 min,依次加入海绵垫、3层滤纸、PVDF膜、凝胶、3层滤纸、海绵垫,放入转膜槽中,避免产生气泡,冰水浴中采用220 mA电流转膜。转膜结束后,三蒸水清洗1次,加入配置好的牛奶封闭液,37℃摇床上孵育1 h;加入一抗稀释液,4℃垂直摇床孵育过夜;在洗膜专用盒中清洗3次,每次10 min,加入二抗稀释液,室温静置120 min;在洗膜专用盒中清洗3次,每次10 min,根据化学发光剂说明书进行显色、曝光,分析目的蛋白与内参条带比值,实验重复3次。
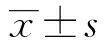
2 结果
2.1Western blot检测转染效果 结果如图1、表1所示,与对照组相比,缺氧复氧处理心肌细胞后SOCS3蛋白的表达明显增加,差异具有统计学意义(P<0.05);siRNA NC转染缺氧复氧心肌细胞,细胞中SOCS3蛋白的表达量较缺氧/复氧组差异不显著,但siRNA SOCS3转染缺氧复氧心肌细胞显著降低SOCS3蛋白的水平(P<0.05),表明缺氧/复氧+siRNA SOCS3组心肌细胞降低SOCS3蛋白的表达主要是由siRNA SOCS3特异性序列引起的,提示转染成功。
2.2CCK-8法检测细胞增殖活性 结果如表2所示,与对照组相比,缺氧复氧处理H9C2心肌细胞显著降低细胞的增殖活性,差异具有统计学意义(P<0.05);siRNA NC转染缺氧复氧心肌细胞,细胞的增殖活性较缺氧/复氧组差异不显著,但siRNA SOCS3转染缺氧复氧心肌细胞显著增加细胞的增殖活性(P<0.05),表明缺氧/复氧+siRNA SOCS3组心肌细胞降低SOCS3蛋白的表达可促进缺氧复氧心肌细胞增殖。

图1 细胞转染后SOCS3蛋白的表达量Fig.1 Expression of SOCS3 protein after transfected of cellsNote:1.Control group;2.Hypoxia/reoxygenation group;3.Hypoxia/reoxygenation+siRNA NC group;4.Hypoxia/reoxygenation+siRNA SOCS3 group.
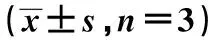
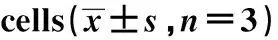

GroupsSOCS3/β-actinControl group0.266±0.028Hypoxia/reoxygenation group0.784±0.0831)Hypoxia/reoxygenation+siRNA NC group0.756±0.0791)Hypoxia/reoxygenation+siRNA SOCS3 group0.271±0.0352)3)
Note:Compared with the control group,1)P<0.05;compared with hypoxia/reoxygenation group,2)P<0.05;compared with hypoxia/reoxygenation group+siRNA NC group,3)P<0.05.
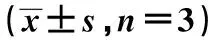
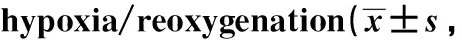

GroupsOD450Control group0.893±0.078Hypoxia/reoxygenation group0.421±0.0451)Hypoxia/reoxygenation+siRNA NC group0.436±0.0471)Hypoxia/reoxygenation+siRNA SOCS3 group0.628±0.0671)2)3)
Note:Compared with the control group,1)P<0.05;compared with hypoxia/reoxygenation group,2)P<0.05;compared with hypoxia/reoxygenation group +siRNA NC group,3)P<0.05.
2.3LDH、MDA、SOD的检测 结果如表3所示,与对照组相比,H9C2心肌细胞缺氧复氧显著升高细胞培养液中LDH和细胞内MDA的水平,降低细胞内SOD活性,差异具有统计学意义(P<0.05);siRNA NC转染缺氧复氧心肌细胞,细胞培养液中LDH以及细胞中MDA、SOD活性较缺氧/复氧组差异不显著,但siRNA SOCS3转染缺氧复氧心肌细胞显著降低细胞培养液中LDH和细胞内MDA,显著增加细胞内SOD活性(P<0.05),提示缺氧/复氧+siRNA SOCS3组心肌细胞降低SOCS3的蛋白表达可抑制缺氧复氧心肌细胞结构和功能损伤。
2.4流式细胞仪检测细胞凋亡率 结果如表4所示,与对照组相比,缺氧复氧处理H9C2心肌细胞显著促进细胞凋亡,差异具有统计学意义(P<0.05);siRNA NC转染缺氧复氧心肌细胞,细胞的凋亡率较缺氧/复氧组差异不显著,但转染siRNA SOCS3显著降低缺氧复氧心肌细胞的凋亡率(P<0.05),表明沉默SOCS3可抑制缺氧复氧心肌细胞凋亡。见图2。
2.5Western blot检测细胞中NF-κB相关蛋白水平 结果如表5所示,与对照组相比,H9C2心肌细胞缺氧复氧显著降低细胞中NF-κB p65以及下游靶蛋白Cyclin D1、c-Myc蛋白的水平,差异具有统计学意义(P<0.05);siRNA NC转染缺氧复氧心肌细胞,细胞中NF-κB p65以及下游靶蛋白Cyclin D1、c-Myc的蛋白表达量较缺氧/复氧组差异不显著,但siRNA SOCS3转染缺氧复氧心肌细胞显著上调NF-κB p65以及下游靶蛋白Cyclin D1、c-Myc的蛋白表达量,差异具有统计学意义(P<0.05),提示沉默SOCS3蛋白的表达对缺氧复氧心肌细胞结构和功能损伤的保护作用与NF-κB信号通路有关。见图3。
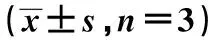
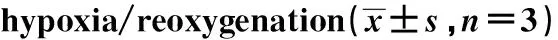

GroupsLDH(U/L)MDA(nmol/ml)SOD(U/L)Control group469.327±37.5814.623±0.89736.567±4.238Hypoxia/reoxygenation group862.457±42.3691)12.335±2.1261)15.658±2.9831)Hypoxia/reoxygenation+siRNA NC group841.697±45.1181)13.457±2.6281)16.329±2.4851)Hypoxia/reoxygenation+siRNA SOCS3 group535.247±23.5411)2)3)7.259±1.2081)2)3)25.784±4.1261)2)3)
Note:Compared with the control group,1)P<0.05;compared with hypoxia/reoxygenation group,2)P<0.05;compared with hypoxia/reoxygenation group+siRNA NC group,3)P<0.05.
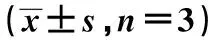


GroupsApoptosis rate(%)Control group3.269±0.385Hypoxia/reoxygenation group18.692±2.1251)Hypoxia/reoxygenation+siRNA NC group19.365±2.4511)Hypoxia/reoxygenation+siRNA SOCS3 group8.261±1.2031)2)3)
Note:Compared with the control group,1)P<0.05;compared with hypoxia/reoxygenation group,2)P<0.05;compared with hypoxia/reoxygenation group +siRNA NC group,3)P<0.05.

图2 沉默SOCS3对缺氧复氧H9C2心肌细胞凋亡的影响Fig.2 Effect of silencing SOCS3 on apoptosis of H9C2 cardiomyocytes after hypoxia/reoxygenationNote:1.Control group;2.Hypoxia/reoxygenation group;3.Hypoxia/reoxygenation+siRNA NC group;4.Hypoxia/reoxygenation+siRNA SOCS3 group.
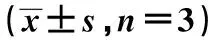
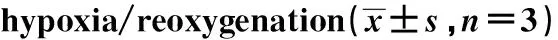

Groupsp65/β-actinCyclin D1/β-actinc-Myc/β-actinControl group0.845±0.0781.205±0.1361.163±0.154Hypoxia/reoxygenation group0.251±0.0321)0.523±0.0651)0.489±0.0531)Hypoxia/reoxygenation+siRNA NC group0.248±0.0291)0.554±0.0581)0.501±0.681)Hypoxia/reoxygenation+siRNA SOCS3 group0.685±0.0541)2)3)0.967±0.1451)2)3)0.896±0.0921)2)3)
Note:Compared with the control group,1)P<0.05; compared with hypoxia/reoxygenation group,2)P<0.05; compared with hypoxia/reoxygenation group+siRNA NC group,3)P<0.05.

图3 沉默SOCS3对缺氧复氧H9C2心肌细胞NF-κB相关蛋白水平的影响Fig.3 Effect of silencing SOCS3 on NF-κB related protein levels in H9C2 cells after hypoxia/reoxygenationNote:1.Control group;2.Hypoxia/reoxygenation group;3.Hypoxia/reoxygenation+siRNA NC group;4.Hypoxia/reoxygenation+siRNA SOCS3 group.
3 讨论
临床治疗心肌梗死后心肌缺血的关键是及时恢复动脉或相关心肌的血液供应,但近年来研究表明,在恢复缺血心肌组织的血液灌流时,不但不能减轻心肌细胞缺血损伤,反而加重了缺血损伤[10]。临床上对于缺血再灌注损伤的机制进行了研究,但目前还没有完全有效的治疗方案,缺血再灌注损伤成为了临床治疗心血管疾病的难题,引起人们的密切关注。目前为止,SOCS家族被发现的成员一共有8个,该家族成员具有SH2核心结构域和含有40个氨基酸模块的保守C端。该家族广泛存在于机体多种细胞中且可被诱导表达[11]。SOCS3是一种与心血管疾病关系最密切的蛋白成员之一[12]。在缺血再灌注损伤的发生发展过程中,细胞的凋亡是IRI病变的主要形式之一[13,14]。本实验通过缺氧复氧干预心肌细胞模拟心肌缺血再灌注,采用RNA干扰SOCS3表达,发现缺氧复氧心肌细胞转染siRNA SOCS3后,细胞中SOCS3蛋白的表达量显著降低;沉默SOCS3基因表达后,细胞的增殖活性显著增加,凋亡率显著降低,表明下调SOCS3基因表达有效抑制缺氧复氧心肌细胞凋亡,对缺氧复氧心肌细胞损伤发挥保护作用。
心肌细胞缺氧导致能量代谢紊乱,心肌细胞膜损伤;复氧时,随着大量氧的灌入,大量氧自由基生成,造成细胞膜受损,通透性增加。临床上通常采用血清心肌酶水平的变化间接反应心肌细胞损伤的程度。LDH是心肌细胞的标志酶之一[15]。SOD是一种细胞内的抗氧化酶,通过去除超氧阴离子,使机体避免受到氧自由基的损伤,SOD水平的变化间接反应细胞去除氧自由基的能力[16]。MDA是细胞氧自由基攻击细胞膜不饱和脂肪酸的反应产物,其水平的高低间接反映氧自由基损伤细胞的程度[17]。本实验结果表明,在缺氧复氧干预心肌细胞时,LDH、MDA水平显著增加,SOD显著下降,心肌细胞的增殖活性降低,表明缺氧复氧过程脂质过氧化反应强烈,细胞损伤增强;靶向沉默SOCS3表达显著降低LDH、MDA含量,SOD、细胞的增殖活性显著增加,表明沉默SOCS3可能通过增强机体清除氧自由基的能力,减轻细胞膜脂质过氧化反应,从而对缺氧复氧心肌细胞发挥保护作用。
研究发现,NF-κB信号通路不仅在缺氧复氧心肌细胞损伤中发挥重要作用,还是心肌细胞缺血的预适应早期以及延迟性保护过程中的重要机制[18-20]。抑制缺血心肌细胞中的NF-κB信号通路的活化,其对心肌损伤的保护作用受到阻碍,表明NF-κB信号通路在缺氧复氧心肌细胞损伤中具有重要作用。在IRI过程中,被激活的NF-κB进入细胞核中,通过调控下游靶基因(Cyclin D1、c-Myc),调控细胞的凋亡、炎症等反应[21]。在本实验中,缺氧复氧干预心肌细胞后,细胞中NF-κB p65、Cyclin D1、c-Myc蛋白水平显著下调,表明NF-κB信号通路在缺氧复氧心肌细胞损伤中发挥一定作用;沉默缺氧复氧心肌细胞中SOCS3基因的表达,显著增加NF-κB p65、Cyclin D1、c-Myc蛋白水平,提示沉默SOCS3可能通过激活NF-κB信号通路发挥抗凋亡的作用,从而保护心肌细胞损伤。
综上所述,siRNA干扰SOCS3基因能够增强细胞氧自由基的清除能力,减轻脂质过氧化反应,可能通过激活NF-κB信号通路,进而发挥抗凋亡作用,从而保护缺氧复氧心肌细胞损伤。SOCS3基因可能成为解决IRI的潜在靶点,为下一步在体实验研究SOCS3基因奠定了理论基础。