PbGPI16在C57BL/6小鼠脑疟发病过程中作用的研究①
2018-10-12刘庆阳朱晓彤曹雅明
邱 悦 刘庆阳 朱晓彤 曹雅明
(中国医科大学附属第一医院心血管超声科,沈阳110001)
疟疾是通过蚊媒传播的寄生原虫感染性疾病,其并发症脑疟是造成感染患者死亡的主要原因。研究结果显示,疟疾感染后宿主过度的免疫应答是诱发脑疟症状的主要原因。有研究证实TNF-α、IFN-γ与 IL-1β等在疟疾感染后升高的前炎症因子是可引起宿主严重的病理改变[1]。同时,疟疾感染后宿主体内表达上调的CXCL9、CXCL10和CXCR3等趋化因子可以造成疟原虫感染红细胞(pRBCs)、白细胞和血小板趋化并黏附于脑微血管壁,进而导致脑微血管内皮细胞损伤和血脑屏障破坏,从而诱发脑疟[2]。此外,疟原虫自身组分亦可引起感染宿主严重的病理反应,例如疟原虫核酸、疟色素和原虫糖基磷脂酰肌醇(Glycosylphosphatidylinositols,GPIs)。其中GPIs是糖脂复合体,可协助锚定细胞膜表面蛋白从而发挥生物学作用。恶性疟原虫感染后,原虫GPIs通过与TLRs相互作用,激活宿主酪氨酸激酶和蛋白激酶C调节下游前炎症因子的表达上调,进而导致脑疟[3]。 鼠疟研究表明,原虫GPIs和GPI锚定蛋白可引起促炎因子的产生并引发发热及脑疟症状[4]。因此,原虫GPIs和GPI锚定蛋白为宿主免疫系统作用的靶位。
GPI锚定蛋白的合成均始于细胞内质网,其合成过程主要通过GPI-T介导的转酰胺基反应[5]。GPI-T的各种亚基均通过自身跨膜或者与其他亚基结合的方式镶嵌于内质网上。所有的GPI锚定蛋白在内质网合成时蛋白羧基末端均含有GPI锚定蛋白信号肽[6]。这类信号肽在转酰胺基反应过程中发挥重要作用,但各蛋白之间不尽相同[7]。在内质网完成转酰胺基反应后,GPIs连接后的GPI锚定蛋白通过高尔基体途径运输至细胞膜[8]。其中GPI-T复合体功能的完整性在GPIs及GPI锚定蛋白的合成及运输至关重要。
前期研究中我们发现PbGPI16是Pb.ANKA中GPI-T复合体中的组成亚基之一,在多种疟原虫种属中均高度保守。在伯氏疟原虫pbgpi16基因敲除株(△pbgpi16)的裂殖子表面MSP1、MSP4和MSP10等GPI锚定蛋白的数量均有减少[9]。本研究中,通过与野生型WT组相比,△pbgpi16基因敲除虫株感染宿主后,宿主前炎症反应明显下降,且△pbgpi16感染C57BL/6小鼠不能成功建立ECM模型。综上,PbANKA原虫PbGPI16蛋白在ECM病理过程中发挥至关重要的作用。
1 材料与方法
1.1材料 40只6~8周龄,雌性C57 BL/6小鼠,购自北京动物所。伯氏疟原虫(Plasmodium berghei ANKA虫株2.34, PbANKA)由中国医科大学免疫学教研室保存。4%的多聚甲醛(北京鼎国)。RNA提取试剂盒(康为世纪)。基因组RNA反转录试剂盒(TaKaRa公司)。MSD Proinflammatory Panel 1 cytokine assay kits试剂盒 (Mesoscale,Rockville,USA)。测量细胞因子TNF-α、IFN-γ和IL-1β ELISA试剂盒(R&D Systems,Minneapolis,USA)。以下抗体均购自BD Biosciences:FcγⅢ/Ⅱ封闭抗体(clone 2.4G2)、FITC-anti-CD11c(clone HL3)、PE-anti-MHCⅡ(clone H1.2F3)、PE-anti-TLR4(clone GL1)。
1.2方法
1.2.1实验模型建立和脑组织HE染色 雌性:C57BL/6小鼠分别采用腹腔注射方式感染1×106的PbANKA(WT)或PbANKA△pbgpi16(△pbgpi16)的pRBCs。吉姆萨染色的尾血薄血膜法镜检感染率并每日观察死亡率。当WT组小鼠感染后第6天(d6)出现神经性症状时,每组各取5只小鼠处死。取出鼠脑并用4%的多聚甲醛固定24 h后,石蜡包埋室温凝固。脑组织连续取5 μm厚切片,60℃烤片12 h,梯度脱蜡脱苯后采用3%柠檬酸钠90℃ 15 min 抗原修复。组织切片进行苏木素伊红染色(HE)检测微血管梗阻和内皮细胞损伤,取血管中有白细胞浸润血管为阳性。
1.2.2RNA提取和实时定量PCR(qPCR) WT或△pbgpi16感染后d2、d4、d6和d8,分别取各组小鼠5只,处死后解剖感染小鼠脑组织及脾组织进行相关炎症因子及趋化因子检测。脑组织及脾组织RNA提取方法如组织RNA提取试剂盒说明书,提取RNA置于-80℃待用。PbA-WT或△pbgpi16组各取1 μg RNA进行反转录,反转录后的cDNA存放于-20℃待用。采用qPCR方法检测小鼠脑中CXCL9、CXCL10、CXCR3和脾中TNF-α、IFN-γ和 IL-1β的表达水平,β-actin设为内参。
1.2.3血清和脾细胞培养上清中细胞因子检测 于小鼠感染WT或△pbgpi16后d2、d4、d6和d8分别取各组小鼠5只,处死后解剖感染小鼠脾组织及血清进行相关炎症因子检测,其中用MSD Proinflammatory Panel 1 cytokine assay kits试剂盒来测量血清中 TNF-α、IFN-γ、IL-1β的水平。实验通过高通量法检测小鼠血清中的各种炎症因子变化情况。每组均设置标准曲线,细胞因子的浓度用标准曲线计算(pg/ml)。 脾组织经研磨后,用0.17 mol/L氯化铵裂解红细胞,RPMI1640培养液洗涤3次后,细胞计数板计数,脾细胞1×106/孔,37℃培养48 h。收集脾细胞培养上清用于脾细胞因子TNF-α、IFN-γ和IL-1β的定量分析。
1.2.4流式细胞术 于小鼠感染WT或△pbgpi16后d2、d4、d6和d8分别取各组小鼠5只,分离脾细胞进行流式细胞检测。取5×106脾细胞,采用FITC-anti-CD11c和PE-anti-MHCⅡ或 PE-anti-TLR4进行细胞膜双染标记DCs,染色结束细胞PBS洗涤后重悬4℃保存,待流式细胞仪检测。染色细胞用FACSCalibur流式细胞仪(BD Bioscience)进行分析,各组均设抗体单标记及阴性对照,细胞检测数为100 000。用FlowJo软件(TreeStar)进行数据分析。
2 结果
2.1PbGPI16缺陷降低C57BL/6小鼠实验性脑疟发病率 WT组小鼠在d6出现神经性症状,并在d5至d12之间出现死亡(图1A)。<30%的△pbgpi16感染组小鼠死于实验性脑疟,>70%小鼠在感染后d12始出现死亡。与WT组相比,△pbgpi16感染的小鼠在各检测时间点呈现出相对较低的原虫血症(图1B)。
2.2△pbgpi16感染小鼠实验性脑疟病理改变降低 为明确ECM的病理损伤程度,采用免疫组化方法常规检测脑血管壁完整性[10]。通过HE染色结果发现,△pbgpi16感染小鼠的脑组织中白细胞浸润血管数明显少于WT组小鼠(图2)。
2.3Δpbgpi16感染小鼠脑组织和脾细胞中趋化因子和前炎症细胞因子转录水平下降 qPCR实验结果显示在△pbgpi16感染小鼠脑组织中CXCL9、CXCL10和CXCR3转录水平降低(图3)。与WT组小鼠相比,△pbgpi16感染小鼠脾组织中TNF-α、IFN-γ和IL-1β的mRNA的转录水平明显下降(图3)。
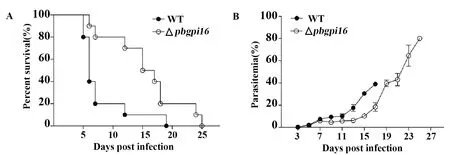
图1 伯氏疟原虫PbGPI16缺失降低C57BL/6小鼠ECM发病率Fig.1 PbGPI16 deficient reduce ECM morbidityNote: A.Parasitemia;B.Survival rate.
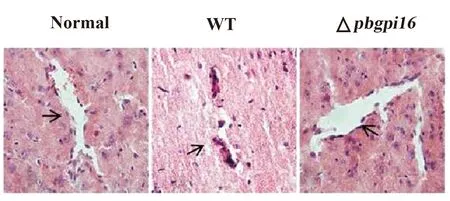
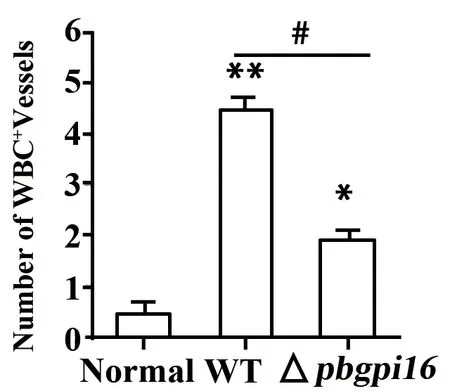
图2△pbgpi16感染小鼠ECM的脑病理损伤减少
Fig.2PathologicaldamageofECMinmiceinfectedwith△pbgpi16decreased
Note: During the statistical process,the microvasculature changes were observed in 20 visual fields under each microscope in each mouse,and 5 mice in each group were randomly compared with the normal control group.*.P<0.05,**.P<0.01,#.P<0.05.
2.4△pbgpi16感染小鼠前炎症反应下降 WT组中脑疟相关前炎症因子于感染后开始升高,在第4到6天出现ECM症状时达到高峰(图4)。与WT组小鼠相比,△pbgpi16感染小鼠脾细胞培养上清中TNF-α、IFN-γ和IL-1β的表达水平明显下降。血清中上述细胞因子通过MSD方法检测,结果显示相对于WT组,△pbgpi16感染小鼠的血清中上述细胞因子浓度均显著下降(图4)。
2.5PbGPI16缺陷疟原虫感染C57BL/6小鼠脾组织中树突状细胞的分化成熟显著延迟采用FACS计数各组感染小鼠不同时间点相关树突细胞变化情况(图5)。流式结果表明WT和△pbgpi16组中,感染后d2小鼠脾组织中DCs均开始活化,并表达MHCⅡ分子及TLR4分子。但△pbgpi16感染小鼠脾组织中成熟的DCs(CD11c+MHC+)及表达TLR4分子的DCs(CD11c+TLR4+)细胞绝对数较WT组小鼠明显下降。

图3 脑组织和脾组织中趋化因子和细胞因子的mRNA 表达水平Fig.3 mRNA expression levels of chemokines and cytokines in brain tissues and splenic tissuesNote: A-C.The transcriptional level of CXCL9,CXCL10 and CXCR3 mRNA at different time points in brain tissue;D-F.mRNA transcriptional level of TNF-α,IFN-γ and IL-1β at different time points in spleen tissue.*.P<0.05,**.P<0.01,#.P<0.05,##.P<0.01.
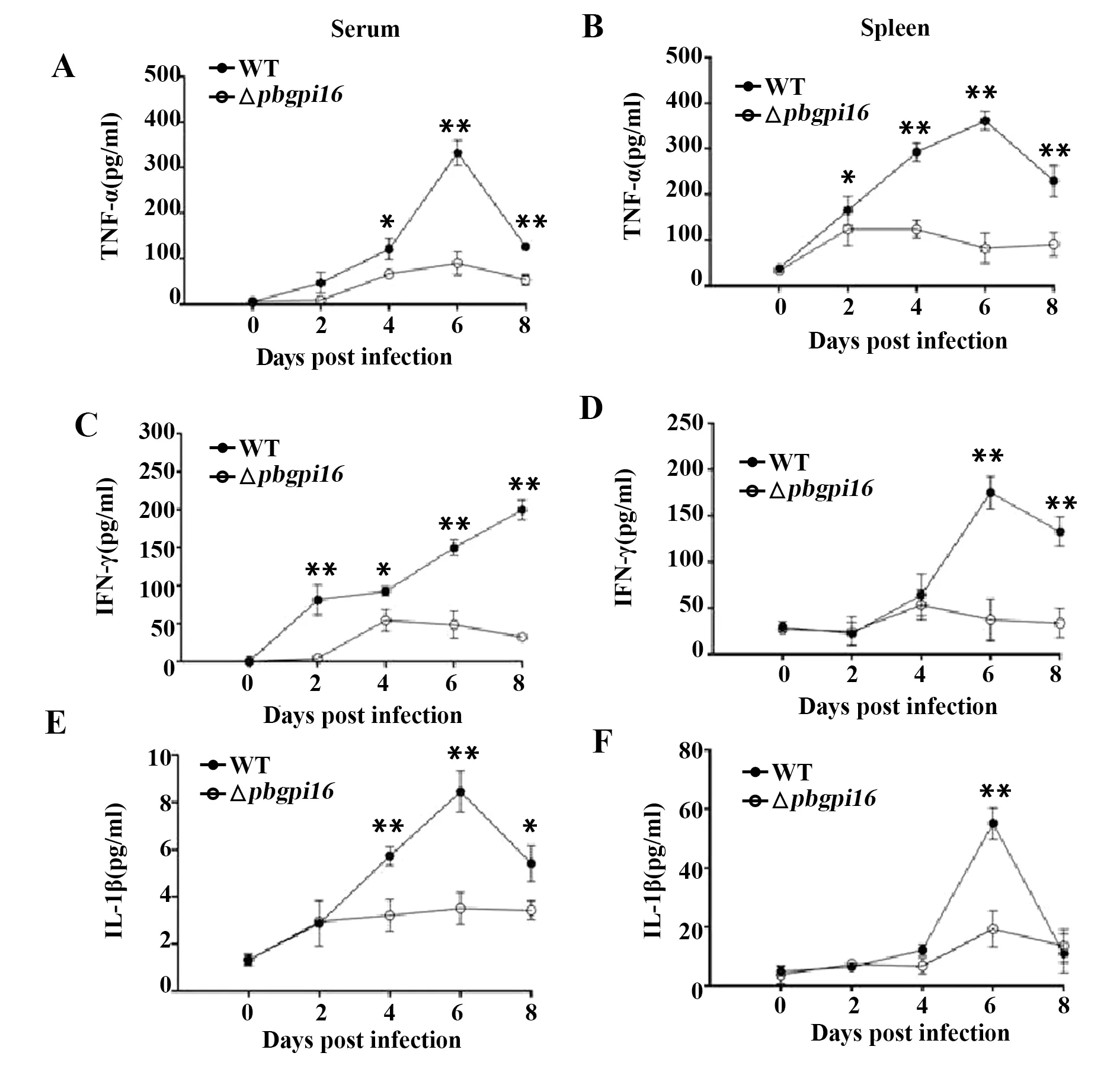
图4 血清和脾细胞培养上清中TNF-α,IFN-γ和IL-1β的表达水平Fig.4 Expression levels of TNF-α,IFN-γ and IL-1β in serum and splenocytes supernatantNote: A,C,E.The levels of TNF-α,IFN-γ and IL-1β at different time points in infected mice serum;B,D,F.The changes of TNF-α,IFN-γ and IL-1β at different time points in splenocytes supernatant.n=5.*.P<0.05,**.P<0.01.

图5 WT和△pbgpi16组小鼠脾组织中表达MHCⅡ及TLR4分子DCs计数Fig.5 Expression of MHCⅡ and TLR4 DCs in spleen tissue of mice in WT and △pbgpi16 groupNote: A.The percentage of CD11c+ MHCⅡ+ cells;B.The percentage of CD11c+ TLR4+ cells;C.The absolute number of CD11c+ MHCⅡ+ cells;D.The absolute number of CD11c+ MHCⅡ+ cells.*.P<0.05 and **.P<0.01 indicates significant differences between the experimental group and the normal mice.##.P<0.01,indicates significant differences between WT and △pbgpi16 group mice.
3 讨论
脑疟的发病机制尚不明确。目前已明确宿主过度的保护性免疫应答反应是诱发脑疟的免疫学基础[11]。疟原虫GPIs及GPI锚定蛋白可引发前炎症反应[12]。生物信息学分析显示PbGPI16是伯氏疟原虫GPI-T复合体中的亚基之一。免疫印迹和免疫荧光方法检测显示,pbgpi16基因敲除疟原虫虫株(△pbgpi16)的MSP1、MSP4和MSP10在细胞膜表面锚定数量明显减少。MSP1、MSP4、MSP10均为疟原虫裂殖子表面的GPI锚定蛋白[13],故我们推测△pbgpi16疟原虫虫体内GPI-T复合体的功能受损,转运至原虫表面的GPIs和GPI锚定蛋白下降,从而导致△pbgpi16激活宿主免疫反应的能力下调。
大量研究证实,前炎症细胞因子和趋化因子参与脑疟免疫应答[14]。疟原虫的GPIs及GPI锚定蛋白可以刺激宿主淋巴细胞产生TNF-α和IFN-γ,高浓度的TNF-α和IFN-γ进而促进CXCL9、CXCL10和CXCR3的表达,导致脑内的T淋巴细胞病理性堆积[15]。本研究通过对比野生型PbA感染的小鼠发现,在△pbgpi16虫株感染的C57BL/6小鼠血脑屏障损伤程度明显下降,且感染小鼠脑内CXCL9、CXCL10和CXCR3等趋化因子mRNA表达水平也明显低于野生型PbA感染小鼠。同时,△pbgpi16虫株感染的C57BL/6小鼠脾组织中TNF-α、IFN-γ和IL-1β的表达亦明显下调。IL-1β可以诱导机体产生前列腺素并且引起发热等疟疾相关临床症状[16]。上述细胞因子在△pbgpi16虫株感染的C57BL/6小鼠脾组织中转录水平下调可能是宿主不发生脑疟症状的主要原因。同时,△pbgpi16感染小鼠血清和脾细胞培养上清液中TNF-α、IFN-γ、IL-1β的低表达与△pbgpi16感染小鼠脑中微血管的病理性损伤和ECM相关症状减轻相符。
在疟疾感染过程中,DCs细胞通过TLRs被激活[17]。活化TLRs可以激活自噬细胞产生IFN-γ进而促进宿主体内Th1细胞的分化[18]。有研究表明,在恶性疟原虫感染的过程中,疟原虫GPIs与GPI锚定蛋白主要通过TLR2和TLR4介导宿主体内相关前炎症反应[19]。本研究中我们发现,与野生型PbA感染小鼠比较,△pbgpi16感染小鼠的DCs细胞表面参与抗原提呈的MHCⅡ和TLR4表达显著下降,提示△pbgpi16原虫激活宿主DCs活化能力下降。疟疾感染过程中以CD4+T细胞为主导的前炎症免疫应答需要DCs提呈原虫抗原,因此,△pbgpi16感染小鼠DCs活化水平下降可能是小鼠病理症状减轻的主要原因。
综上所述,与野生型PbA感染小鼠相比,△pbgpi16原虫感染小鼠血脑屏障损害明显减轻。△pbgpi16基因敲除虫株体内GPI-T复合体中PbGPI16缺失导致GPI-T复合体结构完整性破坏,致使疟原虫表面GPIs及GPI锚定蛋白数量减少, DCs活化水平下调,从而导致以Th1细胞为主的前炎症反应明显下降,感染小鼠脾组织中的TNF-α、IFN-γ和IL-1β及脑中的CXCL9、CXCL10和CXCR3表达明显下降,进而小鼠感染疟疾后脑疟病理症状显著减轻。以上实验结果提示,疟原虫的PbGPI16在ECM的发生发展过程中起关键作用。