程序性死亡配体-1在食管鳞癌中的表达及临床意义
2018-10-11姚童翔原翔刘怡文夏金张耀文李剑周福有
姚童翔,原翔,刘怡文,夏金,张耀文,李剑,周福有
[1.新乡医学院,河南 新乡 453003;2.河南省肿瘤表观遗传重点实验室,河南 洛阳471003;3.河南科技大学第四附属医院(安阳市肿瘤医院)胸外科,河南 安阳 455000]
食管癌是我国常见的恶性肿瘤,中国疾病控制与预防中心数据显示,食管癌在我国的每年发病人数约为22万人以上,死亡人数每年则高达19+万人[1]。食管 鳞 癌(esophageal squamous cell carcinoma, ESCC)是亚洲食管癌的主要病理类型,约占食管癌的90%以上[2],河南省林州市及其毗邻的辉县,安阳等地是我国,也是世界上食管癌发病率和死亡率最高的地区[3]。大多数患者确诊时已属晚期或伴有远处转移,预后差,5年生存率极低[4]。肿瘤免疫抑制在促进肿瘤发展的同时减弱抗肿瘤治疗的疗效[5],程序性死亡配体-1(programmed death ligand-1, PD-L1)是一个主要的调控免疫抑制的分子,PD-L1属于B7超家族,主要在T细胞、B细胞、树突状细胞、炎症反应细胞和恶性肿瘤细胞中表达[6],与程序性死亡-1(programmed cell death-1, PD1)结合后可以提供抑制性信号,抑制T细胞的活化和增殖,诱导T细胞凋亡,使肿瘤细胞逃避免疫杀伤[7],PD-L1高表达于各种实体恶性肿瘤,并且可诱导T淋巴细胞的凋亡[8],抗PD1/PD-L1通路的药物在在黑色素瘤、非小细胞肺癌等领域取得很大的成功[9],本研究将分析PD-L1在50例食管鳞癌患者中表达特征和其临床意义及预后价值。
1 资料与方法
1.1 一般研究
选取2014年1月-2014年6月于河南科技大学第四附属医院(安阳市肿瘤医院)接受手术治疗的食管癌患者,50例食管鳞癌组织及相应癌旁组织(距肿瘤切缘>5 cm)标本,全部患者均经病理学确诊为食管鳞癌。男31例、女19例;年龄42~79岁,平均(61.3±8.3)岁;高分化+中分化40例、低分化10例;根据美国癌症联合会(AJCC)食管癌第7版TNM分期标准:Ⅰ期8例、Ⅱ期29例、Ⅲ期13例;发生淋巴结转移13例。所有患者术前均未接受放化疗及免疫治疗,并于术前获得患者书面知情同意。该项目通过医院伦理委员会的同意。
1.2 免疫组织化学检测PD-L1
采用免疫组织化学(简称免疫组化)SP超敏试剂盒(中杉金桥产品编号SP-9000)检测食管癌及其相应癌旁组织中PD-L1(抗兔单克隆抗体1∶200,Abcam)的表达。由2位副高职称以上的病理医师双盲阅片,随机挑选5个高倍镜视野观察,根据染色强度(0,阴性;1,弱阳性;2,中度阳性;3,强阳性)和阳性肿瘤细胞数(0,<5%;1,5%~25%;2,25%~75%;3,≥75%)乘积对每个视野进行免疫评分:0为阴性;1~12为阳性,5个视野免疫评分均值为最终结果。
1.3 Western blot检测PD-L1
提取组织蛋白后,用BCA法进行蛋白定量(康为)。用10%SDS-聚丙烯酰胺凝胶进行上层胶恒压90 V/30 min,下层胶恒压120 V/60 min电泳,切胶后采用“三明治夹心法”,恒压90 V/150 min转膜,5%脱脂奶粉封闭PVDF膜1 h,TBST清洗1次,30 s/次,加入PD-L1兔一抗(1∶1 000,Abcam)和内参GAPDH(1∶2 000康为)4℃过夜,TBST清洗3次,5 min/次,加入兔二抗(1∶2 000,康为)室温孵育2 h,再用TBST漂洗3次,5 min/次,ECL(美国invitrogen公司)处理PVDF膜后用凝胶成像系统(美国BIO-RAD公司)检测目的蛋白条带,Image Lab软件对蛋白条带灰度进行定量分析。
1.4 随访
50例食管鳞癌患者术后随访时间30个月。生存时间定义为手术日期至最后一次随访日期或死亡,未删失数据为由食管癌导致的死亡患者,删失数据为随访至30个月仍存活患者。
1.5 统计学方法
数据进分析采用SPSS 23.0统计软件,计量资料以均数±标准差(±s)表示,采用配对t检验;计量资料采用χ2检验。应用Kaplan-Meier绘制生存曲线并以Log-rank检验生存时间之间差异,单因素分析应用Log-rank检验,多因素Cox回归计算风险比例(hazard ratios, HR)及其95%CI,分析各因素对食管鳞癌预后的影响,P<0.05为差异有统计学意义。
2 结果
2.1 食管癌与癌旁组织中PD-L1蛋白的表达情况
PD-L1的阳性表达为胞膜出现棕黄色颗粒,部分胞浆也有表达。部分食管鳞癌及癌旁组织中可见PD-L1阳性表达。食管鳞癌组织组与相应癌旁组织组比较,差异有统计学意义(χ2=13.848,P=0.006),食管鳞癌组织中PD-L1阳性表达率高于相应癌旁组织组,且随着分化程度的降低,PD-L1免疫组化评分逐渐升高。见表1和图1。

表1 组织样本中PD-L1蛋白表达

图1 食管鳞癌中PD-L1的表达 (IHC×400)
2.2 食管癌与癌旁组织中PD-L1蛋白的表达
PD-L1蛋白的分子量约为33 kD。应用Image lab软件将灰度值进行定量分析,并对结果进行统计学分析,食管鳞癌组织组与相应癌旁组织组比较,差异有统计学意义(t=3.612,P=0.000),食管鳞癌组织组PD-L1蛋白表达(灰度均值为4.086±1.060)高于相应癌旁组织组(灰度均值为1.884±0.642)。见图2。
2.3 PD-L1蛋白表达与食管鳞癌临床病理特征的相关性
PD-L1蛋白表达与肿瘤浸润深度及临床分期相关。见表2。
2.4 PD-L1蛋白表达水平与食管鳞癌患者预后
50例食管鳞癌患者术后30个月的总生存率为66%;PD-L1阳性表达组30个月生存率(38.1%)低于阴性组(86.2%)(χ2=14.311,P=0.000)。见图 3。
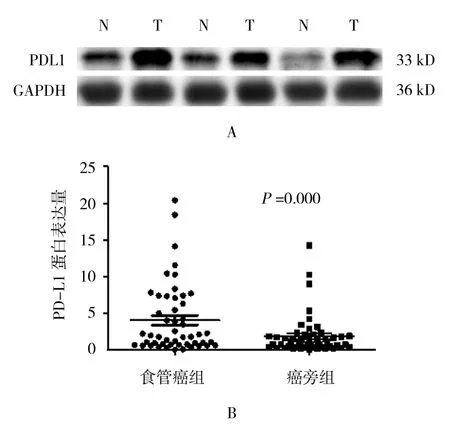
图2 食管鳞癌及相应癌旁组织中PD-L1蛋白表达

表2 PD-L1蛋白表达与食管鳞癌临床病理特征的相关性例(%)
分化程度、淋巴结转移、TNM分期及PD-L1蛋白表达与食管鳞癌患者生存预后相关(见表3)。多变量Cox回归分析结果显示,淋巴结转移与PD-L1表达是食管鳞癌患者生存的预后因素。见表4。
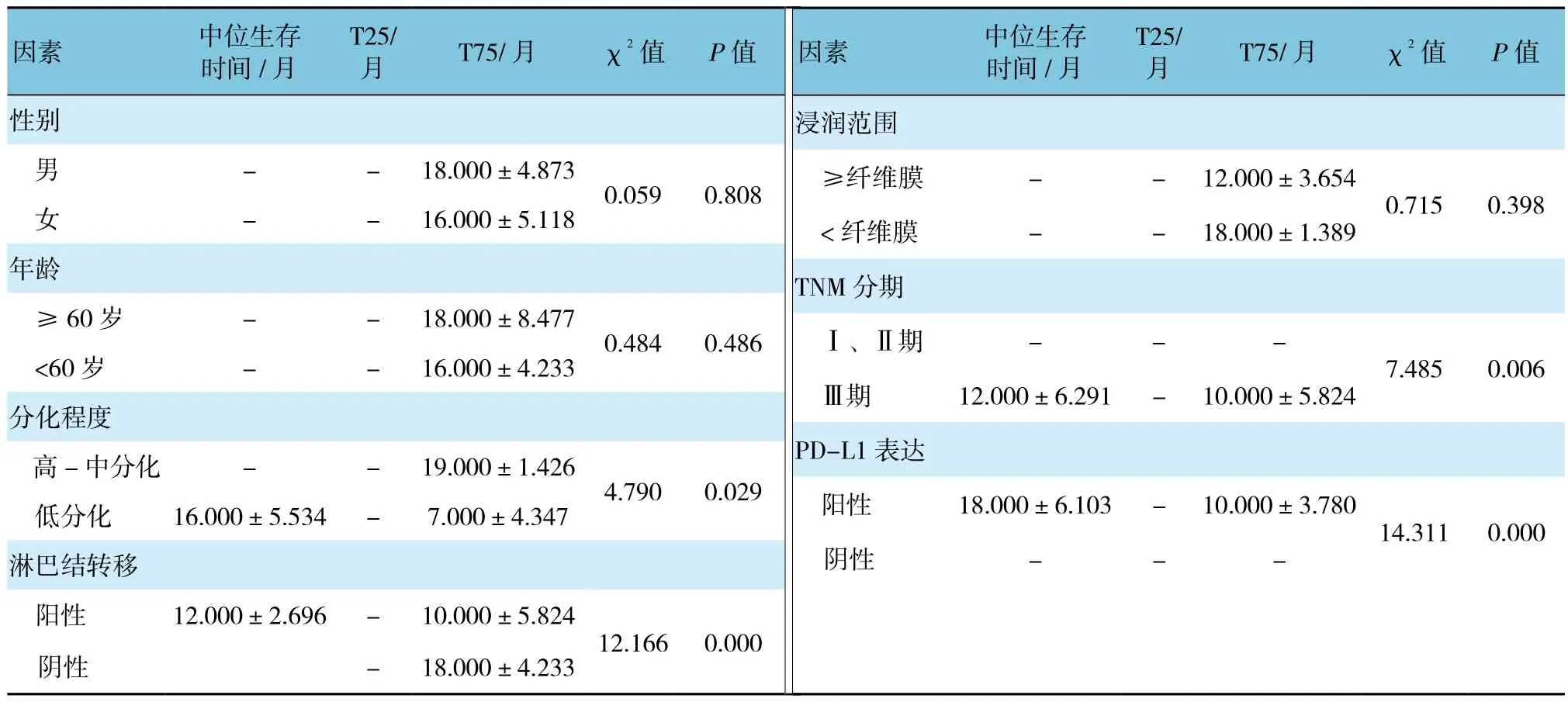
表3 食管鳞癌患者预后Log-rank检验

表4 食管鳞癌患者预后的多因素Cox回归分析

图3 食管鳞癌患者Kaplan-Meier生存曲线
3 讨论
肿瘤免疫逃逸是肿瘤发生、发展过程中的关键环节。肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)被认为是机体对肿瘤细胞特异性免疫反应的效应细胞[10],临床研究表明,TIL在肿瘤(包括食管癌)中发挥关键作用并具有预后意义[11]。由于肿瘤组织不表达或极少量表达MHCⅡ类分子,因此认为抗肿瘤特异性免疫的效应细胞主要为CD8+T细胞,肿瘤特异性CD8+T细胞均高表达PD1,同时许多肿瘤细胞高表达PD-L1分子[12],PD-L1与肿瘤浸润淋巴细胞表达的PD1结合后,可导致PD1胞质区的免疫受体酪氨酸转化基序(ITSM)结构域磷酸化,导致下游信号受到抑制,阻断Akt和PI3K的活性,干扰IL-2的分泌,减弱TCR/CD28信号对免疫细胞的活化作用[13],最终抑制T淋巴细胞增殖和相关细胞因子的分泌,进而抑制机体的抗肿瘤免疫。除了能直接抑制TIL的功能外,PD-L1还可以通过调节T细胞分化调节抗肿瘤免疫,研究[14]表明,CD4+CD25+Foxp3+Treg是具免疫负性调节功能的细胞群,通过细胞分泌白介素10、转化生长因子β等免疫负性细胞因子抑制免疫应答。PD-L1可促进CD4+CD25+Foxp3-T向CD4+CD25+Foxp3+Treg转化[15],使用单克隆抗体阻断PD-L1,可减少Treg产生,并且Treg凋亡加速。GENG等[16]发现,PD-L1能有效促进Treg分泌白介素10,进而发挥免疫抑制作用。本研究均表明PD-L1在肿瘤免疫逃逸过程中发挥重要作用。
肿瘤浸润和转移是恶性肿瘤最重要的生物学特征,也是影响肿瘤患者预后的主要因素。上皮细胞间质化(epithelial-mesenchymal transition, EMT)是指上皮细胞失去极性,细胞间紧密连接及黏附连接消失,变成了具有间质细胞形态和功能的细胞,Ⅲ型EMT与肿瘤的浸润和转移有关[17],人体90%以上恶性肿瘤是上皮性肿瘤,由于EMT是上皮细胞获得迁移能力的有效途径,因此EMT成为癌症浸润转移的重要途径之一。CAO等[18]在小鼠皮肤肿瘤模型中发现,PD-L1可促进肿瘤细胞中转录因子Slug和Twist的表达,抑制上皮性钙粘蛋白(E-cadherin)的表达,从而促进EMT的发生,同时在体内实验也证实了PD-L1的过表达可促进EMT的发生。cop9信号小体5(cop9 signalosome 5,CNS5)是CNS的重要组成部分,能增强肿瘤的侵袭、转移能力[19],LIM等[20]通过构建乳腺癌模型,发现肿瘤坏死因子(TNF-α)通过活化p65,促进CSN5表达,CSN5和PD-L1结合后,可使PD-L1去泛素化,增强PD-L1稳定性。本研究表明PD-L1在肿瘤的侵袭、转移过程中起到重要作用。
本研究表明,PD-L1在食管癌组织的表达高于其相应癌旁组织,这与CHEN[4]、OHIGASHIO[21]研究结果一致。CHEN[22]通过免疫组化检测PD-L1在食管癌细胞的表达情况,显示PD-L1主要在细胞浆和细胞膜表达,部分细胞核也有表达,但本组资料仅检测到PD-L1在细胞浆和细胞膜表达。本研究显示,PD-L1的表达水平与食管癌患者性别、年龄、分化程度、区域淋巴结转移无相关性,而与浸润范围、TNM分期相关。PD-L1高表达患者比低表达患者的死亡风险更高,Cox回归分析结果显示PDL是食管癌独立预后因素,与CHEN[22]、LOOS等[23]结果一致。
PD-L1在食管鳞癌的发生、发展中发挥重要作用,可作为食管鳞癌预后判断的潜在指标。PD1/PD-L1通路的激活可导致免疫抑制性肿瘤微环境形成,使肿瘤发生免疫逃逸,而阻断PD1/PDL信号通路可以逆转肿瘤免疫微环境,增强内源性抗肿瘤免疫效应[24]。因此,探讨PD-L1与食管鳞癌发生、发展的关系,进一步研究PD-L1在食管鳞癌发生、发展中的分子机制,使之成为食管鳞癌治疗的新靶点,为食管癌开辟新的治疗途径。
