羟基红花黄素A调控退变软骨终板细胞周期的作用研究
2018-10-11郑为超
张 宇,郑为超,李 冬,牛 凯
(1. 同济大学附属同济医院检验科,上海 200065;2. 安徽理工大学医学院,安徽 淮南 232001)
椎间盘退变性疾病(degenerative disc disease, DDD)已成为严重影响人们生活质量的高发病[1]。目前除生物力学改变为其病因外,IL-1β、TNF-α等炎症因子在发病过程中的重要性逐渐被认识。研究证实,IL-1β在软骨细胞退变及凋亡过程中处于关键地位,是椎间盘退行性病变的病因之一[2-4]。前期研究发现,活血化瘀代表药红花提取物羟基红花黄素A(hydroxy safflower yellow A,HSYA)具有调控IL-1β信号通路,延缓软骨终板细胞凋亡的作用[5],但具体机制尚不明确。本实验研究发现,HSYA能够改变退变软骨终板细胞周期,可能是HSYA抑制退变软骨终板细胞凋亡的机制之一。
1 材料
1.1实验动物健康昆明种小鼠,♀♂各半,SPF级,4周龄,购自上海莱克实验动物有限责任公司,许可证编号:SCXK(沪)2007-0005。
1.2试剂完全培养基DMEM、胎牛血清,购自Gibco公司;胰蛋白酶购自Promega公司;细胞因子IL-1β购自Prospec公司;增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、p53、p21抗体,均购自Santa cruz公司;β-actin抗体购自CST公司;Dylight二抗购自上海西美杰公司;Ⅱ型胶原酶购自Sigma公司;CCK-8试剂盒购自DOJINDO公司;RNA逆转录试剂盒、SYBR Premix Ex Taq试剂盒,购自大连宝生公司;引物为Invitrogen公司上海合成部生产;碘化丙啶为北京宝赛公司产品。
1.3仪器BNA-311型培养箱(Espec公司);酶标仪(美国Themo公司);Odyssey近红外扫描仪(美国LICOR公司);FACSCalibur流式细胞仪(美国BD公司);CFX96 PCR仪(美国Bio-Rad公司)。
2 方法
2.1椎间盘软骨终板细胞的分离培养及诱导、分组将小鼠断颈处死。无菌的条件下剪开背部皮肤,体视学显微镜下用手术刀削取L1-L5椎间盘软骨,放入PBS培养皿中,清除血污及其它组织。用含100 kU·L-1青-链霉素的PBS缓冲液冲洗后,移入超净台,将软骨组织尽量剪碎。加入2 g·L-1的Ⅱ型胶原酶3 mL,将培养皿放置恒温摇箱中,37℃消化3~4 h。大部分细胞游离时,采用移液器将细胞吹打成单细胞悬液,加入3 mL体积分数10%胎牛血清的DMEM培养基中和后,用15 mL离心管收集细胞,在低温离心机中1 000 r·min-1离心5 min,弃上清液,加入10%胎牛血清的DMEM培养基,用吸管轻轻吹打,使细胞悬液均匀分布。待细胞长至90%时,传代分组。正常组换成含1%胎牛血清的DMEM,诱导组换成诱导培养基(IL-1β浓度为10 μg·L-1的含1%胎牛血清DMEM)后培养,给药组用不同浓度HSYA加诱导培养基。如:细胞增殖检测、流式细胞仪分析、real-time PCR检测的实验分为6组:正常组、诱导组、4组给药组。其中,给药组HSYA浓度分别为10-4、10-5、10-6、10-7mol·L-1;Western blot给药组HSYA浓度为10-5mol·L-1。
2.2CCK-8法检测不同时间点各组细胞增殖情况将第3代软骨细胞按4×104个接种于2块96孔酶标板中,每孔100 μL,除6组实验组外,设立空白对照组,不接种细胞,每组3个复孔。分别培养1、3、5、7、9 d。换新鲜DMEM 100 μL,每孔内加新鲜配制的CCK-8溶液10 μL,37℃孵育2 h后,振荡2 min。在全自动酶标仪上检测光密度OD值,检测波长为450 nm。
2.3流式细胞仪分析细胞周期消化细胞大约5×105个,PBS漂洗后,用体积分数为70%的乙醇制成单细胞悬液,固定过夜,次日1 500 r·min-1离心5 min,弃上清,PBS漂洗后,加入终浓度为20 mg·L-1RNAnase ,37°C消化1 h,离心弃上清,加入碘化丙啶5 min后,上机检测。
2.4Real-timeRT-PCR检测细胞周期及凋亡相关基因p53、Bax、Bcl-2mRNA的表达提取细胞总RNA,经紫外分光光度仪检测RNA含量和纯度。按照逆转录试剂盒说明,将RNA逆转录成cDNA,反应条件如下:37℃ 15 min,85℃ 5 s。Real-time PCR反应体系为20 μL:SYBR Premix Ex Taq 10 μL,去离子水7 μL,上、下游引物各1 μL,模板cDNA 1 μL。反应过程如下:95℃预变性10 min,进入循环,95℃变性20 s,退火5 s(p53、Bax、Bcl-xl、β-actin的退火温度分别为58℃、60℃、56℃、58℃),72℃延伸20 s,循环扩增,循环次数均为40次,最终72℃延伸10 min。反应结束后,以每一样体所含p53、Bax、Bcl-xl mRNA的拷贝数和其β-actin内参基因的拷贝数的比值进行比较。采用-△△CT法比较各组基因表达情况。引物序列如下:p53上游引物5′-GCTCACCCTGGCTAAAGTTCTG-3′,下游引物5′-AGTCGCTACCTACAGCCAGGAT-3′;Bax上游引物5′-GGTT GCCCTCTTCTACTTTGC-3′,下游引物5′-TCTTCCAG ATGGTGAGCGAG-3′;Bcl-xl上游引物5′-CCCCCCA CATCTCAGTTCTCT-3′,下游引物5′-GCCTCCAAGG AGCTGGTTTAG-3′;β-actin上游引物5′-GGAGATT ACTGCCCTGGCTCCTA-3′,下游引物5′-GACTCA TCGTACTCCTGCTTGCTG-3′。
2.5Western blot检测蛋白表达以每孔每毫升1×105个细胞,放置于6 cm培养皿中。用RIPA试剂裂解细胞。测定蛋白浓度,确保每个蛋白样品的上样量一致。沸水中蛋白变性5 min,4℃冷却,待用。12%的SDS-PAGE分离胶,取20 μL样品(约30 μg蛋白)上样,以100 V恒压电泳。300 mA,90 min转移至PVDF膜,用含5% BSA的TBST室温封闭1 h。一抗(1 ∶1 000)4℃孵育过夜。TBST洗膜2次,每次10 min,用Dylight标记相应二抗室温孵育30 min。TBS(0.1 mol·L-1NaCl,0.1 mol·L-1Tris-HCl,pH7.5)洗膜3次,每次10 min,在红外激光成像系统Odeyssey上成像。数据用样品与β-actin的比值表示。

3 结果
3.1HSYA对退变软骨细胞增殖的影响各组大约在5 d开始进入对数生长期,7 d后进入平台期,9 d后逐渐进入衰退期,其中,诱导组相对于正常对照组,进入对数生长期起峰较低,且进入平台期OD值也低于正常对照组,各HSYA给药组对数生长期及平台期OD值均高于诱导组。与正常对照组比较,诱导组IL-1β在不同时间段对软骨终板细胞增殖均具有抑制作用。不同浓度的HSYA均可拮抗IL-1β对软骨细胞增殖的抑制作用,与诱导组比较差异有统计学意义(P<0.05),HSYA各浓度组之间比较差异无显著性,见Tab 1。

Tab 1 Proliferation of cartilage endplates in each group n=3)
#P<0.05vsnormal;*P<0.05vsinduced
3.2HSYA对退变软骨细胞周期的影响如Fig 1所示,诱导组S期比例较正常组S期比例高,各给药组S期细胞比例较诱导组低,其中以HSYA(10-5、10-6mol·L-1)组最为接近正常组。
3.3HSYA对退变软骨细胞周期相关基因表达的影响加药24、48 h后,分别检测各组mRNA。如Fig 2所示,诱导组p53 mRNA表达较正常组高,各给药组p53 mRNA表达量低于诱导组,差异有统计学意义(P<0.05),其中,以HSYA 10-5mol·L-1组p53表达最低;诱导组Bcl-xl mRNA表达低于正常组及HSYA给药组;诱导组Bax mRNA表达高于正常组及HSYA给药组。
3.4HSYA对退变软骨细胞周期相关蛋白表达的影响如Fig 3所示,加药培养24 h后,HSYA 10-5mol·L-1组PCNA蛋白表达量较诱导组高,较正常组低;诱导组p53、p21表达高于正常组及HSYA 10-5mol·L-1组。
4 讨论
软骨终板细胞凋亡是导致椎间盘退变的重要原因之一[6-7]。炎症因子IL-1β的表达和释放,可导致软骨终板细胞的凋亡及退变[8]。因此,减少IL-1β分泌,拮抗其作用,可以延缓椎间盘退变进程。正常软骨细胞中,p53与Puma结合,无生物学活性。炎症因子作用下,p53被激活,核内p53水平增加,转录激活Puma,Puma与p53解离后与Bcl-xL的结合,释放p53,p53直接激活Bax,改变线粒体通透性,促进细胞凋亡[9]。HSYA能够通过下调p53蛋白表达,发挥抑制退变细胞凋亡的作用。
炎症刺激下,DNA损伤后,可引起p53依赖的细胞周期阻滞,p53表达升高,激活下游分子p21[10]。后者通过C端结构域与不溶性PCNA结合,抑制其活性,阻止损伤DNA长链复制。不溶性PCNA在G0-G1期细胞中无明显表达,G1晚期,其表达大幅度增加,S期达到高峰,G2-M期明显下降,其量的变化与DNA合成一致,检测其在细胞中的表达,可作为评价细胞增殖状态的一个指标[11]。实验结果显示,软骨终板细胞退变后PCNA表达下降,HSYA可一定程度上调PCNA表达,这与细胞增殖检测结果相同,提示HSYA能够部分拮抗IL-1β抑制细胞增殖的作用,上调PCNA表达。流式结果显示,退变后细胞S期增高,则可能是由于IL-1β导致DNA损伤后,细胞首先启动损伤感应机制,细胞生长发生停滞,继而启动DNA修复,修复成功细胞可进入下一周期,修复失败细胞将启动凋亡机制[12-13]。正常组及各药物组细胞已进入下一周期,而退变细胞组细胞生长停滞,进行DNA修复,S期
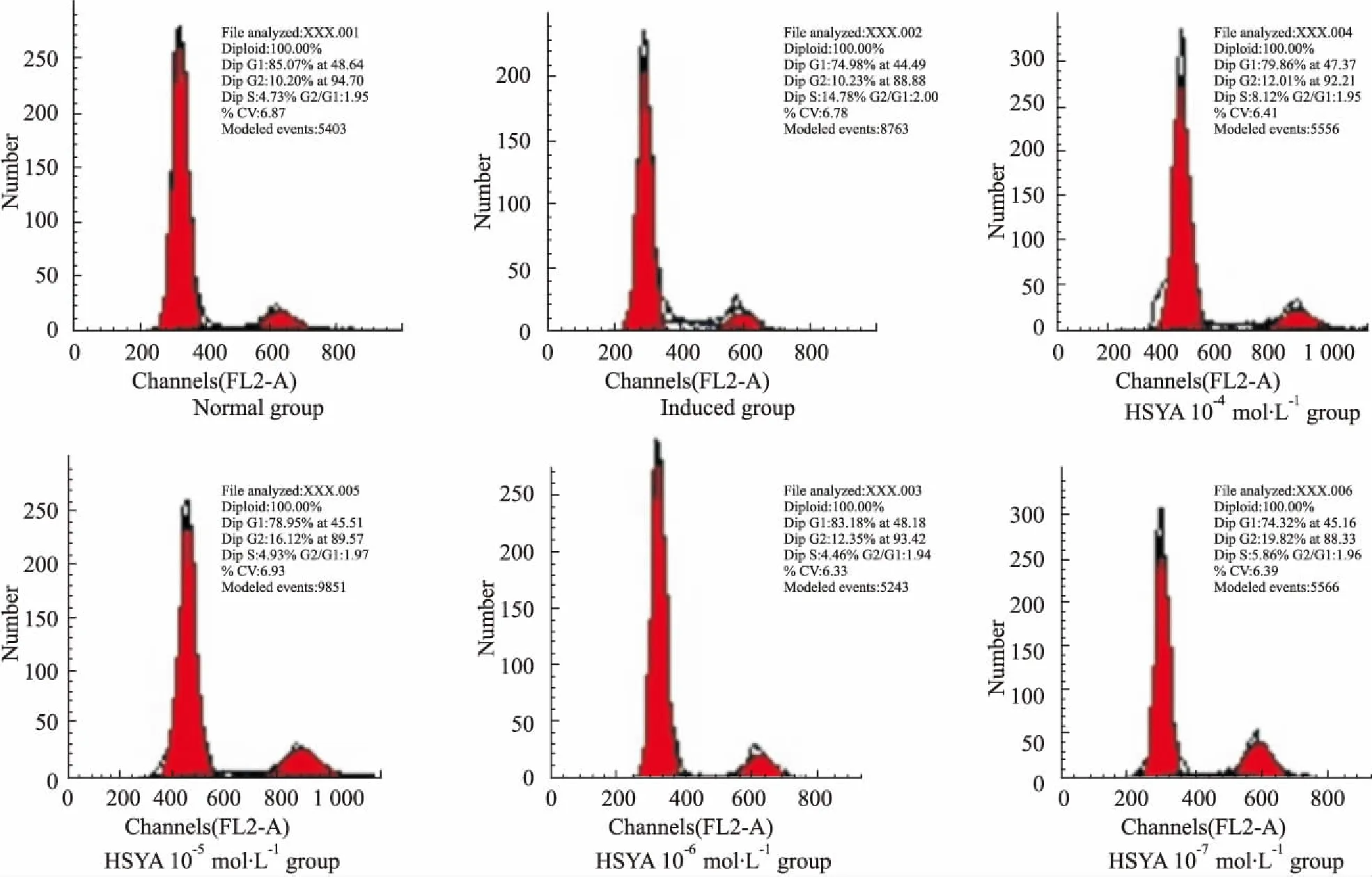
Fig 1 Results of testing cell cycle after 24 h administration
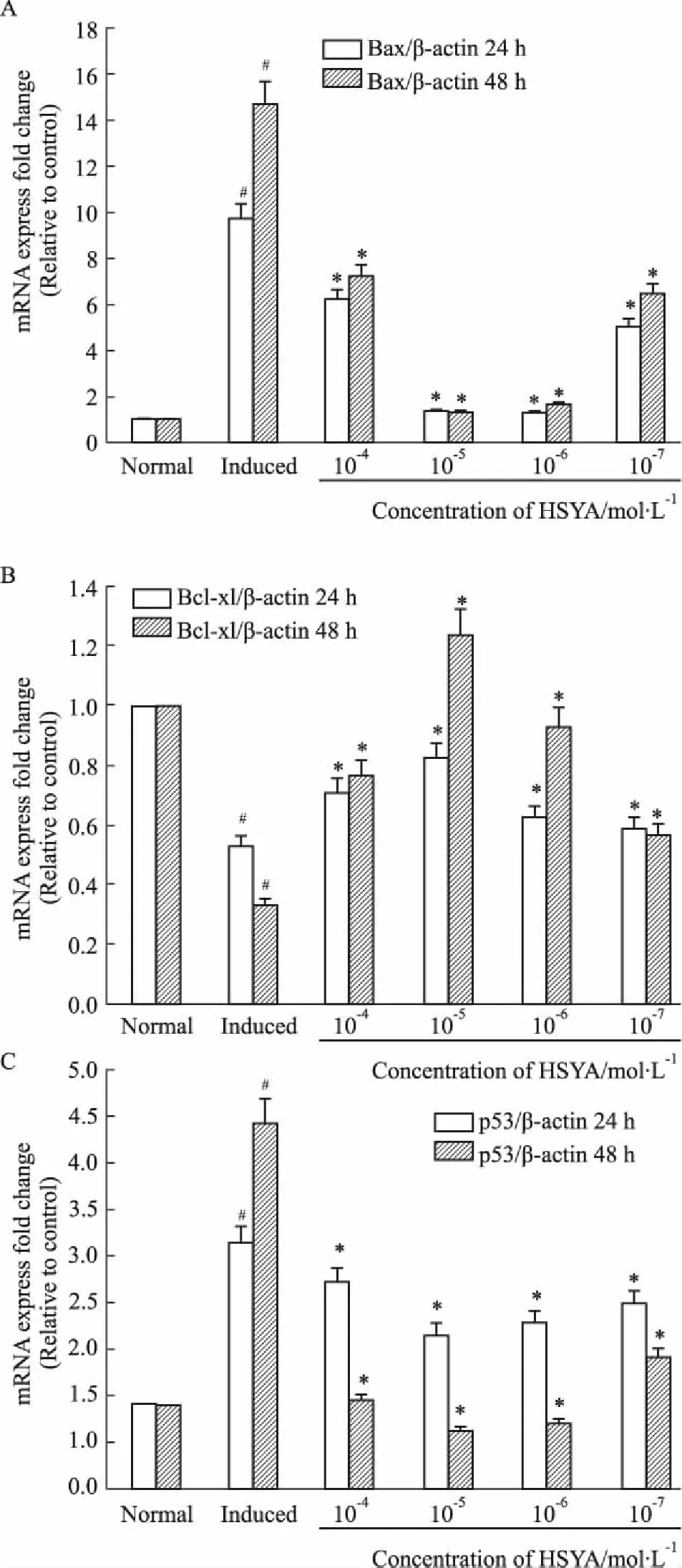
Fig 2 The mRNA expression levels of Bcl-xl (A),
A. The mRNA expression levels of Bcl-xl in each group, after administrated for 24 and 48 hours; B. The mRNA expression levels of Bax in each group, after administrated for 24 and 48 hours; C. The mRNA expression levels of p53 in each group, after administrated for 24 and 48 hours;#P<0.05vsnormal group;*P<0.05vsinduced group
比例较高,细胞凋亡增加[11]。
前期实验主要证实了IL-1β可诱导软骨终板细胞发生退变及凋亡,HSYA具有拮抗IL-1β作用[5],但其具体机制尚不明确。本研究通过对凋亡及细胞周期上游蛋白的检测,进一步发现HSYA能够改变退变软骨细胞周期,这可能是其拮抗IL-1β诱导的软骨细胞凋亡的作用途径之一。
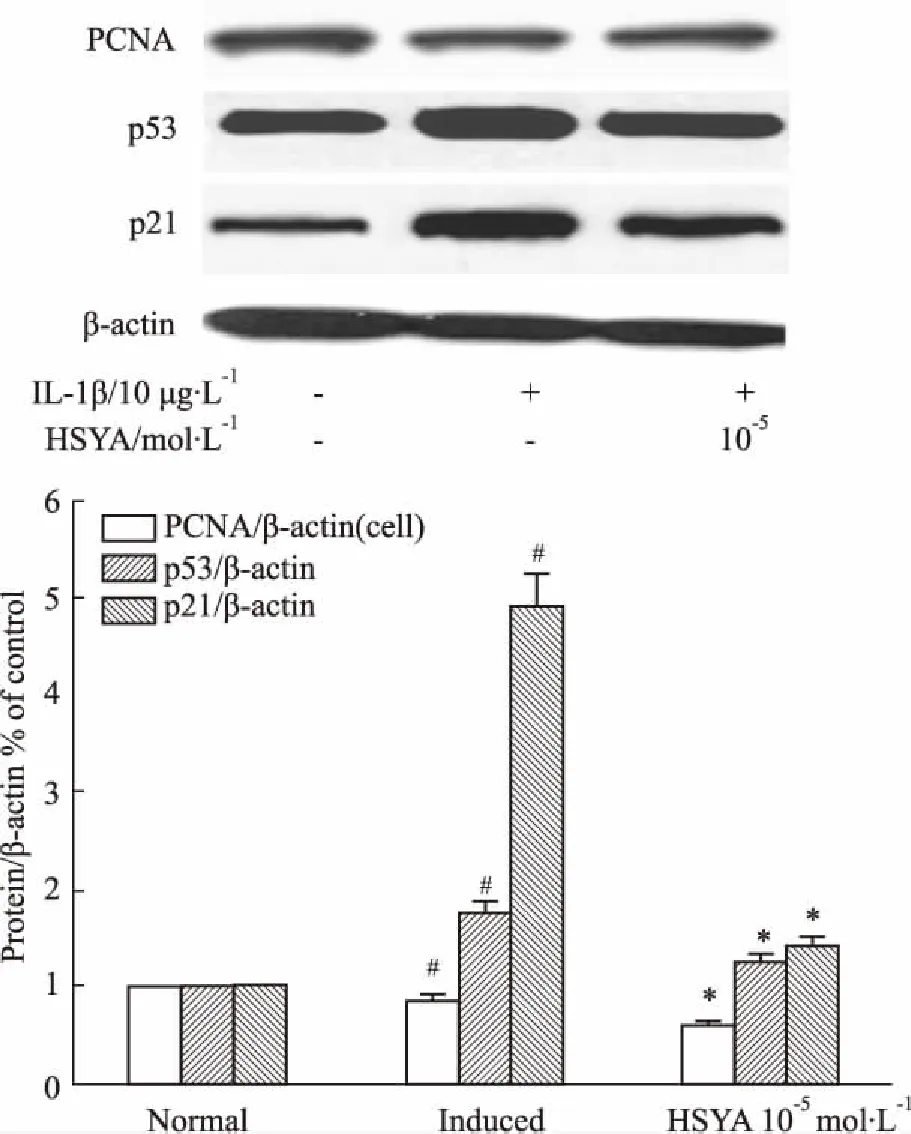
Fig 3 The protein expression levels of PCNA, p53 and
#P<0.05vsnormal group;*P<0.05vsinduced group
综上所述,本研究证实了HSYA具有上调PCNA,下调p53、p21的作用。HSYA可通过调节细胞周期相关蛋白,发挥其促进细胞增殖,抑制IL-1β诱导的软骨终板细胞凋亡的作用,提示HSYA具有改善椎间盘退变的潜能。
(致谢:本研究主要在上海市同济医院检验科实验室及中心实验室完成,感谢课题组成员在本研究过程中提供帮助与指导。)
