乙型肝炎病毒X蛋白对B7-H6基因的激活作用
2018-10-10邹勇杨小安郑常龙潘兴飞徐启桓
邹勇 杨小安 郑常龙 潘兴飞 徐启桓
B7-H6又称NCR3GL1,属于B7家族,是近年来利用生物信息学、质谱技术等发现的新型共刺激分子。2009年,Brandt等[1-2]率先证实,B7家族成员B7-H6为人类自然杀伤(NK)细胞天然细胞毒受体NKP30的配体,可以选择性表达在一些肿瘤细胞表面。最近的研究进一步表明,B7-H6不仅仅在肿瘤细胞上表达,在某些炎症环境中也可以被诱导表达[3]。HBV相关慢加急性肝衰竭(HBV-ACLF)患者肝组织中B7-H6的表达显著上调,并且与疾病严重程度显著正相关,表明NKP30/B7H6相互作用在HBV-ACLF NK细胞介导的肝细胞损伤中可能发挥着重要作用[4]。本研究构建了B7-H6基因启动子荧光素酶报告基因载体,通过不同剂量的pCMVHBx表达质粒转染HepG2细胞来验证HBx蛋白可以促进B7-H6蛋白的表达,为进一步研究B7-H6表达的分子调控机制奠定了基础。
1 材料与方法
1.1 仪器和试剂 VeritasTM微孔板发光检测仪(Turner Biosystems);Stbl3感受态细胞、HepG2细胞(本室保存);PrimeSTAR高保真 DNA聚合酶(TaKaRa);DNA限制性内切酶(Thermo Scientific);ClonExpressⅡ One Step Cloning Kit连接酶(诺唯赞);PrimeSTAR Max Premix(2X)(Takara);柱离心式胶回收试剂盒、DNA抽提纯化试剂盒、质粒抽提试剂盒(中美泰和);Lipofactamine 2000(Invitrogen);聚合酶链反应(PCR)引物(中美泰和);pGL3-Basic、pRLTK双荧光素酶报告基因质粒及检测试剂(Promega)。
1.2 引物设计与合成 根据http://genome.ucsc.edu中B7-H6 mRNA所对应DNA上游长度约3 Kb区域(B7-H6启动子区)的碱基序列,设计产物为2.2 Kb大小片段的上下游引物,并加入酶切位点。引物合成由中美泰和完成。上游引物:5′-ATTTC TCTATCGATAGGTAC CTGTCTTTGAGTGAATGTCCC-3′,下 游 引 物:5′-CAGTACCGGAATGCCAAGCTTG AGACCTCTGTTGCGTAAAG-3′,下划线部分引入酶切位点(KpnI和HindⅢ)。
1.3 启动子区扩增 以人基因组DNA为模板,选用PrimeSTAR高保真DNA聚合酶,利用PCR技术扩增B7-H6启动子区。反应条件如下:94℃预变性5 min,94℃变性30 s、60℃退火30 s、72℃延伸70 s共28个循环,72℃终末延伸3 min。扩增产物经琼脂糖凝胶电泳检测片段大小符合后,用PCR产物纯化试剂盒回收纯化。
1.4 荧光素酶报告基因重组质粒的构建 分别以KpnI和HindⅢ双酶切PCR产物及pGL3-Basic、利用ClonExpressⅡOne Step Cloning Kit使目的片段与载体相连接。连接产物转化感受态细胞Stbl310,涂LB平板过夜。挑取单克隆菌株培养,抽提质粒,并以之为模板进行PCR及琼脂糖凝胶电泳鉴定,并将重组质粒进行测序。
1.5 细胞转染 HepG2细胞接种于24孔板,利用Lipofactamine 2000分别将启动子质粒pGL3-B7-H6、空载体质粒pGL3-Basic、HBV病毒蛋白真核表达质粒(pCMV-HBs、pCMV-HBc和 pCMV-HBx),本课题组已构建及验证,详见参考文献[5],共转染HepG2细胞,所有细胞均以pRL-TK作为内参。转染48 h后裂解细胞进行双荧光素酶活性测定。每组设3个复孔,实验重复3次。
1.6 荧光素酶活性测定 参照Promega公司双荧光素酶报告基因检测系统(Dual-Luciferase©Reporter Assay System)说明书中推荐用量及流程检测各组细胞中荧光素酶活性。以萤火虫荧光素酶(Fluc)活性与海肾荧光素酶(Rluc)活性比值作为最终荧光素酶活性。
1.7 Western blot 不同剂量的pCMV-HBx表达质粒(1-4 μg)转染HepG2细胞,48 h后收获细胞,并裂解,收集上清,然后通过SDS-PAGE电泳分离等量的蛋白质提取物(30 μg)转移至PVDF膜中。用含5%脱脂牛奶的TBST缓冲液封闭非特异性结合位点。加入B7-H6兔多克隆抗体(批号:ab138588,Abcam,美国)或Flag-tag兔多克隆抗体标签抗体(批号:SAB4301135,Sigma,美国),4℃孵育过夜。TBST缓冲液洗膜5×5 min,HRP标记的二抗 (1∶5 000)室温孵育1 h,TBST缓冲液洗膜5×5 min。利用增强化学发光法(ECL)检测B7-H6蛋白的表达。1.8 统计学方法 利用SPSS 16.0软件分析数据。数据均采用均数±标准差(¯x±s)表示,两组间均数的比较用Student-t检验,p<0.05差异具有统计学意义。
2 结果
2.1 人B7-H6启动子区PCR扩增 人B7-H6启动子的扩增片段在约2.2 Kb条带处出现明显的条带,与目的片段大小相符。
2.2 pGL3-B7-H6启动子重组质粒鉴定 重组pGL3-B7-H6启动子质粒用 KpnⅠ+NcoⅠ酶切鉴定,切出2 170 bp和4 737 bp的条带,测序结果显示克隆出的B7-H6基因启动子片段序列与GenBank中记录一致。
2.3 pGL3-B7-H6启动子转录活性分析 如图1所示,pGL3-B7-H6重组质粒与内参质粒pRL-TK共转染HepG2细胞,荧光素酶活性较转染空载体pGL3-Basic组明显增加(5.24±1.25 vs.1.12±0.31,P=0.005)。pGL3-B7-H6重组质粒与 HBV病毒蛋白真核表达质粒(pCMV-HBs、pCMV-HBc和pCMV-HBx)分别共转染HepG2细胞,转染pCMVHBx质粒组的萤光素酶活性与转染空载体pCMV-tag组相比显著升高(17.60±3.36 vs.6.73±1.36,P=0.001),而转染pCMV-HBs或pCMV-HBc质粒组与转染空载体pCMV-tag组相比未见明显升高(8.37±2.20 vs.6.73±1.36,P=0.452;9.97±2.79 vs.6.73±1.36,P=0.157),表明HBX蛋白可显著增强B7-H6基因启动子转录活性。
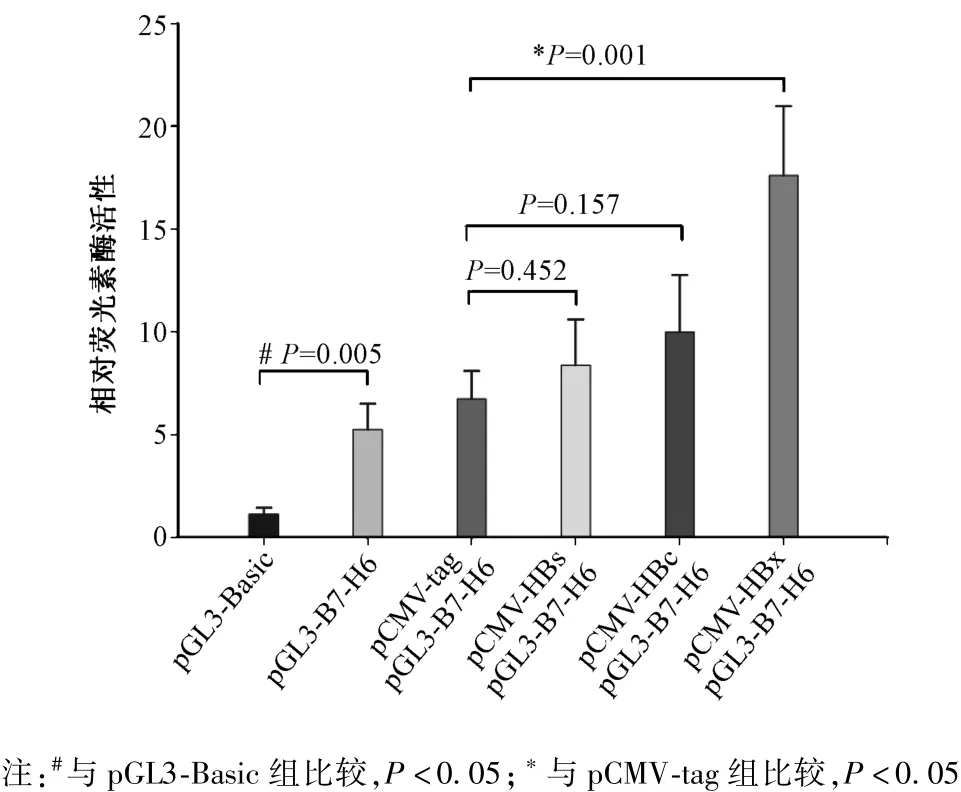
图1 HBV病毒蛋白对B7-H6基因的转录激活作用Note:#compared with pGL3-Basic group,P <0.05;∗compared with pCMV-tag group,p<0.05Fig.1 Hepatitis B Virus X proteins promote transcription of B7-H6
2.4 pCMV-HBx表达质粒转染 HepG2细胞后B7-H6蛋白的表达 不同剂量的pCMV-HBx表达质粒(1~4 μg)转染 HepG2 细胞,Western blot检测B7-H6蛋白和标签蛋白Flag-tag的表达水平。如图2所示,相对于转染空载体组(pCMV-tag),转染pCMV-HBx 表达质粒组(1 μg,2 μg 和 4 μg)B7-H6蛋白表达量均显著增加(P均<0.05),而且随着pCMV-HBx质粒转染量的增加,HepG2细胞中B7-H6蛋白的表达量亦显著增加(P均<0.05)。
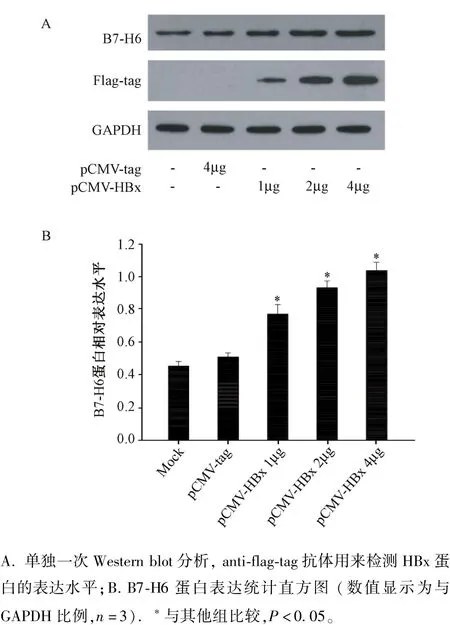
图2 pCMV-HBx表达质粒转染HepG2细胞后B7-H6蛋白的表达A.Representative Western blot analysis of B7-H6 expression;B.The bar graph shows the ratios of B7-H6 protein expression relative to GAPDH(n=3).compared with other groups,p<0.05)Fig.2 Expression of B7-H6 protein post transfection with pCMV-HBx plasmid
3 讨论
前期本课题组利用小鼠暴发性肝衰竭模型对肝衰竭免疫介导的肝细胞损伤机制进行了深入研究,发现在病毒诱导的小鼠暴发性肝衰竭中,肝脏NK细胞可以通过NK细胞活化性受体-配体识别途径NKG2D/NKG2DL和死亡受体途径Fas/FasL杀伤病毒感染的肝细胞,随后又发现,NK细胞在人类HBV相关慢加急性肝衰竭(HBV-ACLF)患者肝脏大量募集和显著活化,外周血NK细胞天然细胞毒受体(NKP30和NKP46)的表达也显著增强[5]。最近已发表的结果显示,NK细胞天然毒受体NKP30特异性配体B7-H6在HBV-ACLF患者肝组织中高表达,且B7-H6表达水平与疾病的严重程度密切相关。NK细胞可通过NKP30/B7H6识别通路上调IL-32表达而诱导肝细胞的凋亡[4]。为进一步深入研究HBV-ACLF高炎症状态下B7-H6应激表达的分子调控机制,本研究构建了人B7-H6启动子荧光素酶报告基因质粒,利用HBV病毒蛋白(HBs、HBc和HBx)真核表达质粒分别与人B7-H6启动子荧光素酶报告基因质粒共转染,发现HBx蛋白可增强B7-H6基因启动子的转录活性,进一步通过Western blot证实,HBx可显著增强B7-H6蛋白的表达,表明HBx蛋白对B7-H6基因具有显著的激活效应,在HBV相关慢加急性肝衰竭NK细胞介导的肝细胞损伤中可能发挥重要作用。
HBx蛋白是一种广谱的转录激活因子,在多种细胞因子参与下能激活多种病毒或细胞的基因转录调控区,从而参与细胞的凋亡过程,影响细胞分裂周期,DNA损伤修复,以及肿瘤发生与侵袭转移等多种病理生理过程[6-9]。而且有研究显示HBx蛋白可通过激活某些宿主细胞基因的表达而诱导肝细胞损伤,HBx蛋白可以通过转录因子Egr-2和Egr-3激活HBV感染的肝细胞癌中FasL基因的表达,从而促进肝细胞的凋亡[10]。 Yoo等[11]证实 HBV 病毒蛋白(HBc和HBx)可通过转录因子c-Ets-2激活人纤维介素基因(fgl2),导致局部微循环障碍,肝细胞坏死。Han等[12]也证实 HBx蛋白可通过转录因子sp1激活人TRAIL基因,增强TRAIL诱导的肝细胞凋亡。推测HBx蛋白也可能通过特定转录因子激活B7-H6基因进而激活NKP30/B7-H6信号通路而促进HBV相关慢加急性肝衰竭NK细胞介导的肝细胞损伤,其精确的转录调控机制有待进一步深入研究。
总之,本研究证实了HBx蛋白可能增强了B7-H6基因启动子的转录活性并促进了B7-H6蛋白的表达,为揭示HBV相关慢加急性肝衰竭肝细胞损伤的机制提供了新的分子靶点和理论依据。
利益冲突 无
