低钾性周期性麻痹临床特点分析
2018-10-08秦文玉刘翔孔质彬唐银发
秦文玉,刘翔,孔质彬,唐银发
中国人民解放军第一八一医院急诊科,广西桂林 541002
低钾性周期性麻痹 (hypokalemicperiodic paralysis,HypoPP)是与钾离子代谢有关的肌肉疾病,临床表现以反复发作肢体弛缓性瘫痪伴血清钾离子水平降低为主。HypoPP分为原发性HypoPP和继发性HypoPP,原发性HypoPP是由于骨骼肌 Na+、Ca2+离子通道基因突变导致的常染色体显性遗传病,发病率约为1/1000 00[1]。已明确编码骨骼肌 L型 α1钙通道亚基(Cav1.1)的CACNA1S基因及编码电压门控钠通道α亚单位的SCN4A基因与 HypoPP相关[1-2]。HypoPP好发于男性约占62%,欧洲国家以家族性多见,中国、韩国等亚洲各国以散发性为主[3]。继发性HypoPP最常见病因为甲状腺功能亢进症,此外还可见于醛固酮增多症、肾小管酸中毒等疾病。HypoPP主要表现为四肢对称性迟缓性瘫痪、肌张力减低、腱反射减弱或消失、感觉正常或异常,伴低钾血症及心电图改变,此外,继发性HypoPP可伴原发病临床表现。HypoPP如果未得到及时治疗,严重者可发生恶性心律失常、呼吸肌麻痹而危及生命,治疗过程中若补钾不当,易发生反跳性高钾血症。继发性HypoPP除了积极处理低钾血症缓解症状和病程,应尽可能根治原发病防止反复发作。该研究收集2010年1月—2016年12月收治的65例住院治疗的HypoPP病例资料,对其临床特征进行分析与探讨,提高对HypoPP的认识和诊治水平,现报道如下。
1 资料与方法
1.1 一般资料
收集住院的低钾性周期性麻痹患者病例资料65例(该研究经伦理委员会批准,文章所采用病例均经患者或其家属同意,未取得联系或同意病例已剔除)。
1.2 研究方法
收集HypoPP病例临床资料,包括性别、年龄、发作诱因、发作次数、临床表现、周期性麻痹家族史、发作时血钾水平、肌酸激酶(CK)水平、甲状腺功能(T3、T4和 TSH)、心电图表现以及治疗情况,分析其临床特点。
1.3 统计方法
所有数据用SPSS 9.0统计学软件进行统计分析,计量资料以均数±标准差(±s)表示,计数资料以[n(%)]表示,计量资料用t检验,计数资料采用 χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
HypoPP 65例,男女约12:1,其中原发组37例:有家族史2例,散发35例;继发组28例:继发于甲状腺功能亢进者21例[含妊娠(孕30周)1例]、原发性醛固酮6例、甲状腺功能减低者1例,两组性别比较差异无统计学意义(χ2=2.58,P>0.05);原发组平均年龄(32.4 ±9.7)岁,继发组 (39.2 ±11.8)岁,原发组发病年龄较继发组轻,差异无统计学意义(t=0.84,P>0.05),均好发于青壮年,原发组发病年龄高峰20~30岁,继发组30~40 岁(见图 1)。
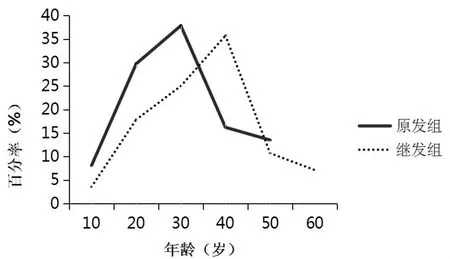
图1 原发组和继发组年龄分布情况
2.2 临床表现
原发组HypoPP和继发组HypoPP临床表现均有发作性不同程度肢体弛缓性瘫痪,继发组心悸、多汗、消瘦、头晕、头痛等原发病典型症状者占1/3,大部分为轻微症状。原发组有家族史者占5.4%,76.9%为首次发作,23.1%为反复发作,两组比较差异无统计学意义(χ2=3.98,P>0.05)。 全部病例均有不同程度发作性肢体瘫痪,近端重于运端、下肢重于上肢,无恶性心律失常及呼吸肌麻痹。原发组中发作前有明确诱发因素者占90.19%,继发组占79.57%,上呼吸道感染和饱餐或摄入甜食是原发组中最常见诱因,继发组中上呼吸道感染和剧烈运动为最常见(表1)。
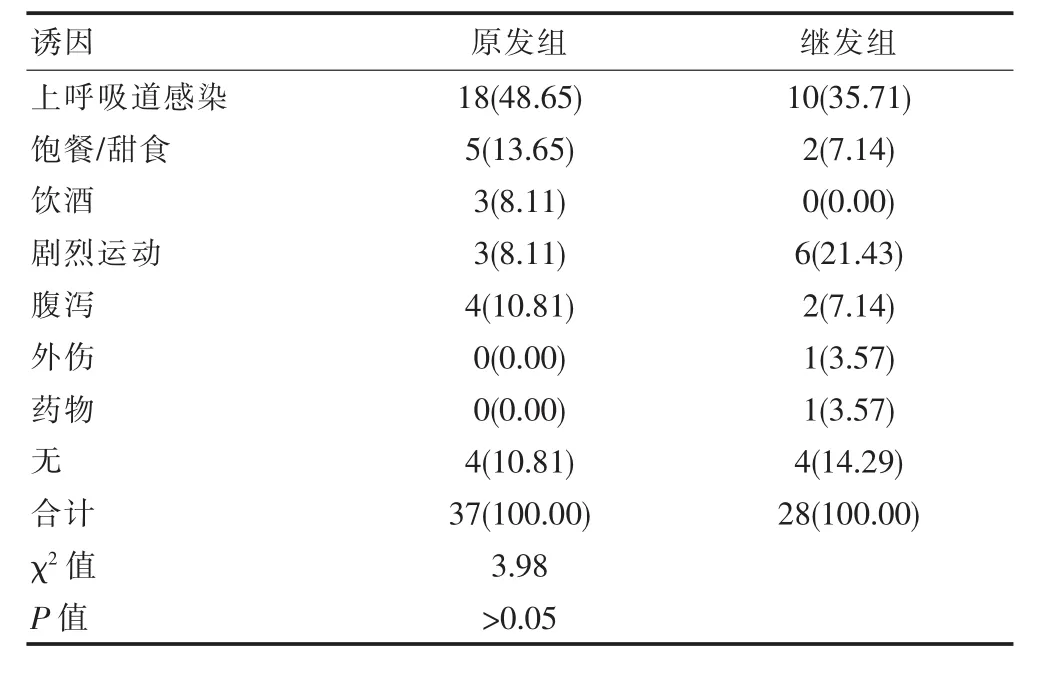
表1 两组患者发病诱因比较[n(%)]
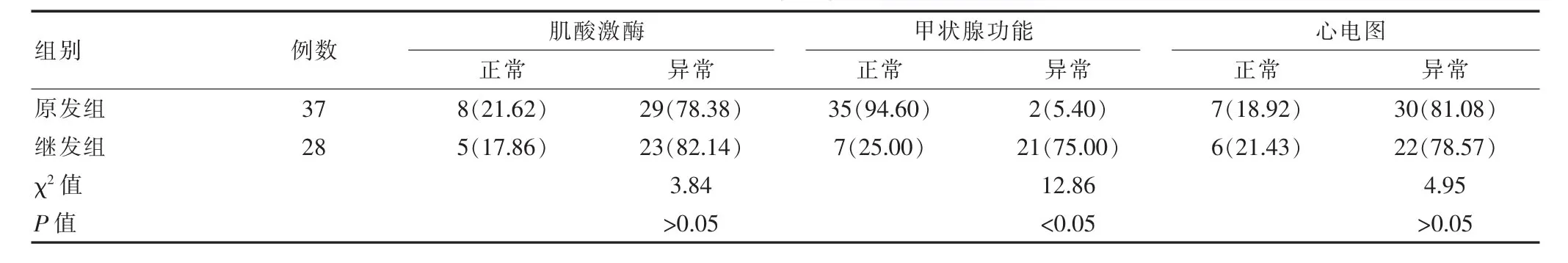
表2 两组实验室辅助检查比较[n(%)]
2.3 辅助检查
原发组发作时血钾浓度为 (2.29±0.46)mmol/L,继发组为(2.35±0.57)mmol/L,原发组血钾水平低于继发组(t=7.84,P<0.05);原发组中CK升高者占78.38%,继发组占 82.14%,两组比较差异无统计学意义 (χ2=3.84,P>0.05),发作时血钾水平与肌体瘫痪程度、CK升高水平相关分析显示差异无统计学意义 (r=0.231,P>0.05)。
甲状腺功能检查:原发组有2例T3、T4升高和TSH降低,继发组中甲状腺异常占75.00%(χ2=12.86,P<0.05),绝大多数为 T3、T4升高和 TSH降低,1例为T3、T4降低和 TSH升高。
心电图检查:原发组和继发组共55例提示低钾改变,常见表现有ST段下降、U波、P-R间期延长、窦性心动过速、偶发室性早搏、偶发房性早搏(表2)。
2.4 治疗方法与效果
补钾治疗方法:入院后血钾<3.0 mmol/L或心电图有低钾表现者,在心电监护下予静脉及口服氯化钾治疗,血钾≥3.0 mmol/L时采用口服补钾;伴低血镁者予同时补充硫酸镁,补钾治疗同时积极治疗原发病,直到复查血钾正常及肌力恢复正常。
3 讨论
该研究通过比较原发HypoPP与继发性HypoPP临床特点,发现HypoPP好发年龄均为青壮年,其中原发组发病年龄高峰为20~30岁,继发组为30~40岁,男女比为12:1。有家族史者占5.4%,大部分为散发,与以往研究报道一致[4]。有报道对5代HypoPP的10例患者家系进行研究,显示在10例临床特点典型的男性患者中均检测到位于 CACNA1S上的 C2819T(His916 Gln)突变位点,5例临床特点不显著女性检测为该突变的携带者,推测该突变位点与性别的不完全外显有关[5],这可能是男性比女性好发的原因之一。该研究中原发组HypoPP和继发组HypoPP临床表现均有发作性肢体弛缓性瘫痪为主,此外继发组有原发疾病相关症状,76.9%病例为首次发作,23.1%反复多次发作。大部分HypoPP病例发作前有明显诱因,其中上呼吸道感染、饱餐或甜食、剧烈运动为最常见诱因。HypoPP发作时原发组和继发组血钾水平均明显低于正常,继发组血钾水平低于原发组,发作时血钾水平与肌体瘫痪程度相关分析显示差异无统计学意义(P>0.05)。继发组大部分甲状腺功能提示 T3、T4和TSH水平异常。甲亢性HypoPP以低血钾、TSH水平受抑制、T3、T4含量增加为主要特征,多见于中国及日本等亚洲国家,发生率约为1.9%~8.8%,其次是拉丁美洲血统人[6]。文献报道甲亢性HypoPP发作时血钾水平与T3或T4无显著相关性,甲状腺毒症严重程度与HypoPP严重程度不成正相关[7]。甲亢性HypoPP存在明显种族差异,可能与人类白细胞相容性抗原类型多态性相关,甲亢性HypoPP患者的DRw8(日本人群常见)、Bw64 (中国人群常见)、Aw19、B17等抗原比其他国家人群显著增高[5-6]。妊娠患者发生HypoPP不常见,若妊娠期间未得到有效治疗,易影响胎儿发育甚至引发流产,对母婴均有严重危害[8]。在该研究中甲亢合并妊娠1例,在严密监测下予静脉和口服补钾治疗,同时丙基硫氧嘧啶积极治疗甲亢,病情得以缓解并保证了胎儿的安全。据文献HypoPP患者临床和实验室检查资料回顾性分析显示HypoPP发作期CK升高程度与血钾水平改变程度呈负相关,提示血清肌酶可作为判断病情程度的重要指标[9]。该研究中两组CK升高水平差异无统计学意义(P>0.05),发作时血钾水平与CK升高程度相关分析显示差异无统计学意义(P>0.05),这与文献报道[9]有差异,可能是样本量较少导致。HypoPP随年龄增长发作次数渐少,继发性HypoPP尽可能根治病因以预防反复发作。研究报道甲亢性HypoPP在补钾时易出现反跳性高钾血症[10],因此,在补钾过程中应密切监测血钾水平,防止恶性心律失常及呼吸机麻痹。HypoPP可能是甲状腺功能亢进症首发症状和就诊原因,多数患者因症状不典型而导致误诊和漏诊,建议HypoPP患者常规行心电图和甲状腺功能检查防止漏诊。
目前关于HypoPP的研究主要集中在基因和发病机制上,对于最佳治疗方案和疾病相关因素管理策略的研究相对欠缺,尚有诸多问题有待更深入的研究去探索。对HypoPP患者应做好健康宣教,避免高碳水化合物饮食、饮酒、暴饮暴食、剧烈运动、过度劳累、呼吸道感染等诱发因素。详细询问病史,应用胰岛素、β受体激动剂及糖皮质激素等药物时把握好适应证,以免诱发HypoPP。
