miR-320a靶向Rab11a调控非小细胞肺癌细胞增殖的研究
2018-09-27石少敏赵建军于杜鹃宋玉明
石少敏,赵建军,于杜鹃,宋玉明
(吉林大学中日联谊医院 呼吸内科,吉林 长春130033)
非小细胞肺癌(NSCLC)是临床常见恶性肿瘤,其发病率和死亡率均居我国所有恶性肿瘤首位[1]。尽管以吉非替尼、恩度等为代表的新型靶向药物在NSCLC治疗中取得令人鼓舞的成效,但NSCLC患者的远期生存率仍不尽如人意[2]。因此,进一步探索NSCLC的发病机制,提高NSCLC的临床疗效是临床亟待解决的问题。微小RNA(miRNA)是一类内源性非编码小分子RNA,可通过靶向调控肿瘤发生发展过程中多个关键基因,参与细胞增殖及凋亡等病理生理过程,是肿瘤的潜在治疗靶点[3]。miR-320a是新发现的miRNA成员,定位于人体染色体8p21.3上[4]。研究表明miR-320a在NSCLC的发生发展中起到类似抑癌基因的作用,但其分子机制尚未完全明确[5]。Rab11a属于Rab小分子GTP酶家族的成员,是内吞再循环过程中的关键因子。既往研究证实,Rab11a表达变化可明显影响肿瘤细胞增殖与凋亡,提示调控Rab11a表达可能是NSCLC靶向治疗的新思路[6]。课题组前期利用miRNA靶基因预测软件证实,miR-320a与Rab11a存在结合位点,提示二者可能具有靶向关系。但miR-320a是否可通过靶向Rab11a调控NSCLC细胞增殖尚未可知。本研究旨在探讨miR-320a靶向Rab11a对NSCLC细胞增殖的影响,以期为临床诊疗提供依据。
1 材料与方法
1.1材料人非小细胞肺癌细胞系A549购于美国模式培养物集存库(ATCC);RPMI1640培养基、PBS、胰蛋白酶、胎牛血清购于Gibco公司;MTT试剂盒购于博士德生物有限公司;Rab11a单克隆抗体购于美国Abcam公司;双荧光素酶试剂盒购于美国Promega公司;Annexin V-FIFC细胞凋亡检测试剂盒购于凯基生物;Neg-miR、si-Rab11a、pre-miR-320a、anti-miR-320a购于Ambion公司。
1.2细胞分组常规复苏A549细胞,将细胞重悬浮于含有1%双抗+10%胎牛血清的RPMI1640培养液中,37℃、5% CO2恒温培养。收集对数生长期的A549细胞并接种于6孔培养板中,调整细胞浓度为5×105个/孔,细胞随机分为4组,即Neg-miR组、si-Rab11a组、pre-miR-320a组、anti-miR-320a组,各组分别转染Neg-miR、si-Rab11a、pre-miR-320a、anti-miR-320a,之后细胞继续培养24 h,转染结束后进行后续实验。
1.3双荧光素酶报告基因实验运用生物学信息软件预测miR-320a的靶基因为Rab11a(http:/ /www.targetscan.org/)。以人非小细胞肺癌细胞基因组DNA为模板,构建野生型Rab11a 3’-UTR(Rab11a-wt)质粒、突变型Rab11a 3’-UTR(Rab11a-Mut)。收集对数生长期的A549细胞,调节细胞密度至2×105cells/well,将Rab11a-wt、Rab11a-Mut与Neg-miR或pre-miR-320a共转染至A549,将细胞37℃、5% CO2恒温培养48 h;测定细胞荧光素酶活性,海肾质粒荧光值作为内参。
1.4Rab11a蛋白表达检测收集各组细胞,提取细胞蛋白,测定样品蛋白浓度,取适量样品行SDS-PAGE凝胶电泳,转至硝酸纤维膜,将膜置于5%封闭液4℃封闭4 h,后依次加入Rab11a单克隆抗体(1∶2 000)、二抗(1∶500)孵育,按ECL试剂盒说明书行电化学发光检测。
1.5细胞增殖活性检测收集各组细胞,将细胞置于37℃、5% CO2恒温培养,分别于培养24 h、36 h及72 h时,离心弃上清每孔加入MTT溶液(5 mg/ml)20 μl,继续37℃、5% CO2恒温培养4 h,离心弃上清,加入DMSO(100 μl/每孔),振荡至结晶物充分溶解,采用全自动酶标仪测450 nm处吸光值(OD值)。
1.6统计学方法采用SPSS20.0对数据进行统计学分析,计量资料用均值±标准差(Mean±SD)表示,组间比较用单因素方差检验,P<0.05为差异具有统计学意义。
2 结果
2.1验证miR-320a对Rab11a的靶向作用
生物信息学工具网站http://www.microRNA.org检测结果显示,miR-320a与Rab11a 3’UTR之间存在结合位点(见图1A)。双荧光素酶报告基因检测结果显示,pre-miR320a与Rab11a-WT共转染后细胞荧光活性显著低于Neg-miR与Rab11a-WT共转染(P<0.05);pre-miR-320a或Neg-miR与Rab11a-MUT共转染后细胞荧光活性比较无统计学差异(P>0.05)(见图1B)。
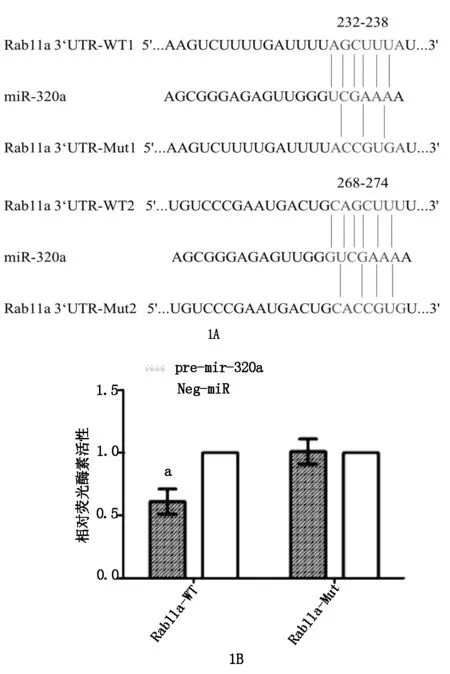
(1A为miRNA靶基因预测软件检测结果;1B为双荧光酶素检测试验结果)
注:aP<0.05,与Neg-miR组比较
图1双荧光素酶报告基因实验验证miR-320a对Rab11a的靶向作用
2.2Westernblot检测Rab11a蛋白表达
Western blot结果显示,转染pre-miR-320a和si-Rab11a后Rab11a蛋白表达显著降低(P<0.05),转染anti-miR-320a后Rab11a蛋白表达显著增高(P<0.05)(见图2)。
2.3MTT法检测细胞增殖
MTT结果显示,转染pre-miR-320a和si-Rab11a后细胞增殖活性显著降低(P<0.05),转染anti-miR-320a后细胞增殖活性显著增高(P<0.05)(见图3)。

注:aP<0.05,与Neg-miR组比较;bP<0.05,与si-Rab11a组比较;cP<0.05,与anti-miR-320a组比较
图2各组Rab11a蛋白表达比较

图3 各组细胞增殖活性比较
3 讨论
miR-320a已被证实参与多种恶性肿瘤的发生与发展[8]。Yang等[9]研究发现,浸润性乳腺癌组织中miR-320a表达与肿瘤大小、临床分期、淋巴结转移及远处转移有关(P<0.05),且miR-320a表达越低者总体生存时间越短。李沛等[10]研究显示,利用慢病毒转染技术上调结肠癌细胞中miR-320a表达水平,可显著抑制细胞中β-catenin、Vimentin、N-cadherin、MMP-2及MMP-9蛋白表达,同时抑制细胞增殖活性、侵袭能力及转移能力。Zhang等[11]研究表明,NSCLC组织中miR-320a表达显著低于癌旁正常组织(P<0.05)。上述研究提示,miR-320a在包括NSCLC在内的多种恶性肿瘤细胞中均发挥类似抑癌基因的功能,但其作用机制尚未完全明确。
受体介导的胞吞作用是动物细胞从胞外摄取大分子物质的重要方式[12]。Rab11a作为胞吞再循环的关键因子,参与物质胞内运输、循环过程。研究发现,Rab11a参与恶性肿瘤的发生发展,其机制可能与Rab11a调控肿瘤细胞胞内运输有关[13]。Dong等[14]研究证实,Rab11a在NSCLC组织中高表达,且其高表达与TNM分期、淋巴转移及预后不良有关(P<0.05);过表达Rab11a可显著促进NSCLC细胞增殖、迁移和侵袭,同时抑制细胞凋亡。上述研究提示,Rab11a可能是NSCLC基因治疗中的一个重要靶点。本研究结果显示,转染pre-miR-320a可显著下调A549细胞中Rab11a表达,而转染anti-miR-320a则可显著上调A549细胞中Rab11a表达,提示miR-320a与Rab11a之间存在某种负向调控机制。进一步利用基因软件预测和双荧光素酶报告基因实验证实,miR-320a可通过作用于Rab11a 3’UTR,实现对Rab11a的靶向作用。本研究还观察到,转染pre-miR-320a后,且随着Rab11a表达的降低,A549细胞增殖活性显著降低,提示过表达miR-320a可通过靶向抑制Rab11a调控NSCLC细胞增殖,反之亦然。故推测,miR-320a靶向调控其下游靶基因Rab11a是其介导NSCLC细胞增殖的主要分子机制。
综上所述,miR-320a可通过靶向Rab11a调控NSCLC细胞增殖。但miR-320a是否还通过靶向其他多个下游靶基因参与NSCLC的发生与发展?尚未可知,仍有待进一步深入研究。
