抗CD133单链抗体/白喉毒素DAB389融合蛋白的基因构建、表达、纯化及鉴定
2018-09-27程金章杨景朴王海涛陈俊俊王宗贵牙韩盛
程金章,杨景朴,仲 炜,王海涛,赵 胤,陈俊俊,王宗贵*,牙韩盛
(1.吉林大学第二医院,吉林 长春130041;2.吉林大学中日联谊医院;3.岳阳县人民医院)
近年来肿瘤干细胞理论的提出给肿瘤治疗带来了曙光,该理论认为:肿瘤组织中极少数的肿瘤干细胞是肿瘤发生、 耐受和转移的根源[1,2]。 CD133被普遍认为是肿瘤干细胞表面特异性表达蛋白,可以作为多种肿瘤干细胞的标志物[3-6]。目前在喉癌中CD133被认为是人喉癌Hep-2细胞系中肿瘤干细胞的标志物[7]。我们前期研究也证实CD133+喉癌肿瘤干细胞具有化疗抵抗性[8]。因此以肿瘤干细胞为靶点的治疗为肿瘤患者带来了希望。
免疫重组毒素是利用基因工程技术将天然毒素的受体结合区基因替换成可与肿瘤细胞表面分子特异结合的抗体或细胞因子基因,制备出具有特异性靶向作用的毒素分子,是肿瘤导向治疗研究中的热点之一,白喉毒素(DT)由535个氨基酸残基组成的相对分子质量为58000 的多肽,由受体结合区、跨膜区和酶活性区3 个在空间上相互独立的结构域组成[9],适于进行各种基因工程操作。本研究采用基因工程技术将CD133(scFV)与白喉毒素片段(DAB389)进行融合,通过诱导、表达、纯化,获得了靶向杀伤CD133阳性肿瘤干细胞的免疫毒素DAB389-Linker-CD133(scFV),为靶向杀伤肿瘤干细胞药物的开发奠定了基础。
1 材料与方法
1.1菌株、质粒及主要试剂
T-CD133(scFV) VH 、T-CD133(scFV) VL-linker、表达载体pET28 a(+), BL21(DE3),CHO(CD133+)工程细胞和CHO-S细胞由吉林大学第二医院中心实验室保存。pUC57-DAB389由南京金斯瑞生物科技有限公司全基因合成; NcoI (8 U/μl)、BamHI (8 U/μl)、 MunI (8 U/μl),XhoI(8 U/μl)、T4 DNA Ligase (350 U/μl)、克隆载体pMD18T购自TaKaRa公司;质粒提取试剂盒和胶回收试剂盒购自Biomega公司。
1.2引物
DNA序列见表1。

表1 引物DNA序列
1.3目的基因构建与鉴定
按照T-CD133(scFV) VH 、T-CD133(scFV) VL-linker基因序列分别设计2条特异性引物序列(P1、P2)(见表1)分别对T-CD133(scFV) VH 、T-CD133(scFV) VL-linker进行PCR扩增,酶切后以T-CD133 VH 、T-CD133(scFV) VL-linker为模板,以P1下、P2上为引物扩增CD133(scFV) ,CD133(scFV)片段经凝胶纯化后进行TA克隆得到质粒 pMD18T-CD133(scFV)。 用引物P3(见表1)对pMD18T-CD133(scFV)进行扩增。pUC57-DAB389和pET28a(+)通过NcoI/BamHI双酶切构建pET28 a(+)-DAB389。
1.4重组表达质粒的构建与鉴定
将CD133(scFV)片段定向连接至中间载体pET28-DAB389上,构建pET28-DAB389- CD133(scFV)重组质粒。将重组质粒转化于感受态BL21(DE3)中,构建重组菌株,提取质粒,酶切鉴定,核苷酸测序。
1.5重组蛋白的诱导表达及分析
将含有pET28-DAB389-Linker-CD133(scFV)重组质粒的菌株1∶1 000接种于4 ml浓度为50 μg/ml 卡那霉素的液体培养基中,37℃ 培养过夜。次日将上述菌液1∶100转接于20 ml含有卡那霉素的液体培养基中,37℃培养至OD600=1,加入IPTG至终浓度为1 mmol/L诱导表达,37 ℃振荡培养4小时。离心收集菌体。分别取诱导前后的上清和沉淀进行SDS-PAGE电泳分析。
1.6重组蛋白的纯化及鉴定
将重组蛋白超声裂解后,根据Ni 柱的使用说明纯化,采用透析法对蛋白进行复性,同时对表达产物进行Western blot 鉴定,纯品蛋白经SDS-PAGE 电泳后,用电转移方法将电泳胶上的蛋白转印至硝酸纤维素膜上,进行Western blot 印迹分析。一抗为mouse-anti-His(1∶5 000)。二抗为FITC-羊抗小鼠IgG(1∶2 000)。
1.7流式细胞术检测DAB389-linker-CD133(scFV)的靶向性
首先用CD133单克隆抗体检测CHO(CD133+)工程细胞和CHO-S细胞的CD133表达率。然后用CHO(CD133+)工程细胞和CHO-S细胞检测DAB389-linker-CD133(scFV)的靶向性。阴性对照组分别为单独CHO(CD133+)细胞和CHO-S细胞,细胞加二抗对照组,细胞加一抗、二抗对照组。一抗为mouse-anti-His(1∶5 000)。二抗为FITC-羊抗小鼠IgG(1∶2 000)。收集细胞,每管5×105个,用PBS洗涤;加入免疫毒素DAB389-linker-CD133(scFV),用PBS稀释至终浓度范围为10 μg/ml、20 μg/ml、40 μg/ml,测定CD133表达率。
2 结果
2.1DAB389-Linker-CD133(scFV)原核表达载体的构建与鉴定
重组质粒pET28-DAB389-Linker-CD133(scFV)通过NcoI/ BamHI双酶切后通过琼脂糖凝胶电泳进行酶切鉴定,酶切片段大小为1 891 bp,与预期相符,说明重组质粒构建成功,核苷酸序列分析正确,与理论值一致。
2.2目的基因的诱导表达及SDS-PAGE电泳分析
通过对菌种 BL21(DE3)/pET28-DAB389-Linker-CD133(scFV)进行小量诱导后, SDS-PAGE电泳检测表明,构建的重组菌株能高效地表达重组蛋白,相对分子量大小约66 KDa。而空菌对照组和未诱导组均未见相应表达带,表明该重组菌表达了DAB389-Linker-CD133(scFV)融合蛋白。见图2。
2.3DAB389-Linker-CD133(scFV)蛋白纯化及westernblot鉴定
通过对粗蛋白DAB389-Linker-CD133(scFV) 进行Ni柱的纯化制备,得到精蛋白, SDS-PAGE凝胶电泳显示蛋白分子量大小约为66 kDa, AlphaImager 1220 v5.5软件分析纯度为95%。通过Ni-NTA亲和纯化、透析复性、超滤浓缩的蛋白终产品 DAB389-Linker-CD133(scFV) 进行SDS-PAGE和Western blot实验,证明所表达制备的蛋白与设计的一致。见图3。

1 空菌;2 诱导后上清;3诱导前沉淀;4 诱导后沉淀检验 注:1.SDS-PAGE电泳;A Western blot
图1DAB389-Linker-CD133(scFV)表达图2SDS-PAGE电泳结果图3载体的酶切鉴定纯化重组蛋白复性后SDS-PAGE电泳及Westernblot检验
2.4流式细胞术检测DAB389-linker-CD133(scFV)的靶向性
用CD133单克隆抗体检测CHO(CD133+)工程细胞和CHO-S细胞的CD133表达率,CHO工程细胞CD133表达率为86.78%,CHO-S细胞的CD133表达率为13.94%。DAB389-Linker-CD133(scFV)浓度为20 μg/ml时与CHO工程细胞和CHO-S细胞的结合率分别为41.3%,和7.87%。实验证实重组蛋白DAB389-Linker-CD133(scFV) 对CD133阳性细胞具有较强靶向性。见图4。
3 讨论
目前越来越多的证据表明肿瘤细胞具有异质性,存在着极少量的肿瘤干细胞,与肿瘤的增殖、复发、转移和对放化疗抵抗关系密切。传统治疗方法虽使肿瘤细胞总数量减少,肿瘤体积缩小或临床诊断消失,但残留下的肿瘤干细胞可以逃逸抗肿瘤药物,最终导致肿瘤复发和转移扩散。
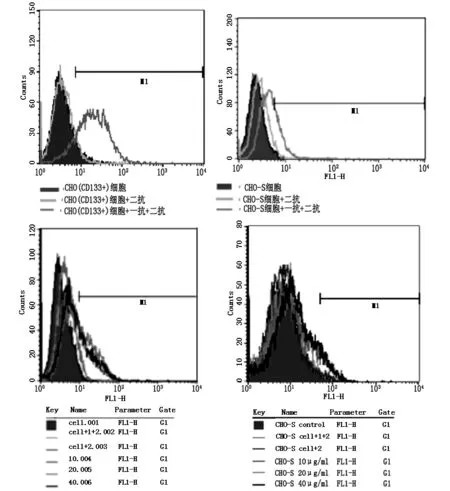
图4 流式细胞仪检测重组蛋白与CHO(CD133+)、CHO-S细胞结合活性
CD133是位于细胞膜表面具有5个跨膜区的糖蛋白,分子量为117 kD。CD133最初在造血干或祖细胞中发现,在内皮前体细胞和神经前体细胞中经常有表达,而在成熟的血细胞、内皮细胞以及神经细胞则没有表达。CD133表达的重要特征是随着细胞的分化而迅速下降,这也使CD133成为分离干细胞和肿瘤干细胞的特异性分子标记[10]。CD133在脑肿瘤、肝癌、前列腺癌、结肠癌、喉癌等多种实体瘤干细胞研究中发挥了重要作用[3-8,11]。因此本研究瞄准肿瘤干细胞,以CD133为靶点,利用scFV 将抗体重链可变区和轻链可变区通过柔性软肽连接,具有良好的靶向性,降低了免疫原性。构建具有靶向CD133的优良递送药物载体,与免疫毒素融合构成具有多重功能的融合蛋白,以达到与肿瘤干细胞特异性结合杀伤的目的[12]。研究中最常应用的免疫毒素有白喉毒素、假单胞杆菌外毒素、蓖麻毒素等[13,14]。 DAB389作为白喉毒素的酶活性区,它通过阻止延长因子-2 在核糖体内促进多肽链延长而抑制蛋白质合成造成细胞死亡,具有极强的细胞毒性,是靶向毒素常用的毒素分子。
本研究用基因工程原理和方法,将CD133/(scFV)和DAB389通过Linker进行连接,成功构建了免疫毒素DAB389-Linker-CD133(scFV) 的重组表达质粒。重组表达质粒经诱导表达后,蛋白电泳证实有与预期分子量大小相符的蛋白产生,经鉴定为目的蛋白,经过亲和层析获得纯化的免疫毒素DAB389-Linker-CD133(scFV),透析复性后获得具有活性的DAB389-Linker-CD133(scFV)。通过对CHO(CD133+)和CHO-S细胞的靶向性实验,证实DAB389-Linker-CD133(scFV)对表达CD133抗原具有良好的靶向性。
DAB389-Linker-CD133(scFV)有望对CD133+肿瘤干细胞进行靶向杀伤,以提高放化疗的敏感性。为进一步研究开发针对肿瘤干细胞的靶向杀伤药物奠定了理论基础。
