红曲菌中桔霉素的控制策略及研究进展
2018-09-26李贞景薛意斌任志远王昌禄
李贞景,薛意斌,刘 妍,徐 晗,任志远,王昌禄*
桔霉素又叫桔青霉素,是一种真菌毒素,最早由Hetherington和Raaisttrick于1931年从桔青霉(Penicillium citrinum)培养物的过滤液中分离得到[1]。桔霉素呈柠檬黄色针状菱形结晶,分子式为C13H14O5,存在离子态和非离子态两种构型(图1)。桔霉素能与金属离子形成螯合物,但其性质不稳定,在酸性、碱性溶液及加热条件下都易发生分解[2]。
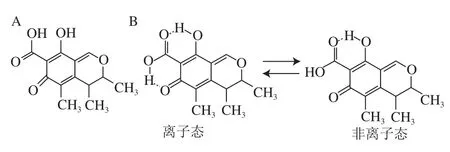
图1 桔霉素的结构式(A)及其两种构型(B)Fig. 1 Structural formula (A) and two configurations of citrinin (B)
桔霉素是红曲菌(Monascus spp.)的次级代谢产物。红曲菌在我国的使用历史悠久,但长期以来仅用于食品着色和酿酒,产业规模较小。在我国一般将由红曲菌发酵制成的相关产品总称为红曲。从20世纪90年代开始,随着国内市场对天然、健康食品需求的不断增加以及欧美等国对我国红曲产品的日益认可,我国的红曲产业进入了快速发展时期。但在1998年,欧洲学者从红曲中发现了对人体有潜在危害的桔霉素,欧美各国也相继制定了红曲产品中桔霉素的限量标准。在现有技术条件下,我国红曲菌液态发酵产品红曲红、红曲黄等红曲色素中的桔霉素问题基本得到了解决,但固态发酵红曲米中的桔霉素含量仍远高于欧美国家的限量标准,这既影响了我国红曲产品的出口,也对我国居民身体健康造成潜在危害。因此,有效控制红曲菌中桔霉素的含量是红曲产业发展中必须解决的问题之一。
1 桔霉素的毒性
红曲菌中的桔霉素之所以日益引起人们的关注,主要在于其具有较强的毒性。研究表明,桔霉素有肾脏毒性,50 μmol/L的桔霉素就能使PK15细胞的钙稳态失去平衡,导致细胞死亡[3]。桔霉素与赭曲霉毒素A联合使用可造成肝细胞活性氧水平升高、DNA链断裂和线粒体介导的细胞凋亡,且毒性具有协同增强作用[4]。桔霉素与展青霉素等其他真菌毒素共同使用,其毒性也表现出协同增强效果[5]。食品一旦受到桔霉素的污染,有其他真菌毒素共存的可能性极大;因此桔霉素毒性的这种协同作用应当引起研究人员的足够重视。桔霉素具有致畸性,Ciegler等[6]发现,给发育的鸡胚胎注射150 μg/egg的桔霉素后,胚胎的致畸率高达73%。Wu Yu等[7]也发现,桔霉素能够降低小鼠卵母细胞成熟和早期胚胎发育的能力,这可能是由于氧化应激诱导细胞凋亡引起的。
针对桔霉素的毒性机制虽然已有一些研究成果,如Chagas等[8]的研究表明,桔霉素能在肝细胞线粒体聚集并干扰电子传递系统,抑制细胞中蛋白质的合成,引起肝糖原含量下降,导致甘油三脂和胆固醇合成受阻;但整体来看仍缺乏有力的证据,因此,有关桔霉素毒性机制的研究仍需进一步加强[9]。
2 桔霉素限量标准与检测方法
因为桔霉素对人体有极大的危害性,许多国家和地区都已将桔霉素列为食品危险成分并制定了严格的限量标准(表1)。目前,我国仅对红曲红和红曲黄色素中的桔霉素做了限量规定(红曲红色素的限量标准为0.04 mg/kg,红曲黄色素的限量标准为1.0 mg/kg)[10-11],但对固态发酵的红曲米等红曲产品尚未作出限量规定。随着人们对食品尤其是红曲菌中桔霉素问题的日益重视,制定更加严格、规范的桔霉素限量标准已经成为趋势,今后技术水平落后、产品桔霉素含量高的红曲企业可能面临严峻的生存问题[12]。
目前,桔霉素的主要检测方法有抑菌圈法、免疫学分析法、薄层层析法、高效液相色谱法和高效液相色谱-质谱联用法[13-15]等。抑菌圈法精密度较差。薄层层析法相对简单易行,但灵敏度和精密度较低,近年来已很少被使用。潘振球[13]、Richard[16]等都采用高效液相色谱-质谱联用法对桔霉素进行检测,但成本较高。免疫学分析法主要是酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA),一般又分为直接竞争法和间接竞争法两种。间接法桔霉素ELISA检出限为0.4~0.8 μg/L,直接法为2~4 μg/L[17],但该法需专用的抗体,检测费用较高,难以广泛应用。高效液相色谱法是目前检测桔霉素含量最便捷、可靠的一种方法,它具有分离效率高、选择性好、灵敏度高、应用范围广等优点,被普遍应用于红曲产品中桔霉素含量的检测。我国在2016年制定的GB/T 5009.222—2016《食品安全国家标准 食品中桔青霉素的测定》[18]中规定,大米、玉米、辣椒、红曲类产品中桔霉素的测定应采用免疫亲和柱净化-高效液相色谱法,而大米、大麦、燕麦、小麦类产品可采用C18固相萃取小柱净化-高效液相色谱法。该标准是在GB/T 5009.222—2008《红曲类产品中桔青霉素的测定》[19]的基础上修订的,增加了样品的净化步骤,扩大了检测方法的适用范围,已于2017年6月23日正式实施。

表1 国外桔霉素相关限量标准Table 1 Citrinin limits in other countries
3 红曲菌中桔霉素的合成途径及调控基因
对于红曲菌中次级代谢产物的生物合成,目前得到广泛认可的是聚酮合酶途径,色素、桔霉素、莫纳可林K等皆为聚酮类化合物,由红曲菌聚酮体代谢产生[22]。1999年以来,大量学者对这一代谢途径进行了研究。综合目前研究成果,红曲菌中桔霉素的生物合成途径如图2所示。
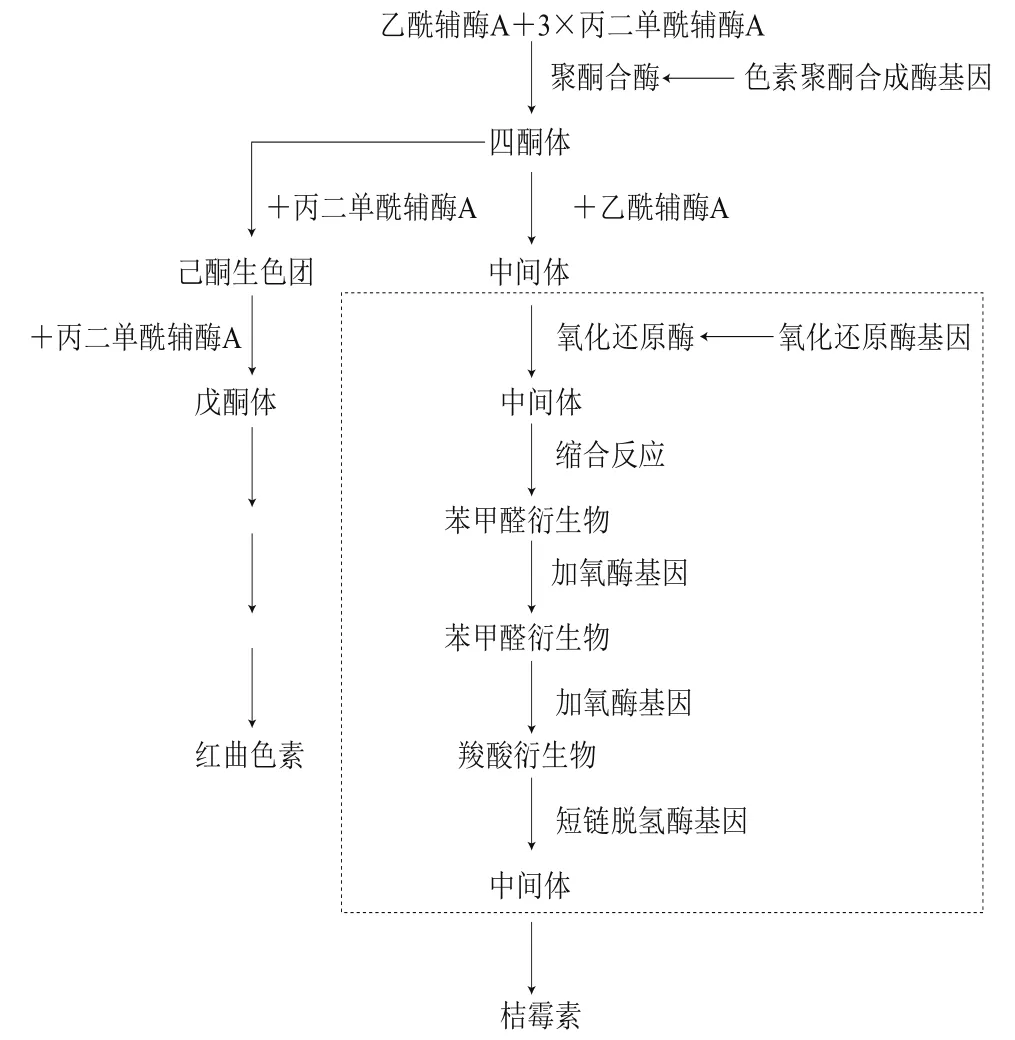
图2 红曲菌中桔霉素的生物合成途径[23-26]Fig. 2 Biosynthetic pathway of citrinin by Monascus spp.[23-26]
从图2可以看出,在聚酮合酶的催化下,一分子乙酰辅酶A与3 个丙二单酰辅酶A通过反复缩合和延伸形成桔霉素和色素的共同前体四酮体,此过程由pksCT编码的聚酮合酶(polyketide synthase,PKS)催化。然后分为两条途径:一条为四酮体与丙二单酰辅酶A缩合生成己酮生色团,并经过一系列反应生成红曲色素;另一条为四酮体与乙酰辅酶A经甲基化缩合、氧化、脱氢、脱水等步骤生成桔霉素,此过程可能是由氧化还原酶(ctnB)、短链脱氢酶(ctn-orf1)、加氧酶(ctn-orf3)等基因调控完成[24-25]。
随着研究的不断深入,调控桔霉素生物合成的相关基因不断被发现。除上述pksCT、ctnB、orf1、orf3外,还发现12 种桔霉素基因参与桔霉素代谢,分别为脂肪酰辅酶A合成酶(ctnI)、短链脱氢酶(ctnE、ctnH)、氧化还原酶(ctnD)、转录激活因子(ctnA)、变位酶(ctnF)、碳酸纤酶(ctnG)、膜转运蛋白(orf5)、WD重复蛋白(ctnR)基因和假设基因(orf6、orf7、orf8)(图3)。

图3 红曲菌中与桔霉素生物合成有关的基因[26]Fig. 3 Citrinin synthesis gene cluster from Monascus spp.[26]
4 控制红曲菌中桔霉素含量的策略
4.1 控制桔霉素的传统方法
菌种选育、培养基优化、改变外界环境因子以及发酵结束后去毒处理都是控制红曲菌中桔霉素含量的传统方法。这些方法一般和生产过程密切相关,简单易行、效果突出且成本较低,是目前控制红曲菌中桔霉素含量的主要策略。
4.1.1 低产或不产桔霉素菌株的选育
国内外学者在红曲菌菌种选育与改造方面进行了大量研究。方春玉等[27]通过紫外线照射及超声复合诱变获得红曲菌突变株,经固态发酵后其酯化能力提高了83.2%,且桔霉素含量极低。郎天丹等[28]利用混合粒子场辐照处理紫色红曲菌,获得高产莫纳可林K、低产桔霉素的M1-20和M2-4两株突变株,且表现出良好的遗传稳定性。陈勉华等[29]筛选得到了一株高产莫纳可林K和γ-氨基丁酸、低产桔霉素和色素的红曲菌C002。陈福生等[30]发现了一种不产桔霉素的丛毛红曲菌(Monascus pilosus)。选育低产或不产桔霉素的菌株虽然能从源头上降低红曲菌中的桔霉素含量,但由于桔霉素的合成与色素和莫纳可林K的合成都属于聚酮合酶途径,在桔霉素产量降低的同时往往也造成色素和莫纳可林K产量的下降。
4.1.2 优化培养基
虞慧玲等[31]研究了多种碳源、氮源对红曲色素及桔霉素产量的影响,结果表明玉米粉为最佳的碳源,大豆为最佳氮源,此时桔霉素含量较低,且色价色调良好。甘氨酸、酪氨酸、精氨酸、丝氨酸和组氨酸作为单一氮源均可促进红曲色素的产生,同时对桔霉素的合成起到抑制作用,且组氨酸的效果最好。进一步研究发现,在真菌中组氨酸可以通过组氨酸脱羧酶产生组胺,而组胺的分解代谢由二胺氧化酶催化,释放NH3和H2O2;因此,组氨酸作为唯一氮源时桔霉素减少可能是由于桔霉素被在组氨酸同化过程中产生的H2O2所降解[32]。岳建明等[33]发现,添加适量NH4NO3、(NH4)2SO4、NH4Cl有利于提高红曲黄色素的生物合成,同时抑制桔霉素的生成,可能是因为这3 种铵盐所提供的低pH值环境有利于对桔霉素产量的控制。赵靖等[34]的研究发现,己酸、辛酸等5 种脂肪酸均能明显抑制桔霉素的合成,且脂肪酸对桔霉素的影响不是通过调节pH值实现的。梁斐等[35]在红曲菌Winter4固态发酵中发现,添加环磷酸腺苷、生物素均可抑制桔霉素的合成。
4.1.3 改变环境因子
溶氧量、温度、光照、发酵时间等外界环境因子均能够对红曲菌中桔霉素的产量产生影响,通过对这些发酵工艺参数的优化和控制可达到降低桔霉素含量的目的。邢淑婕等[36]通过改变装液量,发现溶氧对红曲菌发酵产桔霉素与色素的影响较大,在满足溶氧需求的情况下,应尽可能采用低通风量以降低桔霉素的生成。马博雅等[37]发现,缺氧培养可以显著降低红曲菌中桔霉素的产量,且缺氧条件可能是通过抑制ctnA基因表达和促进orf7基因表达来抑制桔霉素的合成,而pksCT基因不是调控桔霉素合成的关键基因。虞慧玲等[31]提出,适度提高液态发酵的培养温度(36 ℃)有利于高产色素和低产桔霉素。还有研究表明,碱性条件可以促使细胞内的红曲色素排向胞外并显著抑制桔霉素的产生[38]。此外,由于桔霉素主要产生于发酵后期,而色素的合成早于桔霉素,因此,合理的控制发酵时间有利于得到色素的同时减少桔霉素的产量。光线的波长对红曲菌次级代谢产物的合成亦有影响,研究发现,红光能促进红曲色素的合成并抑制桔霉素的合成,而蓝光则促进γ-氨基丁酸的合成[39]。
4.1.4 发酵结束后去毒
在发酵产物中已经存在桔霉素或者桔霉素含量偏高的时候,可以通过一些物理化学手段进行去毒。李蕙蕙等[40]的实验表明,随着辐照强度的增大,红曲米与红曲米提取液中的桔霉素、莫纳可林K及其类似物含量均逐步减少,在红曲米的提取液中,当辐照剂量超过5 kGy时桔霉素全部降解,当辐照剂量超过10 kGy时提取液中的莫纳可林K及其类似物完全降解。张晓伟等[41]发现,桔霉素能够吸收可见光,主要是短波长可见光及紫外光的能量,从而对桔霉素结构造成破坏,且蓝光、紫外光还可以使桔霉素溶液中产生一些氧化自由基,而这些氧化自由基可以与桔霉素发生反应,破坏桔霉素的分子结构,从而达到降解桔霉素目的。Shi等[42]的研究发现,经体积分数45%乙醇溶液、1.5%磷酸溶液提取70 min可去除91.6%的桔霉素,且能保留79.5%的莫纳可林K。上述方法虽然能够在一定程度上达到降低桔霉素含量的效果,但往往也会对红曲菌中的色素及莫纳可林K等成分造成一定的破坏,且有时会引进一些新的化学物质,因此,在实际生产应用中可行性不高。
4.2 生物方法控制桔霉素
应用生物方法控制微生物中的有害代谢产物,具有绿色环保、安全高效等优势,近年来被逐渐重视。生物方法控制红曲菌中的桔霉素含量主要有3 种:1)控制产毒途径,从源头抑制桔霉素的合成,此种方法虽然行之有效,但由于基因改造菌株的安全性有待评估,因此并未得到广泛应用;2)混菌发酵,利用微生物拮抗作用控制桔霉素产量,但由于混合发酵的限制条件较多,要选取生长条件与红曲菌相近的真菌,因此还需要深入研究;3)微生物脱毒,对已经存在的毒素进行脱毒,是其他方法无法替代的,并且具有可实践性,是近年来研究的热点。
4.2.1 控制产毒途径
控制产毒途径,即从分子水平上控制桔霉素的合成。首先利用基因组学和蛋白组学等方法确定桔霉素的合成途径和相关基因,再对这些基因进行改造,或者研究能够阻断桔霉素合成的特定添加物进而控制桔霉素的代谢。虽然桔霉素合成受多种基因、基因簇的调节和控制,且目前尚未研究透彻,但多位学者在桔霉素合成途径和相关基因已有成果的基础上,对红曲菌中桔霉素的合成基因进行了改造[43-49]。
Shimizu等[43]克隆了紫色红曲菌pksCT基因的侧翼区域,所得的桔霉素合成基因簇包括pksCT基因和5 个开放阅读框(orf1、orf2、orf3、orf4和orf5),敲除ctnA基因后,桔霉素产量显著下降,且该基因簇中的大部分基因在mRNA水平上的相对表达量也明显减少。He Yi等[44]报道敲除orf1和orf2基因后,红曲菌桔霉素产量显著降低。关于ctnE、ctnG、ctnH和orf7基因在桔霉素代谢途径中的作用亦有报道[45-48]。这些研究虽然在不同程度上降低了桔霉素的含量,但红曲菌有益代谢产物产量也随之减少。
阮琼芳[49]通过Blast比对分析,进一步预测酰基辅酶A合成酶(Acyl-CoA synthetase,ACS)和芳香醇脱氢酶(glucose-methanol-choline oxidoreductase,GMC)基因可能与桔霉素的生物合成有关,据此构建了ASC缺失菌株ACS-6和GMC缺失菌株GMC-8,并推测ACS基因参与桔霉素和色素共同前体物质的合成,GMC基因参与桔霉素和色素的PKS后修饰过程。通过特定添加物干扰桔霉素合成途径的研究也有报道。例如,添加不同浓度环磷酸腺苷可以激活一种蛋白激酶引起的桔霉素合成有关基因的变化,进而控制调节红曲色素和桔霉素的合成[50]。这些研究为提高红曲色素产量的同时降低桔霉素含量提供了新的研究思路,如果能明确桔霉素的生物合成途径中桔霉素合成支路的调控基因和相关酶系,则可通过敲除关键基因或添加关键酶的抑制剂,抑制桔霉素的合成,使四酮体流向色素合成途径。
4.2.2 混菌发酵
微生物混合发酵在生产实践上已有应用,它可以达到许多情况下单菌发酵所不能达到的生产效果,这主要是由于多菌发酵是一个生物混合体系,体系中的微生物之间大多具有生长代谢的协调作用[51]。在桔霉素控制方面,郝常明等[52]提出,采用生长条件与红曲菌相近,但能利用桔霉素或能生成抑制桔霉素中间产物形成的真菌一同培养,可降低桔霉素的含量。张建玲[53]的研究发现,与红曲菌纯培养相比,红曲菌与酵母或乳酸菌混合培养不但有利于促进红曲色素生成,还能抑制桔霉素的产生。混菌发酵虽然在很多领域都有成功实践的案例,但混菌体系的相关机制研究还不够深入,混菌体系的协调控制也具有较大的难度,缺乏有效的理论指导,仍需要深入研究。
4.2.3 微生物脱毒
微生物脱毒主要是通过自身代谢产物或相关酶对已经产生的毒素进行降解脱毒。微生物脱毒在某些毒素的脱除上已经有了很多报道[54-55]。在桔霉素的微生物脱毒研究中,Iwahashi等[56]发现酿酒酵母(Saccharomyces cerevisiae)可以通过谷胱甘肽的运输对桔霉素进行脱毒。Azizi等[57]在小麦粉中加入酿酒酵母,48 h后样品中桔霉素含量有所降低。整体上看,桔霉素微生物脱毒方面的研究相对较少,其具体机制、脱毒后产物的安全性以及参与脱毒过程的代谢产物或酶种类还不明确,仍需要进一步研究。
5 结 语
目前,虽然我国已经制定了红曲红和红曲黄色素的桔霉素限量标准,但随着人们对红曲产品安全性的日益关注以及新版桔霉素含量测定标准的实施[18],制定更多、更严格的桔霉素限量标准将成为趋势,而这将使我国的红曲企业尤其是红曲菌固态发酵企业面临新的挑战。因此,加强对红曲菌尤其是固态发酵红曲米中桔霉素含量有效控制方法的研究,生产低桔霉素含量甚至不含桔霉素的红曲产品显得尤为重要。
目前,研究人员主要从菌种选育、培养基优化、改变外界环境因子和控制产毒途径等方面降低红曲菌及其产品中的桔霉素含量,但在实际生产中许多方法操作复杂或成本较高,因而难以推广。今后对红曲菌中桔霉素的有效控制应该综合运用基因组学、蛋白组学等分子生物学手段,一方面准确找到控制桔霉素合成或降解的相关基因及途径,通过阻断合成或促进降解来达到降低桔霉素产量的效果;另一方面应探究环境因子对红曲菌中桔霉素的调控规律,通过特定的培养环境定向调节桔霉素的产量。另外,从政策层面来说,国家“十二五”规划中已有支持红曲菌中桔霉素的研究课题(如江南大学和广东天益生物科技有限公司已完成的高色价、低桔霉素红曲红色素生产的产业化项目),“十三五”期间,国家在政策和资金上应进一步加大支持力度,继续推动高校和企业加强低桔霉素含量红曲产品的技术研发,突破红曲产品出口的技术贸易壁垒,为我国红曲产品走向国际市场提供支持。
