腺苷酸活化蛋白激酶活性及其级联效应对肉品品质的影响研究进展
2018-09-26王柏辉赵丽华
王 宇,袁 倩,王柏辉,杨 蕾,赵丽华,靳 烨*
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一个异源三聚体,普遍存在于真核细胞生物中,由一个催化亚基α和两个调节亚基β和γ构成[1]。α亚基含有催化结构域(kinase domain,KD)和自动抑制结构域(auto-inhibitory domain,AID),且有两种异构体,α1在机体中分布广泛,定位于细胞质,而α2主要存在于骨骼肌、心脏和肝脏中,定位于细胞核[2];β亚基有两种亚型,β1在肝脏中表达,而β2在骨骼肌中表达;γ亚基上有和腺苷一磷酸(adenosine monophosphate,AMP)、腺苷三磷酸(adenosine triphosphate,ATP)结合的位点,其有3 种亚型,γ1和γ2在机体中分布广泛,而γ3只在骨骼肌中表达[3]。细胞中的分解代谢和合成代谢共同决定细胞的能量状态,AMP是细胞能量状态的关键检测器,而AMPK是细胞中AMP的主要分子传感器。因此,AMPK的活性主要由AMP与ATP的比值调控,机体在应激状态下消耗ATP导致AMP与ATP比值增大,从而激活AMPK,磷酸化的AMPK(phosphorylated AMPK,P-AMPK)激活AMPK的级联效应,参与调控机体的能量代谢,上调产能分解代谢,关闭耗能代谢途径[4]。AMPK通过调控下游靶蛋白和控制诱导基因转录修饰的转录因子和共激活剂的活性,调节细胞的能量代谢[5],进而反映细胞能量水平以及特定细胞外营养物质的变化,如葡萄糖、脂肪酸、瘦素(Leptin)、脂联素(adiponectin,AdipoQ)和生长素,从而有助于控制机体的能量平衡和食物摄入量[6]。因此,深入研究AMPK的生物学特性对提高畜禽肉品品质有重要的意义。
1 AMPK活力的调节
如同其他激酶,AMPK同样通过磷酸化其活化环上的Thr172位点使其活化。AMPK无活性时,AID结合到KD上,抑制AMPKα Thr172的磷酸化;而当游离的AMP结合到AMPKγ上时,导致AID从KD上解离,解除了AID对AMPKα Thr172位点磷酸化的抑制作用,且降低了磷酸化酶(protein phosphatase 2C,PP2C)对AMPKα Thr172位点去磷酸化作用,使Thr172仍处于磷酸化状态,间接激活AMPK[7]。目前发现3 种主要的AMPK上游激酶(AMP-activated protein kinase kinase,AMPKK),均通过磷酸化AMPKα Thr172位点使其活化[2]。据报道,5-氨基-4-甲酰胺咪唑核糖苷酸(5-amino-4-imidazolecarboxamide riboside,AICAR)、AdipoQ、Leptin等物质均可调控AMPK活力。
1.1 上游激酶对AMPK活力的调节
抑癌肝激酶B1(liver kinase B1,LKB1)又名STK11,是AMPK主要的上游激酶。当机体遭受饥饿、缺血、缺氧、药物等应激时,LKB1会优先激活AMPK保护机体。LKB1具有活性的必要条件是与两个附属蛋白——STE20相关衔接蛋白(STE20 related adaptor protein,STRAD)和小鼠蛋白25(mouse protein 25,MO25)形成复合物[8]。STRAD是LKB1的特异性接头蛋白和底物,MO25的主要作用是连接到STRAD羧基端维持STRAD和LKB1复合物的稳定性[7]。AMP结合AMPK使其成为LKB1复合物的优质底物,不仅增强了LKB1对AMPK的磷酸化程度,而且降低了PP2C对AMPK的去磷酸化程度,从而激活AMPK[9]。Lin Ruiting等[10]的研究表明,6-磷酸葡萄糖酸脱氢酶使细胞内5-磷酸核酮糖达到生理水平后抑制了LKB1-AMPK信号通路,进而促进脂肪酸的合成。
钙/钙调素依赖性蛋白激酶(calcium-calmodulin dependent protein kinase kinase,CaMKK)也可调控AMPK的活性。当机体细胞浆中游离钙的浓度升高时,CaMKK将高灵敏地感受到Ca2+浓度变化而被激活[11]。在不改变AMP与ATP比值的情况下,相比于CaMKKα,CaMKKβ磷酸化AMPK的Thr172位点以激活AMPK的速度更快[12]。研究表明雷公藤甲素通过激活CaMKK-AMPK信号通路诱导癌细胞的自噬,如果敲除CaMKK基因或用特异性抑制剂sto-609抑制CaMKK的活性后,会导致癌细胞中AMPK Thr172位点的磷酸化水平降低,进而抑制雷公藤甲素诱导癌细胞的自噬[13]。
转化生长因子β活化蛋白激酶1(transforming growth factor-β activated kinase,TAK1)是丝裂原活化蛋白激酶的成员,在AMPK活性调节中起重要作用[14]。Wang Bing等[15]的研究表明,一种新型组蛋白去乙酰化酶抑制剂Belinostat能提高胰腺癌细胞中活性氧(reactive oxygen species,ROS)的产生,但ROS只有在TAK1活性的介导下才可激活AMPK下游的信号级联反应,TAK1的活性被抑制会明显抑制ROS对AMPK的激活作用。
1.2 AMP途径调节
5’-AMP可变构激活AMPK(高达10 倍),ATP和AMP具有相似的结构,两者可竞争性结合AMPK的变构位点[16]。细胞中AMP主要来源于腺苷酸激酶反应:2腺苷二磷酸(adenosine diphosphate,ADP)↔ATP+AMP。当机体处于静息状态下,ATP与ADP的比值维持在较高水平,反应逆向进行,所以低含量的AMP无法激活AMPK;但当机体遭受应激消耗ATP时,反应正向进行,导致AMP大幅度增加,从而特异性激活AMPK[1]。AMP通过3 种方式激活AMPK:AMP变构激活AMPKK;AMP结合到AMPK上,使其成为蛋白磷酸酶较差的底物,同时成为AMPKK的优质底物;AMP变构激活AMPK[17]。另外据报道,ADP可提高AMPK Thr172位点的磷酸化程度,但前提是AMPK的β亚基N末端豆蔻酰化[18]。
AICAR是AMPK常用的激活剂。AICAR能激活对AMP敏感的酶,如AMPK、糖原磷酸化酶和果糖-1,6-二磷酸酶,所以AICAR不是AMPK的特异性激活剂[19]。机体摄入AICAR后,经细胞腺苷激酶磷酸化为单磷酸核苷(D-ribofuranosyl-5-monophate,ZMP),ZMP与AMP具有高度的相似性,也可以结合AMPK的变构位点激活AMPK,且两者的作用具有加和性[20]。
1.3 AMP非依赖途径调节
AdipoQ是脂肪组织分泌的一种细胞因子,主要通过与两种受体AdipoQR1和AdipoQR2结合发挥其生物作用,AdipoQR1在组织中表达广泛,而AdipoQR2主要存在于肝细胞中[21]。研究表明,AdipoQ结合AdipoQR1后会磷酸化LKB1使其活化,活化的LKB1通过磷酸化AMPKα的Thr172位点激活AMPK[22]。Awazawa等[23]的研究表明AdipoQ通过结合AdipoQR1激活AMPK,从而抑制固醇调节元件结合蛋白(sterol regulatory element-binding proteins,SREBP)1c的表达,减少脂肪酸合成。
Leptin是脂肪细胞因子家族中的一员,主要由脂肪细胞分泌,它的循环水平和机体的脂肪量成正比[24]。Leptin与跨膜受体lepR结合使LKB1活化,活化的LKB1则从胞核转移到胞质中,磷酸化AMPK的Thr172位点激活AMPK[25]。García-Carrizo等[24]的研究表明,Leptin对AMPK仅在短时间内具有激活作用,随后的6~12 h期间AMPK的磷酸化水平显著下降。有研究表明,Leptin通过磷酸化下丘脑中AMPKα的Ser491位点抑制AMPKα2的活性,通过磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)-肿瘤抑制蛋白结节性硬化复合物(tuberous-sclerosis complex,TSC)-哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路激活70S核糖体S6蛋白激酶(p70 ribosomal protein S6 kinases,p70S6K),而p70S6K通过磷酸化AMPKα的Ser491位点抑制AMPKα2的活性,导致体质量下降和食欲降低[26],AMPK也可抑制p70S6K的活性进而抑制蛋白质的合成。
8Br-AMP和复合物C(Compound C)是AMPK常用的抑制剂,在不改变细胞AMP与ATP比值条件下,均可抑制AMPK的活性及其下游的级联反应,但具体的作用机制需进一步研究。
2 AMPK级联效应

图1 AMPK级联效应示意图Fig. 1 Schematic diagram of AMPK cascade
如图1所示,AMPK级联效应由AMPK及其下游的一系列靶点基因构成,一旦AMPK活化将磷酸化/去磷酸化其直属下游靶点,激活或抑制直属下游靶点的活性,直属下游靶点再联动地激活或抑制各自的下游靶点,进而激活AMPK的级联效应,参与调控机体的能量代谢,如糖代谢、脂代谢、蛋白代谢。AMPK主要通过激活或抑制PGC-1α和FOXO1基因,联动地调控GLUT4、G6Pase等下游靶点,参与调控机体糖代谢,进而影响肉品的pH值、色泽和持水性等指标;通过激活或抑制PGC-1α和SREBPs基因,联动地调控PPARs、ACC和FAS等下游靶点,参与调控机体脂代谢,进而影响肉品的风味、嫩度、多汁性、色泽和系水力等指标;通过抑制TSC基因级联地调控mTORC1和eEF2K下游靶点,参与调控机体蛋白代谢,进而影响肉品的色泽。
3 AMPK对肉品品质的影响
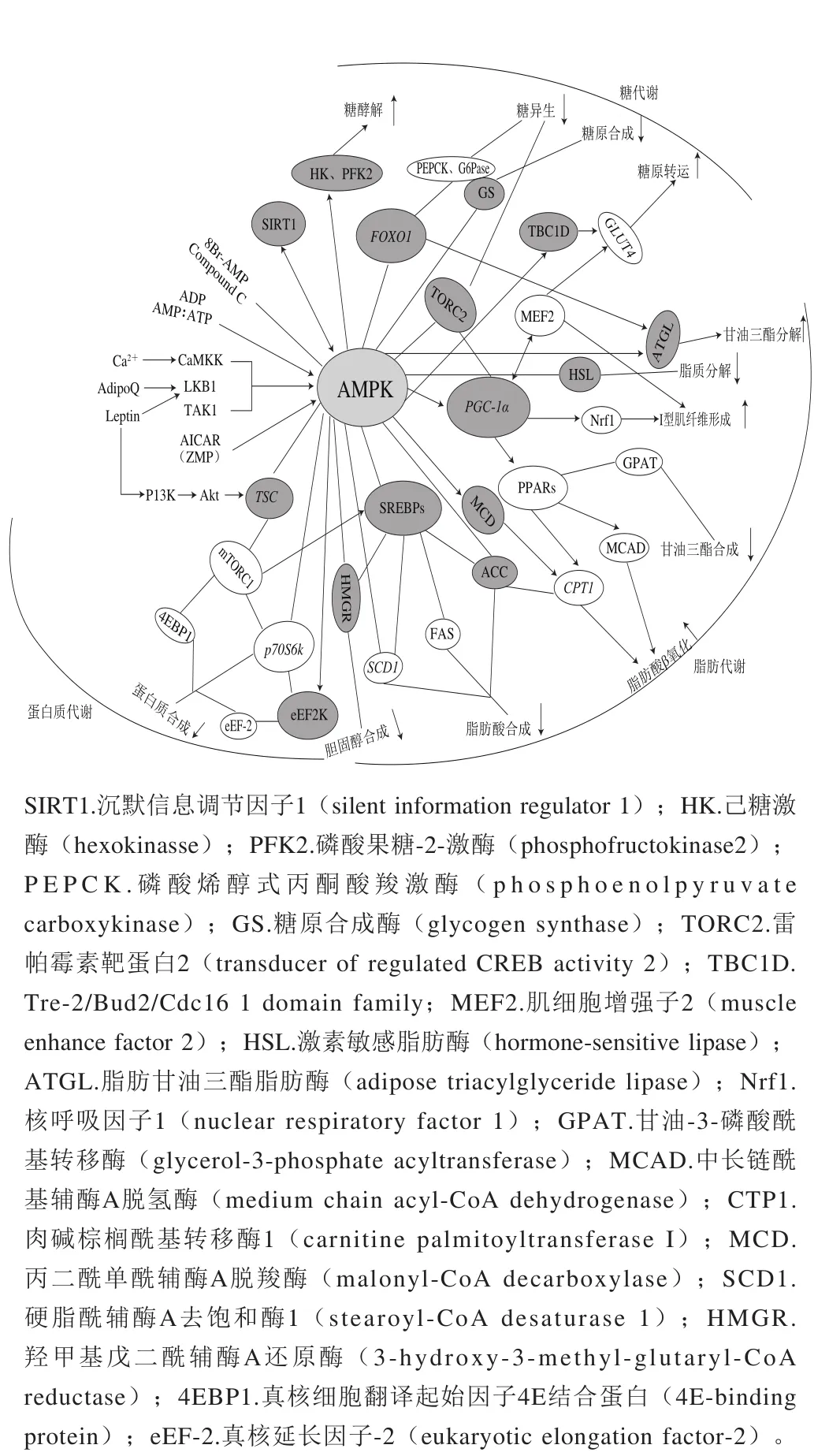
图2 AMPK是能量代谢的主要调控器Fig. 2 AMPK is a major regulator of energy metabolism
3.1 AMPK通过调节糖代谢影响肉品品质
静息状态下,机体中葡萄糖的产生与葡萄糖的摄取处于一定的动态平衡,但当外界因素(运动、饥饿、缺血、药物、细胞因子等)刺激机体时导致整个动态过程失衡并激活AMPK,P-AMPK主要通过以下3 种方式调节糖代谢:促进GLUT4转位、上调GLUT4基因的表达;加速糖酵解;减少糖原合成和糖异生。
P-AMPK不仅可以磷酸化Rab10的TBC1域家族成员TBC1D1的Ser231位点和TBC1D4的Ser704位点使它们被激活,进而调节GLUT4的囊泡与细胞膜的融合和停靠,增强GLUT4转位[27],还能减少心肌细胞内吞GLUT4,即增加细胞膜上GLUT4的含量,增加葡萄糖转运量[7]。P-AMPK通过磷酸化激活PGC-1α,而活化的PGC-1α再激活转录因子MEF2,促使MEF2向细胞核内转移并与GLUT4增强子结合,上调GLUT4基因表达,促进糖原转运[28]。P-AMPK通过直接磷酸化糖酵解关键酶(HK、PFK2等)或上调糖酵解酶的基因表达激活它们,进而加速机体糖酵解,促进ATP的合成[29]。Liang Junfang等[30]的研究表明,AMPKα2敲除的小鼠(而不是AMPKα1敲除的小鼠)降低了死后肌肉中AMPK的活性,且减少了宰后肉pH值的下降和乳酸的生成,所以AMPKα2催化亚基是宰后肌肉糖酵解主要的调节者。P-AMPK通过直接磷酸化GS的Ser7位点使其失活,减少糖原合成[18]。P-AMPK不仅可以直接磷酸化TORC2的Ser171位点使其失活,还可以直接磷酸化FOXO1使其失活,但不能进入核内与cAMP应答元件结合蛋白(cAMP-responseelement-binding protein,CREB)结合抑制糖异生[31],也不能激活糖异生限速酶(PEPCK和G6Pase),进而抑制糖异生[32]。研究表明PGC-1α可诱导糖异生,但由于TORC2被AMPK磷酸化而失活,中断了PGC-1α-TORC2信号通路,抑制了糖异生[28]。
畜禽屠宰前,耐力运动或摄入特殊营养物质(L-精氨酸)可激活AMPK,提高骨骼肌糖原含量,进而增强肌肉强度[33]。而畜禽屠宰后,肌肉及各细胞内的生物化学反应仍在继续进行,但由于失血导致体液平衡被破坏、供氧停止,机体很快进入无氧状态,ATP含量迅速降低,激活AMPK,加速糖酵解途径使乳酸蓄积,导致pH值快速降低,而糖酵解产生的热量减慢了胴体的冷却,故高温和低pH值易导致形成PSE(pale,soft,exudative)肉。宰后肉AMPK活力的高低会直接影响pH值下降的快慢,进而影响肉品的色泽、持水性等指标。研究表明长期处在饥饿压力下的西藏绵羊,宰后肉的AMPK活力和乳酸含量增加、糖原含量减少、pH值降低、熟肉率降低、滴水损失减少、剪切力增加[34]。宰前运输加速机体ATP消耗,放血后肌肉的低能量状态致使AMPK快速被激活,导致糖酵解迅速发生、乳酸积聚和PSE肉的形成率增加[35],而运输后休息期间的水淋浴喷雾可缓解宰前应激并恢复畜禽能量,缓解了宰后肉质的恶化。Hu等[36]的研究表明在急性热应激条件下,通过膳食中补充谷氨酰胺或葡萄糖均可提高鸡胸肉的pH值、a*值和b*值,降低滴水损失、L*值和AMPK的活性。
3.2 AMPK通过调节脂代谢影响肉品品质
ACC是脂肪酸合成的限速酶,有ACCα和ACCβ两种亚型,ACCα主要在脂肪酸合成的组织中表达,如肝脏和脂肪组织,ACCβ主要在脂肪酸氧化的组织中表达,如骨骼肌和心肌[1]。P-AMPK通过磷酸化ACCβ的Ser221位点使其失活,抑制了ACC将乙酰辅酶羧化为丙二酰单酰辅酶A(malonyl-CoA,MCA)的催化作用,降低了MCA对CTP1的抑制作用[7],从而使线粒体外膜上的跨膜蛋白CTP1可催化长链脂肪酸转运到线粒体基质中进行β氧化供能。P-AMPK也可激活MCD,导致MCA含量降低,加速脂肪酸氧化[37]。研究表明,P-AMPK先激活PPARα的辅助活因子PGC1,促进PPARα和PGC1结合进而上调PPARα的表达,活化的PPARα可上调下游靶点CPT1和MCAD等脂肪酸β氧化的限速酶活力,从而增加脂肪酸氧化供能[38]。
P-AMPK不仅可以磷酸化HMGR的Ser871位点使其失活,降低胆固醇合成,也可以抑制其下游靶点过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)和GPAT的活性,减少脂肪细胞中甘油三酯的积累[39]。SREBPs能调控机体脂肪酸和甘油三酯的合成,当机体胆固醇含量低时,SREBP裂解激活蛋白会与SREBP1c结合将其送入高尔基体内进行修饰,暴露出活性部位,之后进入核内调节下游靶点ACC、SCD1和FAS等酶的活力,促进脂肪酸生成[40]。研究表明,mTORC1也可激活SREBP1c,导致其发生核转移并参与调节靶基因的后续转录,促进脂肪酸生成[41]。而P-AMPK通过直接磷酸化SREBP1c,降低其转录活性、与DNA结合的能力及进入核内的数量,从而减少脂肪酸合成[42]。研究表明SCD1基因的突变或缺失可激活AMPK,增加脂肪酸氧化[43]。P-AMPK还可抑制SREBP2对其下游靶标HMGR的调控,降低胆固醇的含量[44]。
当脂肪分解速率高于脂肪酸利用率时,会导致脂肪再次从头合成,为防止ATP消耗,P-AMPK会磷酸化HSL的Ser565位点,进而阻止HSL的Ser563位点被环腺苷酸依赖cAMP的蛋白激酶磷酸化激活,最终降低脂肪的分解[45]。
SIRT1和AMPK均能调控脂类代谢。研究表明SIRT1可被酚类物质激活,活化的SIRT1会激活LKB1和AMPK引起ACC磷酸化失活,从而参与脂质代谢调控[46]。AMPK和SIRT1协同调控骨骼肌能量代谢相关基因的表达,P-AMPK间接地通过增加细胞内NAD+/NADH激活SIRT1,从而促进其下游靶基因(如PGC-1α、CTP1、丙酮酸脱氢酶激酶4基因(pyruvate dehydrogenase kinase isozyme 4,PDK4)、GLUT4)的表达,反过来SIRT1可对LKB1去乙酰化使其活化,活化的LKB1再磷酸化AMPK的Thr172位点激活AMPK[47]。Lin Jiandie等[48]的研究表明PGC-1α基因与肌纤维的转化密切相关,PGC-1α基因的过表达会提高骨骼肌中I型肌纤维的含量。AMPK经外界刺激激活使细胞中NAD+/NADH增加,激活SIRT1,活化的SIRT1可介导下游靶点PGC-1α发生去乙酰化被激活,P-AMPK也可直接磷酸化PGC-1α的Thr177和Ser538位点以激活PGC-1α[49],活化的PGC-1α通过调控其下游靶基因MEF2和Nrf1的活性,促进I型肌纤维形成[2]。MEF2也可直接与PGC-1α基因的启动子结合调控PGC-1α的表达,进而调控肌纤维类型的转化[2]。
Cantó等[50]的研究表明SIRT1和PGC-1α的脱乙酰对AMPK增加PGC-1α的活性是必要的,抑制SIRT1活性会降低AICAR对PGC-1α脱乙酰的诱导作用,AMPK调节线粒体和脂质代谢相关基因的表达时,很大程度上需要依靠SIRT1对PGC-1α活力的调控。据报道,monacolin K通过SIRT1-AMPK信号通路使FOXO1脱乙酰化/去磷酸化被激活,活化的FOXO1由细胞质定位转变为核定位,激活了脂质分解的限速酶ATGL,促进甘油三酯分解为甘油和游离脂肪酸[51]。研究表明,AMPK通过磷酸化ATGL的Ser406位点,增加了甘油三酯的分解[52]。monacolin K还可通过SIRT1-AMPK信号通路磷酸化SREBP1,抑制SREBP1进入细胞核发挥脂肪合成作用[51]。一些研究表明SIRT1与AMPK相互作用,共同调控脂质代谢,但两者信号间的转导关系仍需深入研究。
在畜禽饲养期间,通过外界刺激激活畜禽体内的AMPK,一方面导致酵解型肌纤维向氧化型肌纤维转变,使机体中氧化型肌纤维含量增加,肌纤维的类型决定肉的性能和品质,肌纤维类型组成不同,肉的嫩度、肌内脂肪(intramuscular fat,IMF)含量、肌肉色泽和风味等肉品指标也有差异。若酵解型肌纤维所占比例大,则宰后肉pH值下降迅速且系水力低,易形成PSE肉。反之,氧化型肌纤维所占比例大,则肌肉嫩度好、pH值下降缓慢、色泽红润、风味好、肌红蛋白和磷脂的含量也丰富。Huang等[53]的研究表明,氧化型肌纤维含量与背膘厚度和IMF含量呈正相关,而酵解型肌纤维含量与IMF含量呈负相关,与屠宰率呈正相关。另一方面,AMPK可抑制脂肪生成,影响畜禽的肌内脂肪沉积量,进而影响肉质嫩度和多汁性。Shen等[54]的研究表明小鼠膳食中补充α-硫辛酸可提高小鼠死后肌肉的极限pH值,减少胴体脂肪的沉积,并可防止PSE肉的形成。Yang Ye等[55]的研究表明,慢速型生长鸡16 周后肌内脂肪含量和脂肪基因表达明显高于8 周快速生长鸡,且16 周慢速生长鸡的AMPK表达显著低于8 周快速生长鸡,所以AMPK表达与鸡的IMF含量呈负相关。王亚娜等[56]的研究表明,宰后肉在成熟过程中脂肪氧化和降解产生的醛、醇、酮等风味物质会对肉的风味有一定影响。宰后肉经烹饪处理产生的挥发性支链脂肪酸和烷基酚类也会影响肉品的风味。
3.3 AMPK通过调节蛋白代谢影响肉品品质
mTOR是调控机体蛋白质合成的重要枢纽,mTOR发挥功能的必要条件是存在mTORC1或mTORC2。P-AMPK直接磷酸化TSC2的Ser1345位点,激活TSC1/TSC2复合物,抑制小G蛋白的活性,使mTOR失活[57]。4EBP1和p70S6K是mTORC1下游蛋白,4EBP1调控蛋白的翻译,而p70S6K调控蛋白的合成。mTORC1通过磷酸化4EBP1使真核细胞启动因子(eukaryotic initiation factor,eIF)4E从4EBP1-eIF4E复合物上解离下来,游离的eIF4E与eIF4G、eIF4B、eIF4A结合形成eIF4F起始复合物,再结合到5’ TOP mRNAs结构上启动机体蛋白质的翻译[58]。p70S6K基因被mTORC1磷酸化形成了具有活性的P-p70S6K,促进蛋白质的合成[59]。mTOR经P-AMPK作用失去活性,降低其对4EBP1和p70S6K的磷酸化作用,从而抑制机体蛋白质的合成。
eEF-2主要调控机体蛋白质的翻译、肽链的延伸和核糖体的移动等。P-AMPK通过磷酸化eEF2K的Ser398位点改变eEF2K的活性[60]。活化的eEF2K通过磷酸化eEF-2的Thr56位点使其失活,减少了eEF-2与核糖体间的相互作用,降低蛋白质的合成[61]。研究表明mTORC1-p70S6K信号通路通过磷酸化eEF2K的Ser366位点抑制了eEF2K的活性[62]。
AMPK活性的改变可能导致mTOR信号的改变,并会影响畜禽瘦肉的生长[63]。机体运动时AMPK被激活,抑制蛋白质的合成,但运动后的恢复期,AMPK对蛋白质的抑制减弱,机体会提高蛋白质的合成以补充运动中流失的蛋白质[47]。Dreyer等[64]的研究表明,运动期间P-AMPK降低了4EBP1的磷酸化,进而抑制蛋白质的合成,但运动后1~2 h Akt、mTOR、S6激酶、eEF2等的活化提高了蛋白质的合成;因此可通过增加畜禽的运动量提高AMPK活性,增加运动后期蛋白质的合成,如增加肌红蛋白的含量以提高肉的色泽、增加一些肌纤维蛋白的合成以增强肌肉的强度。Appuhamy等[65]的研究表明,P-AMPK对牛乳腺上皮细胞中mTOR介导的蛋白质合成具有负向调控作用,但与mTOR介导的乳蛋白合成相比,其对乳蛋白合成速率的影响甚微。
4 结 语
AMPK及其级联效应可调控机体的各种能量代谢,如促进糖酵解、葡萄糖吸收、脂肪酸氧化和I型肌纤维形成,并抑制糖原、脂肪酸、胆固醇、蛋白质等物质的合成。所以,调控AMPK的生物学效应将有利于肉品品质的改善。到目前为止,国内外主要是将AMPK作为许多慢性代谢疾病的治疗靶点,如糖尿病、肥胖、癌症和肿瘤等,而通过调控AMPK改善肉品品质的研究相对较少。但由于AMPK是机体糖脂蛋白代谢的重要调节器,宰前AMPK主要通过调节脂代谢和蛋白代谢影响机体脂肪沉积、肌纤维类型及蛋白质的合成,进而影响肉品品质,而宰后其主要通过调控糖酵解影响肉品品质。因此,AMPK及其级联效应仍是改善肉品品质的重要靶点。
