干燥工艺对枇杷花茶感官品质的影响及其毒理学评价
2018-09-26郑美瑜李建军冯健君陆胜民
郑美瑜,李建军,冯健君,陆胜民,*
枇杷(Eriobotrya japonica Lindl.)系蔷薇科植物,是一种具有药用价值的小型亚热带常绿果树,在我国已经有2 200多年的种植历史,产区主要分布在浙江、福建、安徽、四川等省区。枇杷花为枇杷的花蕾及花序,性温、味淡、清香、带有甜味,据《本草纲目》记载,枇杷花“止渴下气,利肺气,止吐逆,清上焦热,润五脏”[1]。据报道枇杷花含有黄酮[2]、多酚[3-4]和三萜皂苷[5-6]等活性成分,具有化痰、止咳和清肺等功效[7-8],有较高的药用和保健价值[9-10]。枇杷花每个花序上会有80~100 朵花,在枇杷的栽培过程中,为了提高果实的品质和产量,要对果树进行疏花,每株会有60%~80%的新鲜花蕾被疏掉[11],使留下的花所结的果实有更充分的养分。因此,枇杷花资源来源丰富。枇杷花目前已成为研究热点,但研究大多集中于对枇杷花中黄酮和三萜酸等功能活性成分的提取方面[12-17]。笔者前期已分析了枇杷花不同花期和不同组织中主要有效成分的含量,以及不同干燥方法对有效成分含量的影响[18]。
目前干燥方法对枇杷花茶感官品质影响的研究还较少,芦艳[19]的研究对比了干炒杀青、微波杀青和蒸汽杀青对枇杷花感官品质的影响,但后续的干燥方法未做研究。本研究通过茶叶感官评审方法对比了在不同干燥方法预处理下枇杷花茶的固形物形态、汤色、香气、滋味等感官品质。植物原料中含有的多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)会引起干燥过程的酶促褐变[20-21],影响感官品质,为此,在干燥前要进行灭酶处理[22-24]。本实验研究了微波和热蒸汽两种处理对枇杷花中两种酶活力的影响。为了研究枇杷花茶食用安全性,本实验还对枇杷花进行了毒理学检验,以期为枇杷花的加工利用提供科学依据。
1 材料与方法
1.1 材料与试剂
枇杷花购自杭州市余杭区塘栖西太洋枇杷花研究所。枇杷花的采摘时间为2015年11月8日上午9:00~11:00,采取整个花序,采摘后立即运往浙江省果蔬保鲜与加工技术研究重点实验室,并把花序上盛花期的花蕾摘下,用于测定酶活力和进行不同的干燥处理。干燥花蕾的水提浓缩液作为毒理学检验样品,每毫升浓缩液由2.5 g枇杷花茶中提取得到。
实验动物ICR小鼠(清洁级)由浙江省实验动物中心提供,实验动物生产许可证号为SCXK(浙)2014-0001,实验动物使用许可证为SYXK(浙)2011-0166。
叠氮钠(NaN3)、敌克松(Dexon)、2-乙酰氨基芴(2-acetamidofluorene,2-AAF)、1,8-二羟基蒽醌(1,8-dihydroxyanthraquinone,1,8-HAQ) 美国Sigma-Aldrich公司。
1.2 仪器与设备
FD 5308真空冷冻干燥机 韩国SIM公司;DZF-6050型真空干燥箱、DHG-9070A型电热鼓风干燥箱、DK-8D型恒温水槽 上海精宏仪器设备有限公司;AL104-1C型电子天平 瑞士Mettler Toledo公司;Color Quest XE色差计 美国Hunter Lab公司。
1.3 方法
1.3.1 枇杷花的预处理
取枇杷花盛花期的新鲜花蕾,分别在蒸锅和微波炉(420 W)中进行灭酶热处理75 s,每隔15 s取出,立即测定枇杷花PPO和POD的活力。
1.3.2 粗酶液的提取
准确称取盛花期新鲜花蕾或经预处理的花蕾2 g,放入预冷的研钵中,加入pH 7.0磷酸盐缓冲液20 mL和少许石英砂低温研磨,4 ℃、7 000 r/min离心20 min,收集上清液即为粗酶液。
1.3.3 POD活力的测定
根据卓成龙等[22]的方法并适当改进,在石英比色皿中依次加入2 mL pH 6.0磷酸盐缓冲液、1 mL质量分数0.25%愈创木酚、0.2 mL粗酶液、0.1 mL质量分数0.75%过氧化氢溶液,迅速混匀,以缓冲液代替粗酶液作为空白,计时3 min,检测460 nm波长处吸光度的变化,由式(1)计算POD活力。
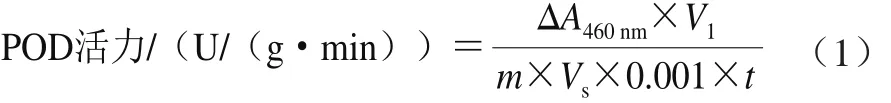
式中:ΔA460nm为吸光度变化;m为鲜质量/g;t为反应时间/min;V1为提取粗酶液总体积/mL;Vs为测定时取用酶液体积/mL。
1.3.4 PPO活力的测定
根据张立彦等[24]的方法并适当改进,在石英比色皿中加入2 mL pH 5.4的醋酸缓冲液、1 mL 10 mmol/L邻苯二酚、0.1 mL粗酶液,迅速混匀,以醋酸缓冲液取代粗酶液作为空白管,计时3 min,检测420 nm波长处的吸光度变化,由式(2)计算PPO活力。
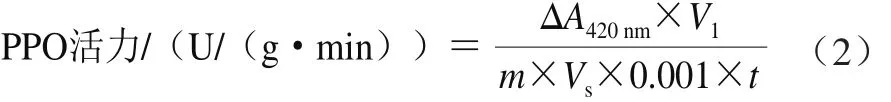
式中:ΔA420nm为吸光度的变化;m为鲜质量/g;t为反应时间/min;V1为提取粗酶液总体积/mL;Vs为测定时取用酶液体积/mL。
1.3.5 枇杷花的干燥
新鲜的枇杷花经灭酶处理后,分别通过冷冻干燥、微波干燥(140、280、420、560、700 W)、真空干燥(40、50、60 ℃)、热风干燥(40、60、80、100 ℃)即得枇杷花茶。冷冻干燥在冷冻干燥机里进行。微波干燥过程中每隔1 min,取出挥发水分和冷却30 s,再放回直至干燥。真空干燥在真空干燥箱里进行,热风干燥过程每隔30 min翻动一次。干燥后的枇杷花茶随机取适量,用于感官评定和活性成分含量的测定。
1.3.6 枇杷花茶感官评定
根据GB/T 23776—2009《茶叶感官评审方法》[25]和施兆鹏等[26]的花茶评审方法制定枇杷花茶的感官评分表(表1),随机挑选10 名非专业人员作为评审者。将样品混合均匀,由评审者各取10 g左右枇杷花茶置于白色A4纸上轻微晃动,观察外形。然后由评审者各取样品3 g,置于干净透明玻璃杯中,用150 mL沸水冲泡,静置5 min,将茶水倒出,观察汤色,嗅杯中的香气,品尝滋味,并依据表1进行打分,以评分的平均分作为统计结果。
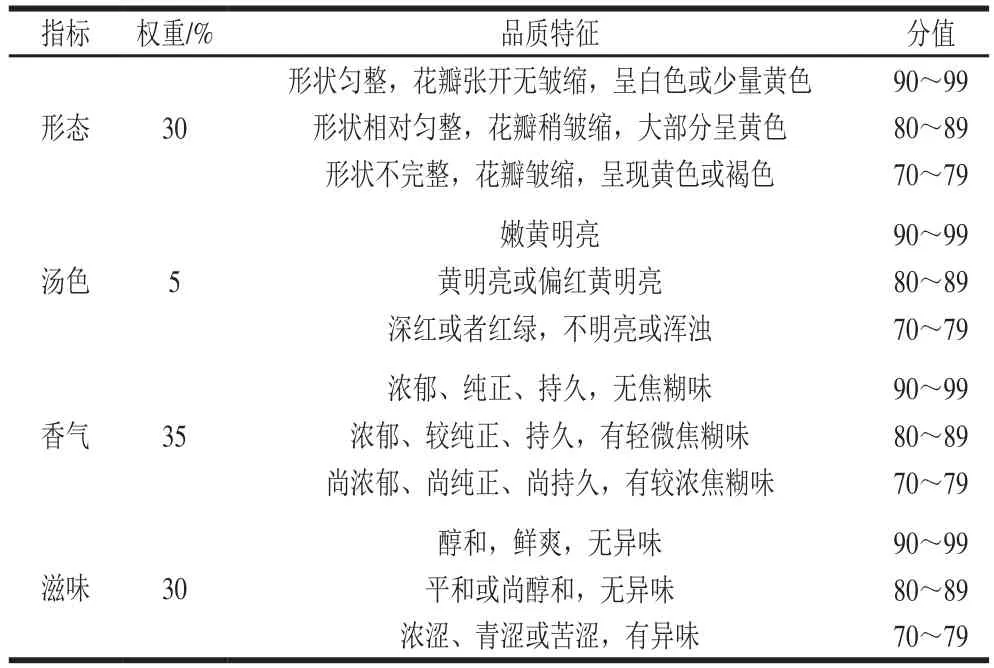
表1 枇杷花茶感官质量评分表Table 1 Criteria for sensory evaluation of loquat flowers tea
1.3.7 枇杷花茶汤色泽测定
以上述评审者进行感官评定的茶汤测定色泽,L用色差计测定茶汤的L*值(明度值)、a*值(正值表示偏红,负值表示偏绿)、b*值(正值表示偏黄,负值表示偏绿),以蒸馏水作为对照调零。
1.3.8 枇杷花毒理学检验
1.3.8.1 急性毒性实验
选用健康、成熟、体质量为18~22 g的ICR小鼠20 只,雌雄各半。小鼠灌胃前禁食(不禁水)16 h,按0.2 mL/10 g mb灌胃给予受试液,灌胃1 次,灌胃2 h后自由进食。灌胃后连续观察7 d,期间观察并记录小鼠的一般状况、中毒表现和死亡情况,记录实验期初及期末体质量。
1.3.8.2 Ames实验
选用4 株组氨酸营养缺陷型鼠伤寒沙门氏菌(TA97a、TA98、TA100、TA102),采用平板掺入法,通过多氯联苯诱导的大鼠肝匀浆经9 000×g离心后取上清液,加NADP及葡萄糖-6-磷酸等辅助因子作为体外代谢活性系统(即S9)。实验设20、100、500、2 500、12 500 μg/皿 5 个剂量组,外加空白对照、溶剂对照和阳性对照组(NaN3、Dexon、2-AAF、1,8-HAQ),每种菌株每个测试剂量设3 皿平行,在添加S9(+S9)和不添加S9(-S9)条件下分别进行实验。重复实验一次。
直接计数培养基上各菌株的回变菌落数。以计数培养基上各菌株的回变菌落数的多少而定,如在背景生长良好条件下,受试物组回变菌落数增加一倍以上,并有剂量反应关系或至少某一测试点有可重复的并有统计学意义的阳性反应,即认为受试物Ames实验结果阳性。
1.3.8.3 小鼠骨髓细胞微核实验
小鼠按体质量随机分成5 组,每组10 只,雌雄各半。枇杷花设2.5、5.0、10.0 g/kg 3 个剂量组,阴性对照组为蒸馏水,阳性对照组为环磷酰胺(40 mg/kg mb)。小鼠按20 mL/kg mb灌胃,间隔24 h灌胃2 次,于第2次灌胃后6 h脱臼处死。取胸骨骨髓制成骨髓片,甲醇固定,Giemsa染色。镜检时每只动物计数1 000 个嗜多染红细胞,计算微核率及嗜多染红细胞/成熟红细胞(PCE/NCE)个数比值。
1.3.8.4 小鼠精子畸形实验
雄性小鼠25 只,随机分成5 组,每组5 只。枇杷花设2.5、5.0、10.0 g/kg mb3 个剂量组,阴性对照组为蒸馏水,阳性对照组为丝裂霉素C(1.5 mg/kg mb)。小鼠按20 mL/kg灌胃,连续5 d,每天一次。于首次灌胃后第35天脱臼处死,取两侧附睾,制成吸滤液直接涂片,自然干燥,甲醇固定,用1%伊红染色。高倍镜下观察精子形态并计数,每只小鼠计数完整精子1 000 条,计算精子畸形发生率。
1.4 数据统计分析
实验数据以 ±s表示,组间的显著性分析用单因素方差分析,两两比较采用最小显著差数法(SNK法),显著水平为P<0.05。统计分析通过SPSS Statistics 17.0软件进行。
2 结果与分析
2.1 枇杷花中POD和PPO活力及热处理对其的影响
2.1.1 枇杷花不同组织中POD和PPO活力
枇杷花中的POD和PPO会促使枇杷花发生酶促褐变和氧化,影响外观颜色和有效成分含量等。由图1可知,在枇杷花的不同组织中,POD和PPO活力大小顺序均为花瓣>花蕊>花萼,且彼此间存在显著差异(P<0.05),而花瓣中的总酚含量最高[18],据研究报道,总酚含量、POD和PPO活力与褐变具有显著相关性[20],因此花瓣最易发生褐变,这与实际情况是相符的,枇杷花贮藏过程中,花瓣部分非常容易变色,因此,干燥前需对枇杷花进行灭酶预处理。
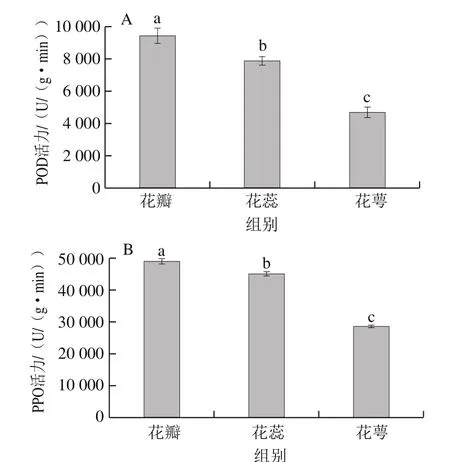
图1 枇杷花不同组织中POD(A)和PPO(B)的活力(n= 3)Fig. 1 POD (A) and PPO (B) activities in different tissues of loquat flower (n = 3)
2.1.2 热蒸汽和微波处理对枇杷花POD和PPO活力的影响
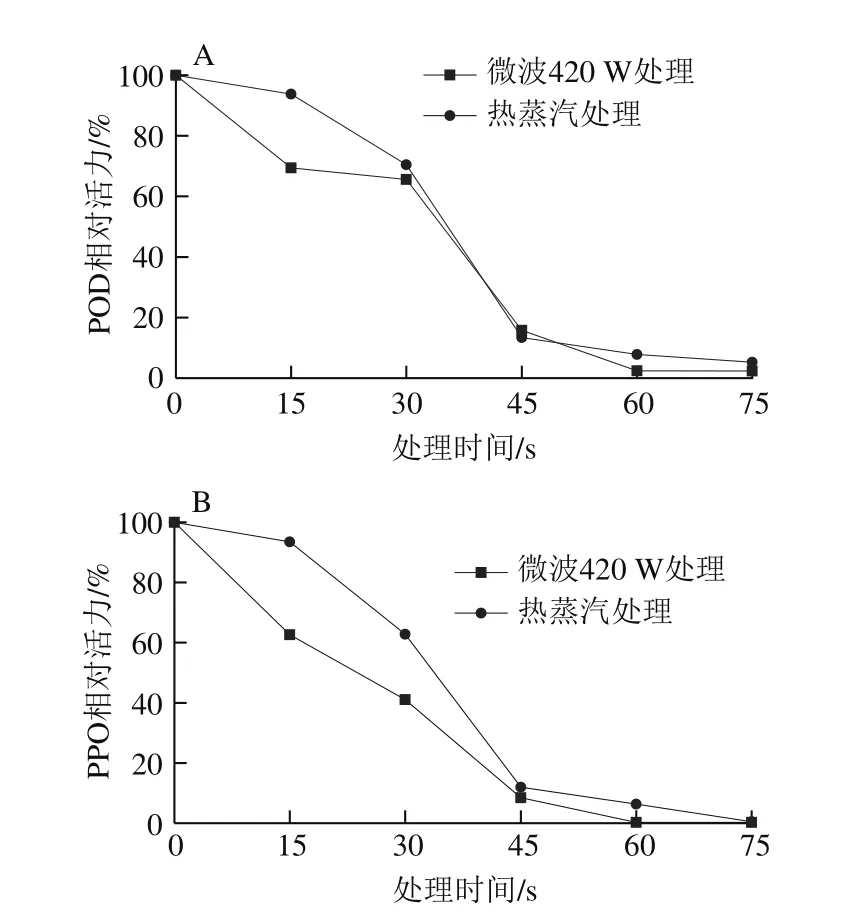
图2 处理时间对枇杷花POD(A)和PPO(B)活力的影响Fig. 2 Effect of treatment time on POD (A) and PPO (B) activities
由图2可以看出,蒸汽处理和微波处理都可以有效地抑制枇杷花中POD和PPO的活力。在处理时间短于45 s时,POD和PPO活力下降较快,在45~75 s内活力降低较为缓慢。分别用两种方式处理75 s后,POD和PPO活力均降低到原始酶活力5%以下。卓成龙等[22]研究表明,700 W微波处理毛豆仁85 s可以使POD活力降低到5%以下,比传统的热水处理效率高,且VC、叶绿素等成分损失率小。
2.2 不同干燥处理对枇杷花茶感官品质的影响

表2 不同干燥处理的枇杷花茶感官品质评分(n=10)Table 2 Sensory quality scores of loquat flower tea produced by different drying treatments (n= 10)
10 名评审者根据表1评分标准对不同干燥条件得到的枇杷花茶进行了评分,将平均分乘以权重因子,结果如表2所示。在形态上,真空冷冻的枇杷花形态最好,花瓣基本无皱缩,颜色保持了枇杷花的白色;微波干燥和真空干燥在功率或温度较低时,形态较好,当功率或温度较高时,枇杷花皱缩严重,有局部焦糊现象,使花瓣变色色泽变黄;而热风干燥时,温度较高时形态较好,可能因为温度较高时,干燥时间较短,因而形态保持较好。
在汤色方面,几种干燥方法得到的枇杷花茶汤都呈淡黄色,且亮度较高,因此获得的评分都较高。
在香气上,微波280 W和420 W干燥制得的样品茶汤香气最好,香气浓郁、纯正,可能是因为微波干燥时间短,而且微波使枇杷花中部分氨基酸发生美拉德反应,但功率较高时会产生焦糊味,香气不纯正;真空冷冻干燥基本保持了枇杷花的天然香气,但气味偏淡,其他两种干燥方法由于干燥时间长,香气物质损失较多。
在滋味上,枇杷花茶汤中酚类物质呈涩味,氨基酸呈鲜味,咖啡碱呈苦味,3 类物质共同构成茶汤的滋味,所以几种干燥方法中,冷冻干燥、微波280、420 W和真空干燥50 ℃条件下制得的样品茶汤醇和、鲜爽,获得较高的评分,可能与干燥方法对这3 种物质的影响有关。
在综合得分上,以真空冷冻的最高,其他3种干燥方法都以处于中间的干燥条件最高,如微波420 W、真空50 ℃和热风80 ℃时为最高。
综上所述,几种干燥方法对枇杷花感官品质的影响不同,冷冻干燥的感官品质最高,微波干燥次之,在实际生产中,可以根据需要和生产条件来选择干燥方法。董娟娥等[27]研究了不同干燥方法对杜仲雄花茶品质的影响,结果表明,炒制干燥所得的雄花茶感官指标得分较低,热风干燥和微波干燥的得分均较高。高温热风和微波420 W处理4 min、560 W处理3 min得分显著高于其他处理,这与本实验结果是基本相符的。
2.3 不同干燥处理对枇杷花茶汤色泽的影响
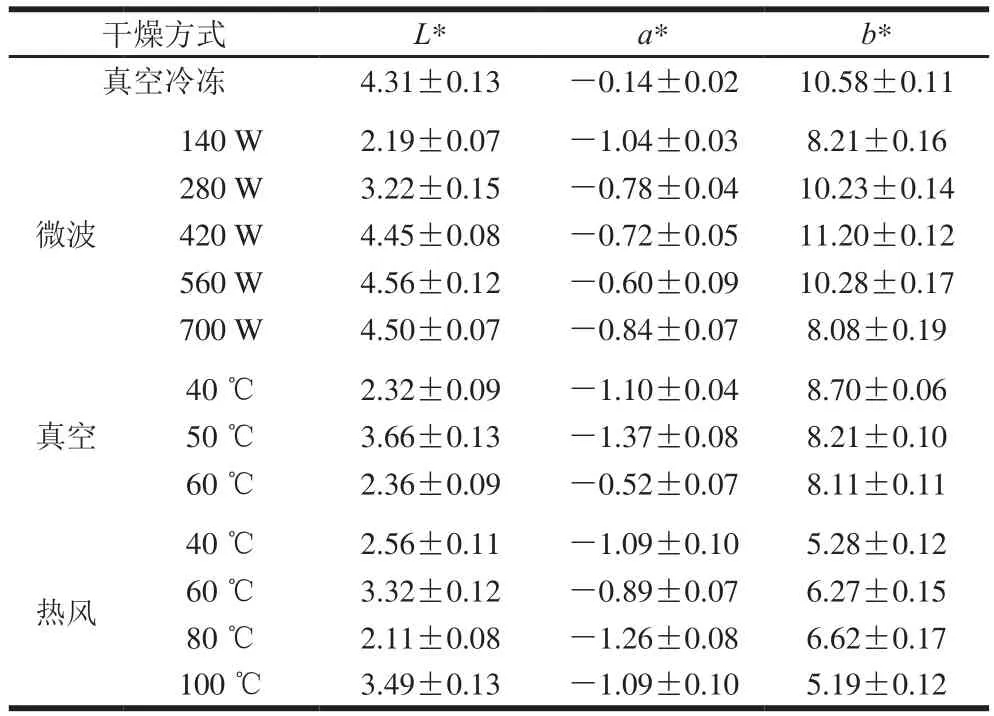
表3 不同干燥处理对枇杷花茶汤色泽的影响(n=10)Table 3 Effect of drying treatment on color difference of loquat flower tea infusion (n= 10)
由表3可知,表中真空冷冻干燥的L*值最大,表明亮度最高,而真空和热风干燥由于干燥过程中发生褐变和美拉德反应,致使茶汤L*值较低。a*值为负表示茶汤颜色偏绿绝对值越大颜色越深。b*值为正表明颜色偏黄,值越大表明黄度值越大。茶汤b*值的差异可能是因为干燥方法对黄酮的影响不同。各干燥方法对茶汤色泽的影响基本与它们对活性成分含量的影响一致[18]。
2.4 枇杷花毒理学评价
2.4.1 急性毒性实验结果

表4 枇杷花急性毒性实验小鼠死亡情况Table 4 Acute oral toxicity of loquat flower tea in mice
灌胃给予受试物后,雌雄小鼠均未见明显的中毒症状,14 d内动物无死亡(表4)。枇杷花对雌雄小鼠经口急性毒性半致死浓度(median lethal dose,LD50)均大于20.0 g/kg mb。根据急性毒性剂量分级表分级,枇杷花属于无毒类。
2.4.2 Ames实验结果
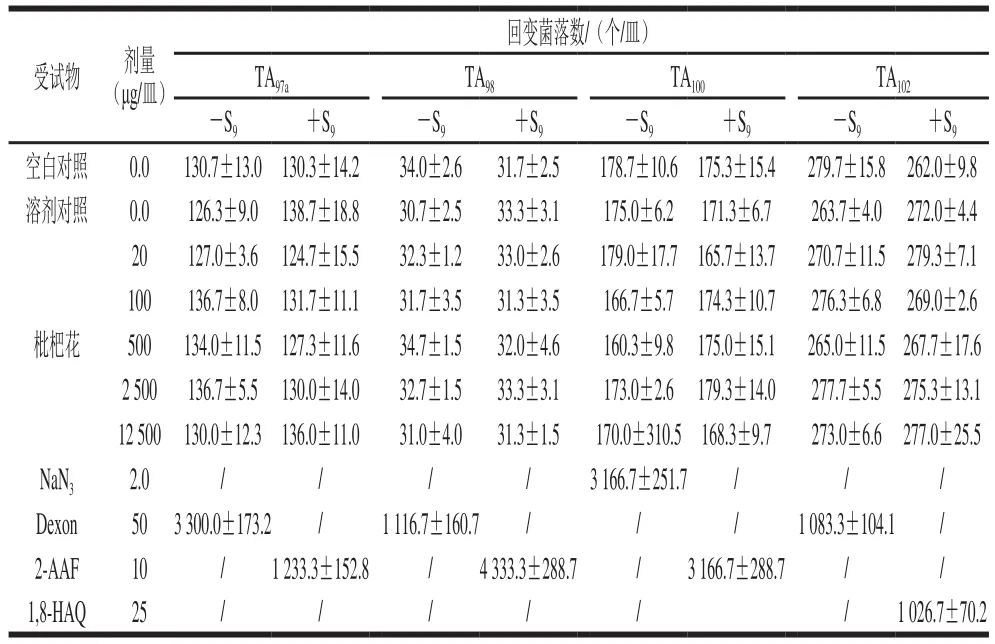
表5 枇杷花Ames实验结果(n=3)Table 5 Ames test of loquat flower tea (n= 3)
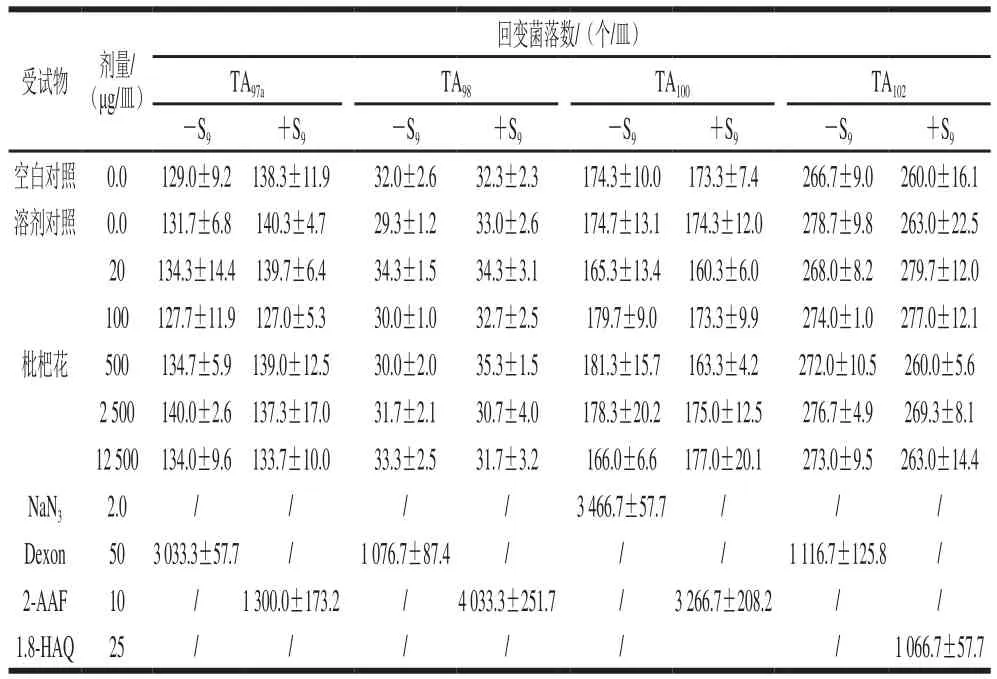
表6 枇杷花Ames实验重复实验结果(n=3)Table 6 Results of replicate Ames test of loquat flower (n= 3)
由表5、6可知,不同浓度受试物在加和不加S9条件下的回变菌落与空白对照组、溶剂对照组相近似,而阳性对照回变菌落数均高于空白对照组、溶剂对照组和受试物组的回变菌落数2 倍以上。表明在该实验条件下枇杷花没有致突变作用。
2.4.3 小鼠骨髓细胞微核实验结果
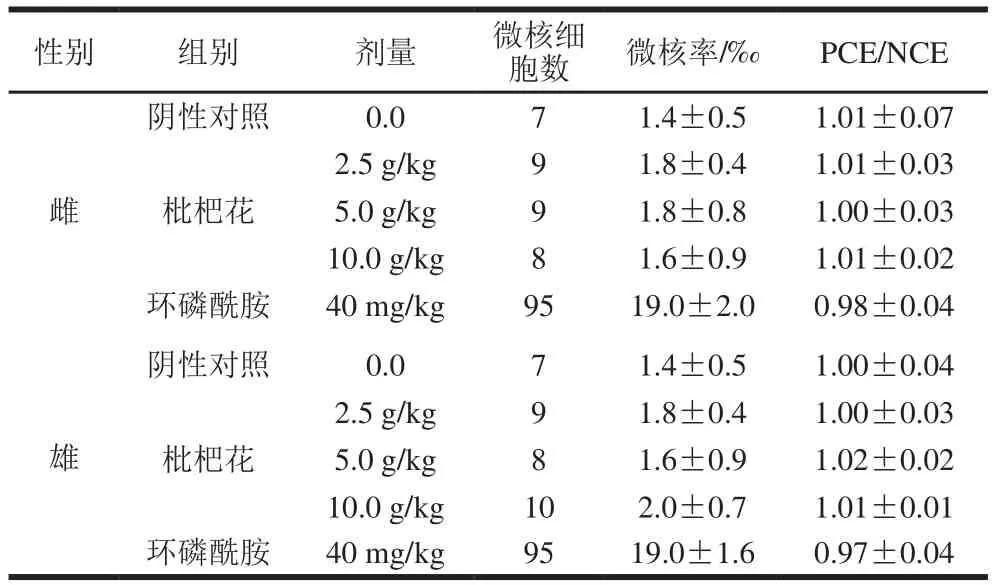
表7 枇杷花对小鼠骨髓细胞微核率的影响(n=10)Table 7 Effect of loquat flower tea on mouse micronuclei frequency (n= 10)
由表7可知,雌雄各剂量组PCE/NCE比值不低于对照组的20%,符合技术规范要求。由方差分析结果可知,枇杷花各剂量组与阴性对照组相比,微核率均无显著差异,而阳性对照组微核率则极显著高于阴性对照组(P<0.01)。表明枇杷花对小鼠骨髓嗜多染红细胞微核率未见明显影响,检测结果为阴性。
2.4.4 小鼠精子畸形实验结果
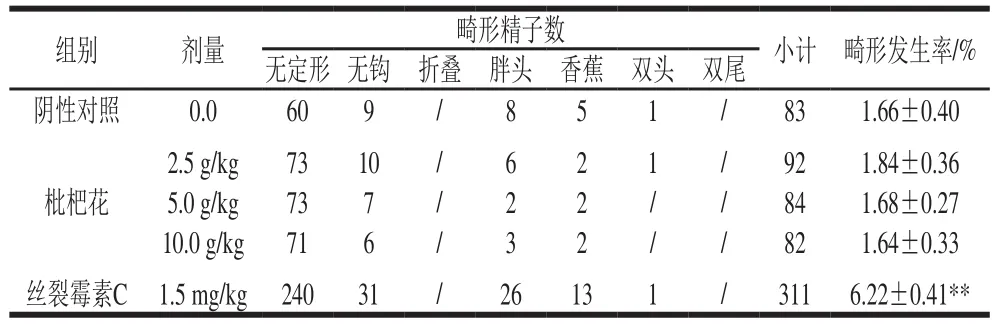
表8 枇杷花对小鼠精子畸形发生率的影响(n=5)Table 8 Effect of loquat flower tea on sperm malformation rate in mice (n= 5)
由表8可知,各剂量组与阴性对照组比较,小鼠精子畸形发生率均无显著性差异,而阳性对照组则极显著高于阴性对照组(P<0.01),检测结果为阴性,表明枇杷花对小鼠精子畸形发生率未产生明显影响。
3 结 论
由研究结果可知,蒸汽和微波处理可以杀灭枇杷花中的PPO和POD两种酶,从而减少了后续干燥过程中的酶促褐变和氧化。几种干燥工艺中,冷冻干燥的枇杷花感官品质最好,微波干燥次之,其中微波在420 W功率下干燥的品质最好,真空干燥和热风干燥的感官品质差别不大,热风干燥在80 ℃时干燥品质较好。在生产中可以根据设备条件选择干燥方法。
毒理学检验表明,急毒实验表明枇杷花属无毒类,小鼠经口最大耐受剂量大于20.0 g/kg mb;小鼠遗传毒性实验(Ames实验、骨髓嗜多染红细胞微核实验、精子畸形实验)结果均为阴性。本研究结果为今后枇杷花茶的加工和保健功能的开发研制提供了科学依据。
近年来,对枇杷花的应用逐渐升温,并向食品方面发展,如枇杷花饮料[28-29]、枇杷花茶[30-31]等。本实验在毒理学上证明枇杷花属无毒类的原料,可以为其提供安全性的佐证。今后,随着枇杷花中活性成分的明晰、功能活性的明确,以及安全性的保证,其将会在食品和保健品中进一步得到应用。
