小麦α-醇溶蛋白体外克隆表达及脱酰胺改性对面条机械特性的影响
2018-09-26张风丽李章发陈林萍林维杰杨彦红文晓艳
廖 兰,张风丽,李章发,陈林萍,林维杰,杨彦红,文晓艳,倪 莉
小麦是我国三大粮食来源之一[1]。小麦蛋白是小麦的副产物,主要由麦谷蛋白和麦醇溶蛋白组成,被当作食品添加剂广泛应用于食品领域[2-4]。麦醇溶蛋白对面团的延展性有重要影响,可分为4 种类型,即α-、β-、γ-和ω-醇溶蛋白[5-8],其中α-醇溶蛋白毒性最大,是引起乳糜泻的主要蛋白质[9-12]。由于小麦醇溶蛋白不同亚基类型和麦谷蛋白具有较高的分子同源性,因此用传统分离纯化方法分离出α-醇溶蛋白难度较大[13]。目前,利用大肠杆菌表达、提取蛋白,测定揉混实验参数已经成为研究α-醇溶蛋白功能的重要方法。李敏[14]利用Escherichia coli体外表达表达得到α-醇溶蛋白,将其添加到基础面粉中,利用粉质仪研究其对面团流变学特性影响,发现α-醇溶蛋白会使面团带宽和机械耐力系数有所增加,而缩短面团的稳定时间和形成时间。刘国娟[15]发现α-醇溶蛋白可以缩短揉面时间并增加面团耐揉性。小麦面筋蛋白含有大量的疏水性氨基酸谷氨酰胺和天冬酰胺,导致其难溶于水,限制了其在食品行业上的应用[16]。脱酰胺改性可以将酰胺基转化为羧基从而提高其溶解性[17]。Shih[18]、Liao Lan[19]和Wang Yongquan[20]等的研究发现酸可以更加有效地将酰胺基团转变为羧基,从而改善小麦面筋蛋白的功能性质。Berti等[21]发现醋酸可以降低小麦蛋白的致敏性。本研究通过体外克隆表达的方法得到α-醇溶蛋白,利用柠檬酸对α-醇溶蛋白进行脱酰胺改性,并将其添加到面粉中,研究脱酰胺改性α-醇溶蛋白的结构变化对面条质地的影响,为进一步研究柠檬酸改性对α-醇溶蛋白致敏性的影响提供理论依据。
1 材料与方法
1.1 材料与试剂
pUC57-α-gliadin由实验室保存;克隆和表达试剂、DNA凝胶回收纯化试剂盒 大连宝生物工程有限公司;周麦28面粉 河南周园种业有限公司;其他所有试剂均为分析纯。
1.2 仪器与设备
VeritiTM96-well聚合酶链式反应(polymerase chain reaction,PCR)梯度扩增仪 Applied Biosystems(中国)科技有限公司;JS-680B全自动凝胶成像分析仪 上海培清科技有限公司;8210E傅里叶变换红外光谱仪 美国尼高力仪器公司;FluoroMax-4荧光分光光度计 法国Horiba Jobin Yvon公司;SH-4000扫描电子显微镜(scanning electron microscope,SEM) 韩国HIROX公司。
1.3 方法
1.3.1 pUC57-α-gliadin转化感受态细胞及序列分析
根据GenBank公布的α-醇溶蛋白基因编码区两端保守区设计1 对引物,引物序列为P1:5’-ATGAAGACCTTTCTCATCCTT-3’、P2:5’-GTTAGTACCGAAGATGCCAAATG-3’,将pUC57-α-gliadin转化至DH5α,蓝白斑筛选阳性菌。以阳性菌为模板进行PCR鉴定,以不含目的基因的DH5α为对照组,PCR产物用质量分数1%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)检测鉴定后送测序公司进行DNA测序,采用NCBI在线BLAST进行序列同源性比对,用DNAMAN软件翻译DNA序列。
1.3.2 表达载体的构建和鉴定
根据目的序列完整编码区,利用Primer Premier 5.0软件设计1 对表达引物P3:5’-CGCCATATGGTTAGAGTT CCAGTGCCA-3’、P4:5’-CCGCTCGAGGTTAGTACCG AAGATGCCAAATG-3’,在上游引物P3、下游引物P4的5’端分别引入酶切位点Nde I和Xho I,以阳性质粒为模板扩增并回收目的基因。PCR产物于1% SDS-PAGE检测后回收,回收的PCR产物及pET-22b(+)质粒分别用Nde I和Xho I进行双酶切,酶切片段经纯化回收,用T4 DNA连接酶16 ℃连接过夜,连接产物转化至DH5α,双酶切鉴定阳性克隆后进行测序。
1.3.3 融合蛋白的表达和纯化
阳性重组质粒pET-22b-α-gliadin转入宿主细菌E. coli BL21(DE3)中,挑取单菌落接种在5 mL LB培养液中(含100 μg/mL氨苄青霉素),在37 ℃下振荡培养过夜。按照1∶100的比例接种于新鲜液体LB培养基(含100 μg/mL氨苄青霉素)上,37 ℃振荡培养至OD600nm值为0.6~0.8,加入异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)至终浓度为1 mmol/L,37 ℃下培养18 h,20 ℃、10 000 r/min离心5 min,收集菌体,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗两次。取部分菌体超声破碎处理后进行SDS-PAGE分析。根据Arentz-Hansen等[22]的方法,用预热至60 ℃的体积分数70%乙醇溶液重悬菌体,60 ℃下水浴2 h,菌悬液在20 ℃、12 000 r/min离心30 min,收集上清液,进行SDS-PAGE分析。加入上清液2 倍体积的1.5 mol/L氯化钠溶液,4 ℃下过夜沉降α-醇溶蛋白,离心收集沉淀,透析后冷冻干燥。
1.3.4 α-醇溶蛋白脱酰胺改性
根据Liao Lan等[19]的方法,配制含0.04 mol/L柠檬酸的α-醇溶蛋白悬浮液(质量分数1%),在水浴锅中常温水化8 h后放入灭菌锅中121 ℃湿热脱酰胺10 min,于4 ℃、9 500 r/min离心10 min后得到上清液,在4 ℃透析24 h除去盐离子,冻干,得到脱酰胺改性的α-醇溶蛋白。
1.3.5 傅里叶变换红外光谱测定
根据Liao Lan等[23]的方法。称取2 mg样品及200 mg KBr,在干燥条件下研磨至均匀,压片,全波段扫描(4 000~400 cm-1),用PeakFit v4.12软件去卷积和二阶求导,分析酰胺I带区域(1 700~1 600 cm-1)图谱二级结构含量。
1.3.6 内源性荧光扫描
根据Wu Haohao等[24]的方法,待测样品溶于体积分数70%乙醇溶液中(1.0 mg/mL)。荧光分光光度计的测定条件为:激发波长295 nm,记录300~400 nm波长范围的发射光谱。
1.3.7 SEM观察
SEM观察根据李剑平[25]的方法。取干净样品台,均匀贴上长度为3~4 mm的导电胶,粘取少量固体粉末涂抹在导电胶上。将样品台放入喷金仪器的真空室,开启真空泵抽真空。待压力达到2~4 Pa时开始喷金。电流为20 mA,时间为40 s。将样品台放入仪器真空室抽真空,待压力适宜后打开钨灯丝电源,开始观察。
1.3.8 脱酰胺改性α-醇溶蛋白对面条质地影响的测定
根据刘国娟[15]和王灵昭[26]等的方法并作适当调整,分别在10 g面粉中添加20 mg脱酰胺改性和未改性α-醇溶蛋白,搅拌均匀后加入5.0 mL蒸馏水揉成面团,再制成面条,以未加入α-醇溶蛋白的面条作为对照,测定质地剖面分析(texture profile analysis,TPA)指标。每次将3 根面条水平放置在载物台上,每个样品做6 组平行实验。质构仪设定参数为:轻型刀片探头;Compress模式;测试前速率0.8 mm/s,测试速率0.8 mm/s,测试后速率1 mm/s;测试距离为样品75%厚度;感应力为Auto-5 g。
1.4 数据统计与分析
所有实验均进行平行实验,而且重复2~3 次;样品的测定均重复3~5 次,结果应用SPSS 13.0软件中LSD多维分析法进行方差和显著性分析,以P<0.05表示差异显著。采用Origin 9.0软件作图。PCR结果用Image lab软件进行处理和分析。
2 结果与分析
2.1 pUC57-α-gliadin转化及同源性分析结果
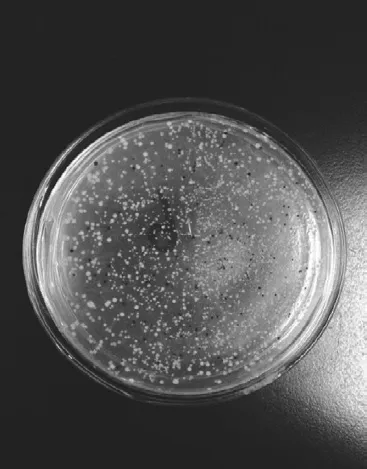
图1 pUC57-α-gliadin转化的平板蓝白斑Fig. 1 Clones shown as blue or white plaques on a plate
由图1可以看出,在含有5-溴-4-氯-3-吲哚基β-D-半乳糖苷、IPTG和含氨苄青霉素的LB琼脂平板培养基上有明显的蓝白斑单菌落,可以初步判断pUC57-α-gliadin成功转化到了DH5α感受态细胞中。挑选单菌落进行PCR鉴定,经1.0% SDS-PAGE检测,由图2可以看出,泳道4、8、9在860 bp处出现了PCR产物,证明其为阳性克隆子。测序结果采用NCBI在线BLAST进行同源性分析,结果如表1所示,实验所用α-gliadin序列广泛存在于小麦基因组中,其最高同源性最高达到100%。
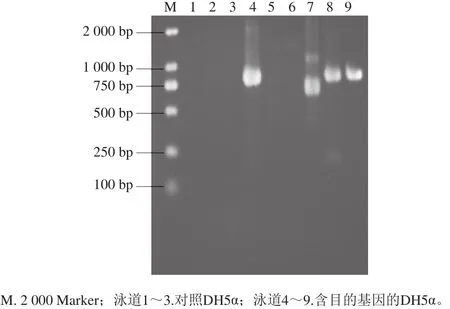
图2 pUC57-α-gliadin PCR鉴定结果Fig. 2 Agarose electrophoresis pattern of PCR amplification products of pUC57-α-gliadin
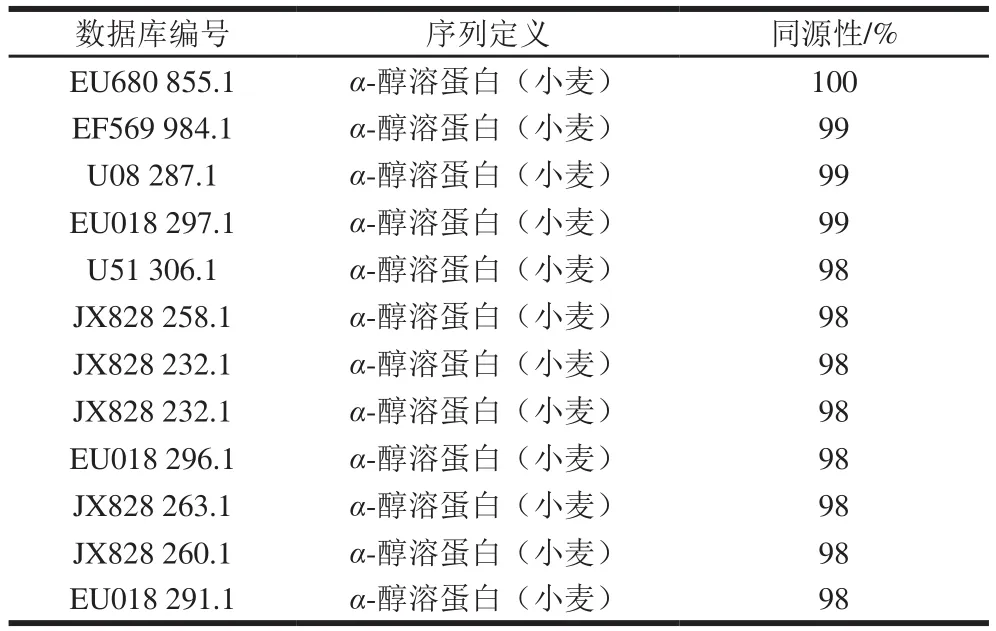
表1 α-gliadin基因序列同源性分析Table 1 Homology analysis of α-gliadin nucleotide sequences
2.2 表达载体pET-22b-α-gliadin构建结果
连接产物转化感受态细胞后,如图3所示,在含氨苄青霉素的LB琼脂平板培养基上可以长出白色单菌落,说明pET-22b-α-gliadin成功进入DH5α感受态细胞并使其产生氨苄抗性。挑选4 个单菌落进行PCR鉴定,经1.0% SDS-PAGE检测,由图4可以看出,泳道1~4在800 bp处出现目的片段。双酶切结果(图5)和测序结果证明其为阳性克隆子。
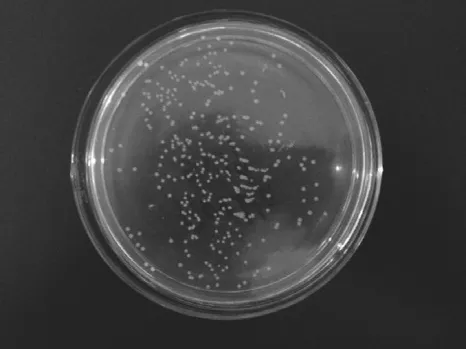
图3 pET-22b-α-gliadin的转化结果Fig. 3 Transformation of plasmid pET-22b-α-gliadin
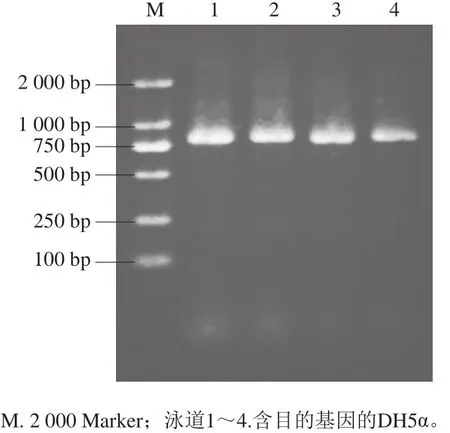
图4 pET-22b-α-gliadin阳性克隆子PCR鉴定Fig. 4 Agarose electrophoresis pattern of PCR amplification products of pET-22b-α-gliadin
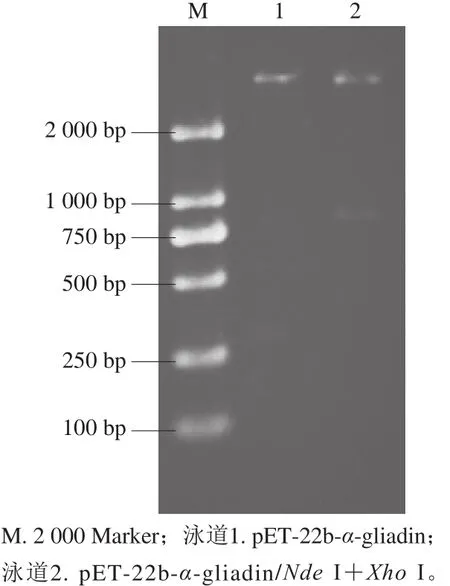
图5 阳性克隆子双酶切鉴定Fig. 5 Agarose electrophoresis pattern of the double digested plasmid DNA
2.3 诱导表达产物SDS-PAGE分析结果
用DNAMAN软件对表达蛋白氨基酸序列进行推导,氨基酸序列如下:MVRVPVPQLQPQNPSQQQPQEQVP LVQQQQFLGQQQPFPPQQPYPQPQPFPSQQPYLQLLPF LQPQLPYSQPQPFRPQQPYPQPQPQYSQPQQPISQQQQ QQQQQQQQQQQQQQQIIQQILQQQLIPCMDVVLQQH NIVHGKSQVLQQSTYQLLQELCCQHLWQIPEQSQCQA IHNVVHAIILHQQQKQQQQPSSQVSFQQPLQQYPLGQ GSFRPSQQNPQAQGSVQPQQLPQFEEIRNLALQTLPA MCNVYIPPYCTIAPFGIFGTNLEHHHHHH,预测的蛋白质分子质量为32.2 kDa。从图6中可以看出,经过体积分数70%乙醇溶液提取后,在约32.0 kDa处出现一条明显的条带,这与Arentz-Hansen等[22]的结果相似,证明经过诱导后DE3表达出目的α-醇溶蛋白,且用体积分数70%乙醇溶液可以提纯得到目的蛋白,为下一步的实验提供了依据。
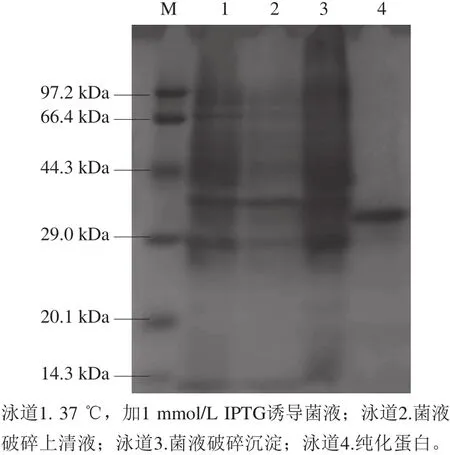
图6 α-醇溶蛋白诱导表达产物的SDS-PAGE分析Fig. 6 SDS-PAGE analysis of expressed and purified α-gliadin
2.4 α-醇溶蛋白及其改性后二级结构变化
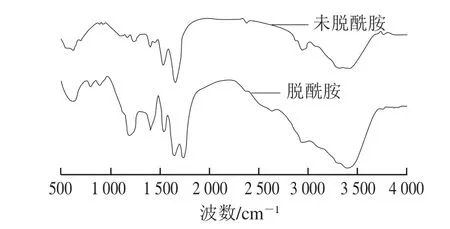
图7 脱酰胺改性α-醇溶蛋白傅里叶变换红外光谱图Fig. 7 Fourier transform infrared spectrum of deamidated α-gliadin
图7 为α-醇溶蛋白经过柠檬酸脱酰胺改性前后的傅里叶变换红外光谱图。对α-醇溶蛋白的酰胺I带(1 700~1 600 cm-1)带进行分峰处理,能够得到5 种蛋白二级结构特征峰(1 604、1 635、1 652、1 679、1 693 cm-1)。
从表2可知,经过柠檬酸脱酰胺改性后α-醇溶蛋白的α-螺旋含量由39.80%下降至33.50%,同时β-折叠结构含量由39.50%上升为52.30%,增加显著,而β-转角含量则从20.70%下降为15.40%。龙伟等[27]指出:蛋白质α-螺旋和β-折叠是存在于蛋白质内部的稳定规则结构,β-转角较多地暴露在蛋白质表面,这使得抗体比较易于和β-转角嵌合,其成为抗原表位的可能性也随之提高;脱酰胺改性后α-醇溶蛋白的β-转角含量下降,说明其成为抗原表位的可能性降低,因此降低α-醇溶蛋白的致敏性。α-螺旋的结构比较紧密且稳定,这不利于蛋白展现良好的功能特性所需要的构象变化[28]。β-折叠和β-转角结构的紧密程度较差且构象稳定性也比α-螺旋结构差,但是它可以改善蛋白质的柔韧性,有利于蛋白质一些功能特性的发挥。α-螺旋/β-折叠的值反映了蛋白质分子柔韧性,比值小则蛋白质柔韧性高[29]。表2显示α-醇溶蛋白经过柠檬酸脱酰胺改性后,α-螺旋/β-折叠由1.00降为0.64,说明柠檬酸脱酰胺改性提高了α-醇溶蛋白分子柔性。
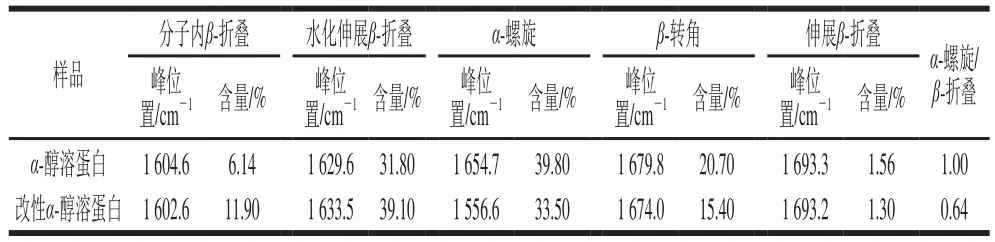
表2 脱酰胺改性α-醇溶蛋白的二级结构含量变化Table 2 Secondary structure composition of deamidated α-gliadin
2.5 α-醇溶蛋白及其改性后内源性荧光变化
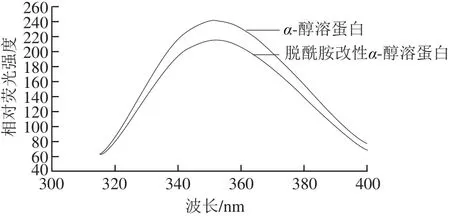
图8 脱酰胺改性α-醇溶蛋白内源性荧光扫描图Fig. 8 Endogenous fluorescence spectrum of deamidated α-gliadin
内源性荧光光谱主要由色氨酸残基环境极性的变化确定,是监测溶液中蛋白质含量和蛋白质在界面处构象变化的灵敏方法[29]。如图8所示,经过柠檬酸脱酰胺改性后,改性α-醇溶蛋的λmax从351.5 nm移动到355.3 nm,λmax向长波长方向移动,这是由于经脱酰胺处理后的蛋白结构部分展开,使内源色氨酸基团暴露在溶剂中,色氨酸残基周围的微环境极性增强。说明脱酰胺处理有利于α-醇溶蛋白构象的展开。
2.6 SEM观察结果
醇溶蛋白是只含有分子内二硫键的单体蛋白质,由于没有亚基结构和分子间二硫键,醇溶蛋白肽链之间通过氢键、疏水键和分子内二硫键连结,形成紧密的三维结构而呈球形[30]。图9a中α-醇溶蛋白呈颗粒状或球形,表面粗糙重叠在一起。图9b中可以看出α-醇溶蛋白经过柠檬酸湿热脱酰胺改性后,形成表面光滑均匀的块状。说明脱酰胺改性对α-醇溶蛋白作用效果非常明显,使其结构发生了剧烈的变化。

图9 脱酰胺改性α-醇溶蛋白SEM扫描图Fig. 9 SEM photomicrographs of deamidated α-gliadin
2.7 α-醇溶蛋白及其脱酰胺改性后对面团质地的影响
为进一步探究柠檬酸脱酰胺改性α-醇溶蛋白对面条质地的影响,利用质构仪测定了添加α-醇溶蛋白和柠檬酸脱酰胺改性的α-醇溶蛋白的面团制成面条的TPA指标,以期对脱酰胺改性α-醇溶蛋白的应用提供参考。
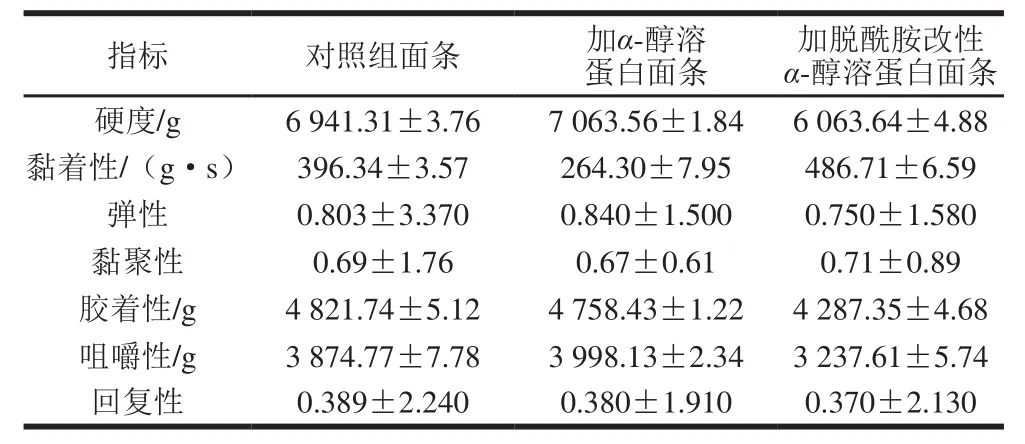
表3 脱酰胺改性α-醇溶蛋白对面条质地的影响Table 3 Effect of deamidated α-gliadin on textural properties of noodles
如表3所示,总体而言,添加了α-醇溶蛋白的面条除了黏着性由(396.34±3.57)g·s降为(264.30±7.95)g·s外,对于其他参数,α-醇溶蛋白的添加影响有限。而对于添加了柠檬酸脱酰胺改性α-醇溶蛋白的面条,其硬度由(6 941.31±3.76)g下降为(6 063.64±4.88)g,黏着性提高至(486.71±6.59)g·s,同时,面条的胶着性下降了534.39 g,咀嚼性下降了637.16 g,降幅明显;而面条的弹性、黏聚性以及回复性则没有发生太大变化。这说明经过柠檬酸脱酰胺改性后,α-醇溶蛋白会提高面条的黏性而降低面条硬度,对于弹性的影响较小。
3 结 论
本实验通过体外表达、分离纯化得到小麦α-醇溶蛋白,研究了在柠檬酸湿热脱酰胺处理10 min后小麦α-醇溶蛋白的分子结构的变化,以及改性后对面条质地的影响,主要得出以下结论:1)经过柠檬酸脱酰胺改性后,α-醇溶蛋白的α-螺旋和β-转角结构含量降低,β-折叠结构的含量增加,α-螺旋/β-折叠下降,说明α-醇溶蛋白的分子柔性得到提高,有利于α-醇溶蛋白相关功能特性的发挥。2)脱酰胺改性后α-醇溶蛋白内源色氨酸暴露,蛋白结构展开,SEM观察结果进一步说明脱酰胺改性使α-醇溶蛋白结构发生剧烈变化。3)TPA实验结果表明,脱酰胺改性α-醇溶蛋白可以显著提高面条的黏性而降低面条硬度,为α-醇溶蛋白的应用提供理论依据。以上结果表明,利用柠檬酸对α-醇溶蛋白进行脱酰胺改性改善了α-醇溶蛋白的功能性质,具有一定的理论价值和实际意义,可为开展α-醇溶蛋白致敏性研究提供参考。
