饲养方式对苏尼特羊肠道菌群与脂肪酸代谢的影响
2018-09-26王柏辉罗玉龙王德宝
王柏辉,杨 蕾,罗玉龙,王 宇,袁 倩,王德宝,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
随着国家退化草地限牧、退牧还草及禁牧舍饲、恢复草地生态政策的实施,内蒙古、新疆和青海等以放牧为主的地区逐渐改变饲养模式,由传统的天然放牧或放牧补饲的饲养方式转变为舍饲或舍饲与放牧(季节性)相结合的饲养管理方式,这种转变的确带来了明显的生态环境效应和产生了巨大的社会效益,但同时带来了一些负面影响;其中放牧羊圈养后造成的羊肉品质劣化是消费者的一个普遍认识。放牧羊肉在风味上显著优于舍饲羊,羊肉异味发生率明显低,并且放牧羊肉营养素组成和功能性成分含量方面也优于非放牧羊[1-2]。苏尼特羊作为内蒙古独特的优良羊种,蛋白含量高、膻味轻,并且富含人体所需的各种氨基酸和脂肪酸,具有较高的营养价值[3]。
近年来,动物体内胃肠道微生物是研究热点,大量文献报了道肠道微生物与动物(包括人类)营养代谢、肥胖、脂肪沉积和糖尿病等的关系,胃肠道微生物在营养代谢方面的作用主要包括碳水化合物代谢、蛋白质和氨基酸代谢、脂质代谢、维生素代谢及矿物质代谢等[4-5]。研究表明动物饮食和能量代谢的不同、羊肠道菌群的变化与肉中化学组成的变化有密切的联系[6]。也有研究表明首先脂肪沉积与拟杆菌属和厚壁菌属的比例有密切关系,其次细菌基因可能调控与脂代谢途径相关基因。肠道微生物的发酵产物短链脂肪酸作为机体的能源物质,可调控G蛋白偶联受体(GPCR 41和GPCR 43)的活性,其与脂肪代谢相关酶(脂肪酸合成酶、乙酰辅酶A羧化酶等)间具有相互协同、相互调控的作用[7-9]。另外,研究不同饲养模式下苏尼特羊肠道微生物及代谢产物和血液与羊肉中脂肪酸的相互关系,为今后改善放牧羊圈养后羊肉品质的劣化提供理论依据。
1 材料与方法
1.1 材料与试剂
在内蒙古乌拉特中旗,选择两种饲养方式(放牧和放牧+舍饲)12 月龄苏尼特羊共24 只,每组12 只,公母各半。放牧组:断奶后,自由放牧12 个月;放牧+舍饲组:断奶后,自由放牧9 个月后舍饲喂养3 个月。在放牧条件下,牧草种类以乌拉特中旗荒漠化草原典型牧草(芨芨草、蒙古葱、中间锦鸡儿、沙生冰草、碱韭等10余种)为主;舍饲条件下,草料以农区饲草料(玉米秸秆、葵盘粉、葵花籽皮等,同时补充玉米精料及育肥饲料)为主,放牧组和放牧+舍饲组体质量分别约为40.8 kg和28.55 kg。屠宰前,用乙二胺四乙酸抗凝剂的真空采血管采集羊颈静脉血液约2 mL;屠宰后,取背最长肌60 g于-20 ℃保藏待用。收集粪便约20 g于无菌无酶冻存管中,液氮运输,-80 ℃保藏待测。
三氯甲烷、三氟化硼-乙醚络合物、氯化钠、氢氧化钠、无水硫酸钠、硫酸、乙醚(均为分析纯)、正己烷(色谱纯)、甲醇(色谱纯)、37 种脂肪酸甲酯的混合标准品 美国Sigma公司;甘油三酯(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒 南京建成生物工程研究所;QIAamp DNA Stool Mini Kit试剂盒 德国QIAGEN公司;乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸标准品 天津光复科技发展有限公司。
1.2 仪器与设备
气相色谱-质谱联用仪 美国赛默飞世尔科技公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;HJ-6型多头磁力搅拌加热器 江苏荣华仪器制造有限公司;5810R离心机 德国Eppendorf公司;HH-4水浴锅 上海福玛实验设备有限公司;GRX-9053A型热空气干燥箱 上海一恒科技有限公司;FTC-3000聚合酶链式反应(polymerase chain reaction,PCR)仪 加拿大Funglyn Biotech公司。
1.3 方法
1.3.1 肠道微生物菌群的测定
1.3.1.1 粪便总DNA提取
采用QIAamp DNA Stool Mini Kit试剂盒提取细菌总DNA,用核酸浓度测定仪测定总DNA浓度,于-20 ℃保存备用。
1.3.1.2 细菌16S rDNA序列扩增和MiSeq测序
选取16S rDNA的V4~V5区序列进行高通量测序分析。采用两步PCR扩增方法进行文库构建。将纯化的DNA作为模板,利用16S rDNA V4~V5区通用引物515F(5’-GTGCCAGCMGCCGCGG-3’)和907R(5’-CCGTCAATTCMTTTRAGTTT-3’)扩增目的片段16S rDNA V4~V5区,并用1.2%琼脂糖凝胶电泳检测,检测效果较好的样本进行2%琼脂糖凝胶电泳并切胶回收,以回收产物为模板进行一次8 个循环的PCR扩增,将Illumina平台测序所需要的接头,测序引物和标签序列添加到目的片段两端。全部PCR产物采用AxyPrepDNA凝胶回收试剂盒进行回收,并用PCR仪进行荧光定量,均一化混匀后完成文库构建,在Illumina MiSeq平台上完成测序。此实验由上海微基生物科技有限公司完成。
1.3.2 肠道微生物代谢物的测定
1.3.2.1 短链脂肪酸标准曲线的绘制
分别取标准品(纯度为99%)1 mL用色谱纯甲醇定容至10 mL容量瓶中,依次10 倍稀释为6 个梯度(10-1、10-2、10-3、10-4、10-5、10-6)。
1.3.2.2 短链脂肪酸的提取
称取0.1~0.2 g粪便与2 mL冰生理盐水,再加入1 mL 50%的硫酸溶液后漩涡混匀,10 000 r/min离心5 min。然后再加入2 mL乙醚充分混匀,10 000 r/min离心5 min,静止分层,取上清液,用0.22 μm有机滤膜过滤后,用于气相色谱分析。
1.3.2.3 气相色谱-质谱条件
气相色谱条件:DB-5色谱柱(30 m×0.25 mm,0.25 μm),载气为氦气,载气流速1.2 mL/min,进样口温度250 ℃,进样量为1 μL,分流比10∶1。采用程序升温:初始温度为100 ℃,保持0.5 min,然后以8 ℃/min的速率升至180 ℃,保持1 min;然后以20 ℃/min的速率升至200 ℃,保持5 min。
质谱条件:离子源温度250 ℃,传输线温度250 ℃,质量扫描范围m/z 40~450。
1.3.3 血脂指标的测定
采用分光光度法,根据测定试剂盒说明书操作步骤,对TG、TC、HDL-C、LDL的浓度进行测定。
1.3.4 羊肉中脂肪酸的测定
1.3.4.1 脂肪酸的提取
根据Folch等[10]的方法进一步调整:称取5 g已均质肉样加入氯仿-甲醇混合液(2∶1,V/V),振摇2 h,浸泡8 h后用G3漏斗过滤,滤液中加入5 mL质量分数20%氯化钠溶液,静止分层,下层的氯仿层即为脂肪提取液。通过无水硫酸钠脱水后,40 ℃旋转蒸发浓缩得到脂肪。然后加入0.5 mol/L的氢氧化钠-甲醇溶液5 mL,70 ℃下回流5 min,进行脂肪皂化,随后加入5 mL的三氟化硼乙醚溶液,70 ℃下回流2 min,进行脂肪甲酯化。最后加入2 mL色谱纯正己烷,70 ℃下回流1 min后,加入5 mL饱和NaCl溶液,静置10 min,吸取出1 mL正己烷层于进样瓶中,用0.22 μm有机滤膜过滤后,进行气相色谱分析。
1.3.4.2 气相色谱-质谱分析
气相色谱条件:反式色谱柱(100 m×0.25 mm,0.20 μm),载气为氦气,载气流速1 mL/min,进样口温度240 ℃,进样量1 μL,分流比100∶1。采用程序升温:初始温度为60 ℃,保持1 min,然后以20 ℃/min的速率升至120 ℃,保持1 min;然后以5 ℃/min的速率升至240 ℃,保持15 min。
质谱条件:离子源温度为300 ℃,传输线温度240 ℃,质量扫描范围m/z 50~500,溶剂延迟时间4 min。
1.4 数据分析
数据用SPSS 19.0统计软件进行单因素方差分析和相关性分析(Pearson系数)。
2 结果与分析
2.1 饲养方式对肠道菌群的影响
通过应用高通量测序技术对两组粪便样品进行测序分析可知,门水平上,肠道菌群以厚壁菌门和拟杆菌门为主,约占94%;从属水平上来说,测序结果中丰度大于1%的主要包括拟杆菌属、Alistipes、纤维杆菌属、Phocaeicola和瘤胃球菌属。
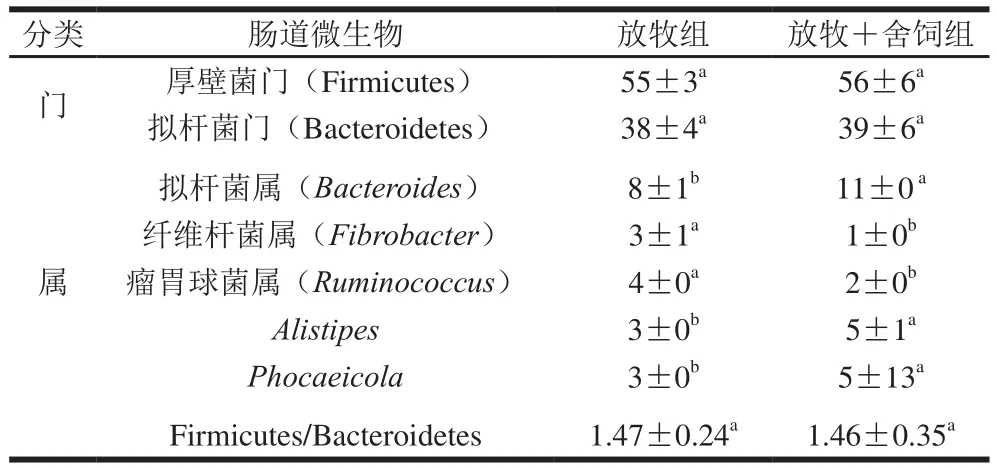
表1 饲养方式对肠道微生物相对丰度的影响Table 1 Effects of two different feeding patterns on the abundance of intestinal flora%
由表1可知,在两种饲养方式下,厚壁菌门和拟杆菌门的丰度没有显著差异(P>0.05)。放牧+舍饲组中拟杆菌属、Alistipes和Phocaeicola的丰度要显著高于放牧组(P<0.05),而纤维杆菌属和瘤胃球菌属的丰度显著低于放牧组(P<0.05)。放牧组中厚壁菌门与拟杆菌门的比值高于放牧+舍饲组,但差异不显著(P>0.05)。Sonia等[7]研究表明相对于瘦的动物或人,肥胖的动物或人的肠道菌群中有较高比例的厚壁菌门,较低比例的拟杆菌门,这与本研究中结果相一致。由于放牧组中拟杆菌属的比例显著低于放牧+舍饲组,并且放牧组的肌内脂肪含量高于放牧+舍饲组,肌内脂肪含量分别为3.33%和2.55%,从而进一步说明了肠道菌群与脂肪沉积有密切关系。
2.2 饲养方式对肠道微生物代谢物的影响

表2 饲养方式对肠道微生物代谢物含量的影响Table 2 Effects of two different feeding patterns on the contents of intestinal short chain fatty acids μg/g
由表2可知,两种饲养方式对肠道微生物代谢物的含量有显著影响。放牧组中乙酸、丁酸和戊酸的含量显著低于放牧+舍饲组(P<0.05),而丙酸和异戊酸的含量显著高于放牧+舍饲组(P<0.05),异丁酸含量在两组间没有显著差异(P>0.05)。
动物饮食通过小肠被吸收或消化,肠道菌群的代谢物主要是短链脂肪酸,主要包括乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸为主。短链脂肪酸作为机体的主要能源物质,为机体的脂肪代谢、蛋白质代谢、碳水化合物代谢等提供能量[11]。肠道微生物代谢物直接影响小肠功能,也可能影响胃、脑、脂肪组织和肌肉组织。有研究表明脂肪组织是肠道微生物代谢物的富集的靶点,进而说明肠道微生物代谢与脂肪沉积有着显著关系[7]。
2.3 饲养方式对血脂指标的影响

表3 饲养方式对血液中血脂指标的影响Table 3 Effects of two different feeding patterns on plasma lipid parameters mmol/L
由表3可知,两种饲养方式对血液中血脂指标有显著的影响。放牧+舍饲组血液中TC和HDL-C的浓度显著高于放牧组(P<0.05),而TG和LDL-C的浓度无显著差异(P>0.05)。
血液中TG反映了机体对脂类的利用情况,TG浓度越低,意味着机体对脂肪的利用率越高。脂类在体内运输发生障碍时,血脂浓度会明显升高。TC浓度对动物肌间脂肪浓度有较大的影响,TC浓度低的个体其肌间脂肪浓度高而肌间胆固醇浓度低[12]。放牧组血液中TC浓度低于放牧+舍饲组,TG浓度高于放牧+舍饲组,进一步说明放牧羊机体代谢对脂肪的利用率比较低,从而其肌内脂肪浓度较高。HDL-C浓度反映了血浆中高密度脂蛋白含量,高密度脂蛋白的主要功能是将肝外组织中过多的胆
固醇转运到肝脏代谢,以防止胆固醇在这些组织中过多地聚集。放牧羊血液中HDL-C的浓度低于放牧+舍饲羊,且脂肪细胞中胆固醇大部分由循环血液中摄取而来,可推测放牧羊肌肉组织和脂肪组织中胆固醇浓度较少。并且也有研究表明HDL-C与机体质量有密切关系[13]。
2.4 饲养方式对肌肉中脂肪酸的影响

表4 饲养方式对苏尼特羊肉中脂肪酸含量的影响Table 4 Effects of two different feeding patterns on fatty acid contents in meat from Sunit sheep%
由表4可知,在两种饲养方式下苏尼特羊背最长肌中脂肪酸主要以棕榈酸、硬脂酸和油酸为主,约占78%,其所占比例依次为油酸>棕榈酸>硬脂酸,这与Atti[14]和Cividini[15]等的研究结果一致。两种饲养方式下,饱和脂肪酸(saturated fatty acids,SFA)和单不饱和脂肪酸(monounsaturated fatty acid,MUFA)含量平均值分别为44.4%和41.9%。放牧组中多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的含量显著高于放牧+舍饲组(P<0.05),约高2.24%。
两种饲养方式下,苏尼特羊背最长肌中SFA主要以棕榈酸和硬脂酸为主,两者分别约占总脂肪酸的22.6%和19.5%,差异不显著(P>0.05)。放牧组中癸酸的含量显著低于放牧+舍饲组(P<0.05),而月桂酸的含量显著高于放牧+舍饲组(P<0.05)。两种饲养方式对肉豆蔻酸含量无显著影响。
苏尼特羊背最长肌中MUFA主要包括棕榈油酸、油酸和反式油酸。由表4可知,两种饲养方式对油酸和棕榈油酸的含量没有显著影响(P>0.05)。放牧组反式油酸的含量显著高于放牧+舍饲组(P<0.05),这与Wachira[16]和Vasta[17]等的研究结果相一致,这可能与牧草中PUFA含量较高有关系。
由表4可知,两种饲养方式对长链脂肪酸的含量有显著影响。放牧组中α-亚麻酸的含量要显著高于放牧+舍饲组(P<0.05)。亚麻酸是长链脂肪酸合成的前体物质,并且具有较为广泛的生物学意义且对人体健康有益[18-19]。有研究表明放牧转变为舍饲后时间长短对亚麻酸含量的影响有显著影响,转变后时间较短组羊肉中亚麻酸的含量要显著高于转变后时间较长组[20]。放牧组中二十碳五烯酸(eicosapntemacnioc acid,EPA)(C20:5)和二十二碳六烯酸(docosahexaenoic acid,DHA)(C22:6)所占总脂肪酸的比例显著高于放牧+舍饲组(P<0.05),分别为1.05%和0.75%、1.27%和0.93%。EPA和DHA是两种功能性长链脂肪酸,具有抗氧化、抗衰老作用,可用于健脑补脑,提高记忆力及思维能力,对记忆力减退、老年性痴呆有一定疗效[21]。两种饲养方式对亚油酸和反式亚油酸的含量没有显著影响(P>0.05),其同分异构体主要包括共轭亚油酸。研究表明共轭亚油酸具有抗动脉粥样硬化、抗肿瘤等重要的生理功能。放牧组中共轭亚油酸的含量显著大于放牧+舍饲组,其原因可能是牧草有利于肌内脂肪中共轭亚油酸的沉积,这与Urrutia等[22]的研究结果一致,表明高含量脂肪物质(亚麻酸和亚油酸)能极显著促进共轭亚油酸在组织中沉积。
放牧组中背最长肌n-3 PUFA的比例显著高于放牧+舍饲组(P<0.05),分别为4.24%和2.63%。两种饲养模式下羊肉的n-6/n-3比例依次分别为2.14和3.87,差异显著(P<0.05)。两种饲养模式的比值都低与欧美等国家推荐的4∶1。营养专家认为合理的n-6/n-3比例有利于降低血压、抑制不规律心脏跳动、维持能量平衡、糖代谢和其他慢性疾病的发生,以及促进正常的生长发育,如何改善饲养模式下羊肉的n-6/n-3比例还需进一步的研究[23]。
2.5 肠道菌群及代谢产物与血脂指标间相关性分析
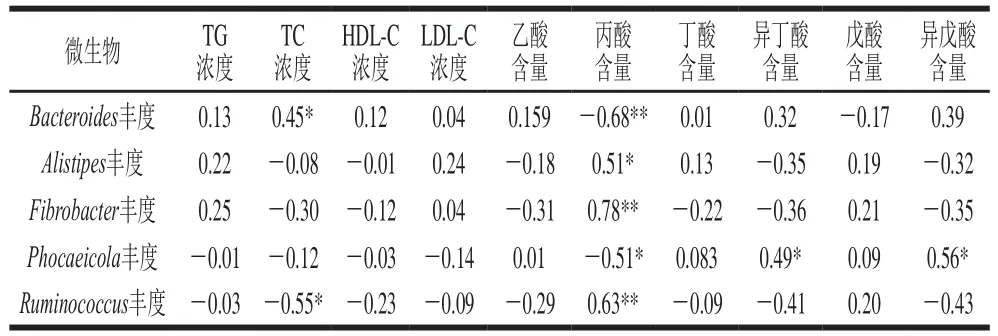
表5 肠道微生物与其代谢物和血脂指标相关性分析Table 5 Correlation coefficients between the abundance of intestinal flora, fecal short chain fatty acids and plasma lipid parameters
由表5可知,通过分析肠道微生物与短链脂肪酸浓度的相关性可知,丙酸浓度与Alistipes丰度(P<0.05)、纤维杆菌属丰度(P<0.01)和瘤胃球菌属丰度(P<0.01)间存在显著正相关;与拟杆菌属丰度(P<0.01)和Phocaeicola丰度(P<0.05)存在显著负相关。可溶性膳食纤维在结肠微生物的作用下可产生短链脂肪酸,主要包括乙酸、丙酸和丁酸。丙酸在碳水化合物和蛋白质代谢过程中扮演着重要的角色,并且有利于维持结肠的正常功能和肠上皮细胞的形态和功能具有重要作用[24]。在本研究中,放牧组中丙酸的含量显著高于放牧+舍饲组,可推测出牧草的多样性有利于丙酸在体内的沉积,也可能有利于羊肉风味物质的形成。本实验还发现Phocaeicola丰度与异丁酸和异戊酸含量呈显著正相关(P<0.05)。
通过分析血液中血脂指标与肠道微生物的关系可知,TC浓度与拟杆菌属丰度之间存在显著正相关(P<0.05),与瘤胃球菌属丰度之间存在显著负相关(P<0.05)。哺乳动物细胞中胆固醇的合成是一个复杂的过程,其以乙酰辅酶A为原料,经过40余个细胞溶质和膜结合酶的催化作用完成。有研究表明肠道中丹毒丝菌科(Erysipelotrichaceae)和毛螺菌科(Lachnospiraceae)细菌的浓度与动脉粥样硬化患者血浆中TC和LDL-C的浓度呈正相关,并通过口服益生菌有利于改善肠道微生物,从而降低血液中TC浓度。其可能存在的潜在机理是由于NPC1L1蛋白是介导哺乳动物小肠对膳食中胆固醇吸收的关键蛋白质,益生菌通过抑制肠道内NPC1L1蛋白的表达,来降低血液中TC和LDL-C的浓度[25-26]。
2.6 长链脂肪酸与肠道菌群及代谢物和血液指标间相关性分析
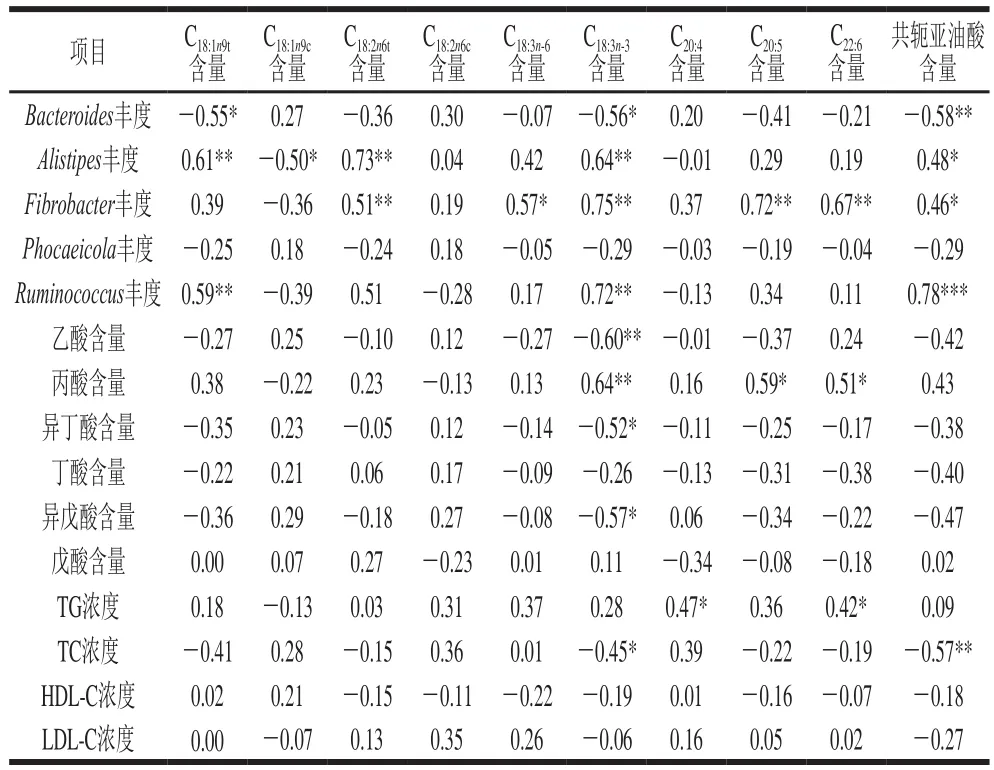
表6 长链脂肪酸与肠道微生物及其代谢物和血脂指标相关性分析Table 6 Correlation coefficients between long chain fatty acids of muscle and the abundance of intestinal flora and plasma lipid parameters
如表6所示,通过分析羊肉中长链脂肪酸和肠道菌群间相关性可知,羊肉中共轭亚油酸与含量纤维杆菌属丰度(P<0.05)、瘤胃球菌属丰度(P<0.001)和Alistipes丰度(P<0.05)间存在显著正相关,与拟杆菌属丰度存在显著负相关(P<0.01)。有研究认为机体内共轭亚油酸主要通过瘤胃微生物丁弧酸菌对亚油酸的生物转换作用生成,也可能是肠道微生物在动物细胞内起脱氢作用产生[27-28]。反式油酸含量与拟杆菌属丰度间存在显著负相关,而与Alistipes丰度存在显著正相关。其原因可能是由于哺乳动物体内无Δ-12-脱氢酶,反式油酸进入机体后,通过瘤胃和肠道微生物异构化作用由油酸生成共轭亚油酸[29]。众所周知,α-亚麻酸是人体必需脂肪酸,是n-3系列PUFA的母体,也是反刍动物瘤胃中脂肪酸代谢主要的氢化底物[30]。羊肉中亚麻酸的含量与纤维杆菌属、瘤胃球菌属和Alistipes丰度间存在极显著正相关(P<0.01),与拟杆菌属丰度间存在显著负相关(P<0.05)。纤维杆菌属丰度与EPA和DPA含量间存在极显著正相关(P<0.01)。通过分析羊肉中长链脂肪酸与肠道微生物代谢物与血液中血脂指标浓度的相互关系可知,亚麻酸含量与乙酸含量、异丁酸含量和异戊酸含量间存在显著负相关(P<0.05),而与丙酸含量呈极显著正相关(P<0.01),还发现EPA和DHA含量与丙酸含量呈现显著正相关(P<0.05)。饮食与肠道微生物代谢物间有密切联系,富含亚麻酸的饮食对动物肠道菌群多样性有显著影响,进而能够促进动物组织中亚麻酸的沉积。血液中TC浓度与肌肉中亚麻酸和共轭亚油酸含量间呈现显著负相关(P<0.05),从而说明高含量亚麻酸和共轭亚油酸的饮食有利于降低血液中TC的浓度,对预防粥样动脉硬化等疾病有重要意义。综上所述,亚麻酸代谢与肠道菌群及其代谢物和血液脂质代谢有密切的联系,如何改善肠道菌群的多样性,进而影响机体内亚麻酸代谢,从而为改善哺乳动物肉和乳中长链脂肪酸的沉积,也是未来课题研究的新方向。
3 结 论
放牧组苏尼特羊中纤维杆菌属和瘤胃球菌属的丰度显著高于放牧+舍饲组,而拟杆菌属、Alistipes和Phocaeicola的丰度显著低于放牧+舍饲组。放牧+舍饲组中乙酸和丁酸的含量显著高于放牧组,而丙酸的含量显著低于放牧组。放牧组中TC和HDL-C浓度要低于放牧+舍饲组,TG和LDL-C的含量无显著影响。两种饲养方式下,脂肪酸主要以棕榈酸,硬脂酸和油酸为主。放牧组中α-亚麻酸、EPA、DHA和共轭亚油酸的含量显著高于放牧+舍饲组,n-3系列的PUFA含量也显著高于放牧+舍饲组。放牧条件下菌群结构更有利于短链脂肪酸的产生,进而有利于PUFA沉积,提高了羊肉营养价值。
丙酸含量与Alistipes、纤维杆菌属和瘤胃球菌属丰度存在显著正相关,与拟杆菌属和Phocaeicola丰度存在显著负相关。胆固醇浓度与拟杆菌属丰度存在显著正相关,与瘤胃球菌属丰度存在显著负相关。苏尼特羊肉中共轭亚油酸和α-亚麻酸含量与肠道微生物丰度存在显著的相关性,与血液中TC浓度存在显著负相关,并且丙酸含量与EPA和DHA含量存在显著正相关。因此,如何改善肠道菌群的多样性,建立肠道菌群与机体亚麻酸代谢的关系,有利于羊肉中长链脂肪酸的沉积,为改善舍饲羊肉风味和营养物质提供一种新的思路。
