基于鱼鳞贮藏方式改善鳙鱼鱼鳞明胶的功能特性
2018-09-26沙小梅涂宗财胡姿姿王振兴
沙小梅,涂宗财,,*,黄 涛,胡姿姿,王 辉,张 露,李 鑫,王振兴
鳙鱼(Hypophthalmichthys nobilis)是一种产自亚洲的淡水鱼,广泛分布于湖泊和河流中。鳙鱼已经被引入欧洲、南美洲和北美洲的70多个国家[1]。在中国,鳙鱼是四大家鱼之一,其他3 种为青鱼(Mylopharyngodon piceus)、鲢鱼(Hypophthalmichthys molitrix)和草鱼(Ctenopharyngodon idella)[2]。据报道,早在2010年,我国鲤科鱼类年产量已达到1 500万 t[3]。据中国渔业统计年鉴,2015年我国鳙鱼养殖产量达到335.944万 t。
鱼鳞是鱼制品加工过程中的主要废弃物之一,其富含胶原蛋白,是一种良好的明胶原料[4]。近些年来,有关鱼鳞明胶的研究渐渐增加,主要集中在鱼鳞预处理[5]、制备过程[6]、明胶改性[7]等。Karim等[8]的报道指出,原料的贮藏方式会对明胶的功能性质产生很大影响。热风干燥作为一种食品保存手段,广泛应用于食品工业。工业上的烘干机通常是采用热风或者直接将燃烧气体作为干燥媒介[9]。太阳晒干是一种传统且低成本的脱水方式,这种利用太阳对物质进行干燥的方式在当代仍被广泛使用[10]。众所周知,一般情况下,低温能有效延长食品的贮藏期,冰箱贮藏就是一个日常生活中用于食物保藏的典型方式。
因此,本实验选取热风干燥、太阳晒干和低温保藏方式处理鱼鳞,研究其对制备的鱼鳞明胶功能性质(凝胶强度、乳化性、起泡性)的影响,探寻能够提高鳙鱼鱼鳞明胶功能性质的原料贮藏方式。此外,采用傅里叶变换红外光谱(Fourier transform infrared spectra,FTIR)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)和扫描电子显微镜(scanning electron microscope,SEM)探究鱼鳞贮藏方式对明胶结构特性的影响。
1 材料与方法
1.1 材料与试剂
鳙鱼鱼鳞为市售。
蛋白分子质量Marker 美国Thermo Scientific公司;KBr(光谱级) 上海晶纯实业有限公司;其他均为分析纯。
1.2 仪器与设备
Nicolet 5700 FTIR仪 美国Thermo公司;环境SEM 德国FEI Deutschland GmbH公司;CT3质构分析仪 美国Brookfield公司;T25分散机 德国IKA公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 鱼鳞的贮藏
将新鲜鱼鳞清洗3 遍以去除杂质,再等分成5 份。第1份鱼鳞直接用于明胶的制备,作为空白组;第2份鱼鳞在约30 ℃下日光晒约48 h,至水分质量分数低于10%,然后在室温(约25 ℃)下贮藏1 个月;第3份鱼鳞置于4 ℃贮藏1 个月;第4份鱼鳞置于-20 ℃贮藏1 个月;第5份鱼鳞在60 ℃烘干至水质量分数低于10%,然后在室温(约25 ℃)下贮藏1 个月。
1.3.2 鱼鳞明胶的提取
5 份鱼鳞分别置于组织捣碎机中捣碎5 min,以去除鱼鳞表面的银白色物质。接下来对鱼鳞进行脱钙处理,脱钙工艺如下:盐酸浓度0.5 mol/L、料液比1∶25(m/V)、脱钙时间1 h。脱钙后,进一步清洗鱼鳞以去除残存的酸液,以用于下一步的鱼鳞明胶提取。基于课题组前期研究[11]并进行适当的修改,确定鱼鳞明胶的制备工艺如下:湿鱼鳞和去离子水1∶3(m/V)、加热温度80 ℃、制备时间2 h。过滤去除鱼鳞残渣,将滤液置于60 ℃的旋转蒸发仪中,将滤液体积蒸发至原体积的1/3。冻干浓缩后的鱼鳞明胶,备用。测定不同方式贮藏鱼鳞后制备得到的明胶组成。结果显示,所有明胶样品都具有高蛋白质量分数(90.87%~92.53%)、低水分质量分数(4.89%~6.43%)和低灰分质量分数(0.39%~0.94%)。
1.3.3 鱼鳞明胶的结构特性测定
SDS-PAGE实验方法[12]如下:质量分数5%浓缩胶和质量分数7.5%分离胶。制备5 mg/mL的鱼鳞明胶样品,在95 ℃加热5 min,再5 000×g离心10 min,取10 μL上清液上样。
FTIR光谱测定方法[13]如下:将干燥的明胶样品和光谱级的KBr粉末混合均匀,并压成片状。鱼鳞明胶的FTIR光谱图采用Nicolet 5700 FTIR仪在波数范围400~4 000 cm-1采集,获得的数据绘制成以吸光度为y轴和以波数为x轴的图谱。
SEM的测定参考Chen Jun等[14]的方法。将10 mg/mL的鱼鳞明胶溶液冻干,置于样品台的导电胶上。采用环境SEM在低真空模式下放大1 000 倍拍摄鱼鳞明胶的微观结构。
1.3.4 鱼鳞明胶的功能性质测定
鱼鳞明胶的凝胶强度测定方法[7]如下:在55 ℃水浴锅中利用去离子水溶解鱼鳞明胶制备成66.7 mg/mL溶液,在10 ℃下冷却16~18 h。采用质构分析仪以直径1.27 cm的平底圆柱形探头测定鱼鳞明胶的凝胶强度,测试速率为1 mm/s。当鱼鳞明胶样品被挤压4 mm时产生的最大受力(g)即为凝胶强度。样品规格:直径33 mm,高度22 mm。
鱼鳞明胶的乳化活性根据Nagarajan等[15]的方法进行适当修改,9 mL鱼鳞明胶溶液(1 mg/mL)和3 mL大豆油混合,在T25分散机中9 500 r/min下分散1 min。立即从烧杯底部取100 μL乳浊液,加入5 mL 1 mg/mL的SDS溶液,混匀10 s后,立即采用紫外-可见分光光度计测定其在波长500 nm处的吸光度(A0),乳化活性的计算见式(1)。
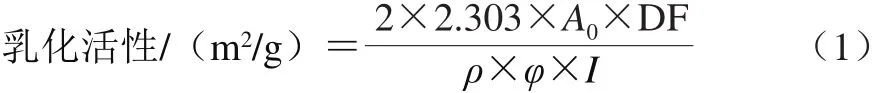
式中:DF表示为稀释系数(50);ρ表示蛋白质量浓度(1 000 g/m3);φ表示油占乳浊液的比例(0.25);I表示比色皿的宽度(0.01 m)。
鱼鳞明胶起泡能力的测定参考Shyni等[16]的方法,并略作修改。运用T25分散机以13 500 r/min分散20 mL 2 mg/mL鱼鳞明胶溶液2 min,再将起泡后的溶液倒入50 mL的量筒中,立即记录总的样品体积。起泡能力按照式(2)进行计算。

1.4 数据分析
所有实验均测定3 次平行,结果取平均值。数据通过SPSS 17.0软件进行分析,选取Duncan’s新复极差法用于显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 鱼鳞明胶的分子质量分析
如图1所示,所有的鱼鳞明胶样品均含有特征性的α链(α1和α2)、β链(两条α链共价交联形成)和高分子质量聚合物(high molecule weight polymer,HMWP)。相比新鲜鱼鳞和60 ℃热风干燥鱼鳞制备得到的明胶,太阳晒干和低温方式(4 ℃和-20 ℃)贮藏的鱼鳞制备得到的明胶具有更多的α链、β链和HMWP。在所有的鱼鳞明胶样品中,新鲜鱼鳞和60 ℃热风干燥鱼鳞制备得到的明胶具有更多分子质量低于100 Da的多肽。这些结果与Liu Haiying等[17]的报道一致,其研究结果表明,相比于25 ℃热风干燥鱼鳞和-18 ℃低温贮藏鱼鳞制备的明胶,新鲜鱼鳞制备的明胶含有较少的α链、β链和HMWP。干燥会引起蛋白质结构的改变,如脱水和变性[18]。脱水可能会促进蛋白质间的相互作用,并诱导蛋白质发生聚集,从而影响明胶的形成[19]。因此,太阳晒干后的鱼鳞制备得到的明胶具有更多的α链、β链和HMWP。同样的,鱼鳞在低温条件下(4 ℃、-20 ℃)因水分蒸发而引起脱水,因此制备得到的明胶含有较多的高分子质量成分。值得说明的是,蛋白质在较高干燥温度下可能会发生变性,而变性会促使蛋白质丢失其特有的结构特征,包括氢键和常用于维持蛋白质分子稳定的二级结构。60 ℃热风干燥可能引发鱼鳞胶原蛋白发生变性,进而使得制备的明胶具有更少的α链、β链和HMWP。
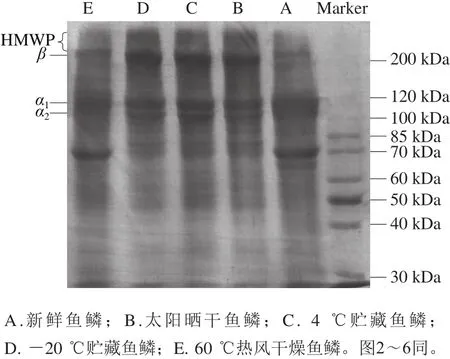
图1 鱼鳞经不同方式贮藏后制备的明胶电泳图Fig. 1 SDS-PAGE profile of fish gelatin extracted from bighead scales under various conditions
2.2 鱼鳞明胶的FTIR分析
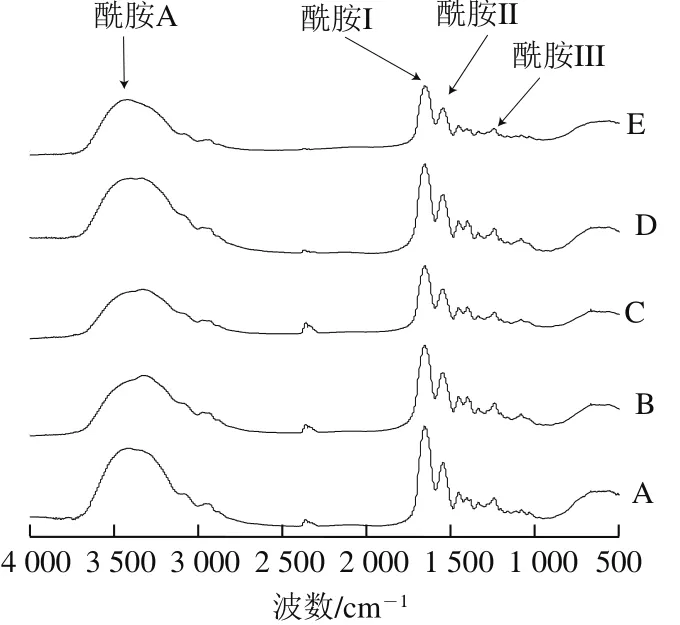
图2 鱼鳞经不同方式贮藏后制备的明胶FTIR图Fig. 2 FTIR spectra of fish gelatin extracted from bighead scales under various storage conditions
由图2可知,所有的鱼鳞明胶样品都含有4 个类似的酰胺带吸收峰:酰胺A带(3 440~3 300 cm-1)、酰胺I带(1 600~1 700 cm-1)、酰胺II带(1 560~1 540 cm-1)、酰胺III带(1 250~1 230 cm-1),表明所有贮藏鱼鳞的方式都不会破坏明胶的功能性基团。新鲜、太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥的鱼鳞制备的明胶酰胺A带吸收峰波数分别为3 401.98、3 336.91、3 332.67、3 337.29 cm-1和3 400.41 cm-1。酰胺A带吸收峰是由N—H伸缩振动引起的。一般而言,单独的N—H伸缩振动引起的酰胺A带吸收峰的波数在3 400~3 440 cm-1范围内。当N—H基团涉及氢键,酰胺A带吸收峰将向低波数移动。氢键越强,酰胺A带吸收峰将向更低波数移动[12]。在所有样品中,经4 ℃贮藏的鱼鳞制备的明胶显示了最低波数的酰胺A带吸收峰,表明含有更强的氢键。新鲜和60 ℃热风干燥的鱼鳞制备的明胶显示了最高波数的酰胺A带吸收峰,表明含有最弱的氢键。类似于SDS-PAGE结果分析,脱水可能是增强氢键、促进蛋白质间相互作用的重要原因。
新鲜、太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥的鱼鳞制备的明胶酰胺I带吸收峰波数分别为1 658.06、1 658.25、1 654.84、1 654.83 cm-1和1 653.54 cm-1,这与Bhat等[20]报道的商业鱼明胶结果(~1 655 cm-1)类似。酰胺I带代表C=O伸缩振动/COO缔合氢键的情况[15],它可能是FTIR中分析蛋白质二级结构的最有力工具。新鲜、太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥的鱼鳞制备的明胶酰胺II带吸收峰波数分别为1 549.45、1 550.40、1 549.23 cm-1和1 549.98 cm-1。酰胺II带是由N—H基团弯曲振动和C≡N基团伸缩振动引起[15]。一般认为,相比于二级结构改变,水合作用更易引起酰胺II带变化。新鲜、太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥的鱼鳞制备的明胶酰胺III带吸收峰波数分别为1 242.76、1 240.45、1 241.12、1 240.90 cm-1和1 241.04 cm-1。酰胺III带由多种因素产生,包括C≡N基团伸缩振动、酰胺键引起的N—H基团变形、甘氨酸和脯氨酸的—CH2基团的非平面摇摆振动[23]。
2.3 鱼鳞明胶的微观结构分析
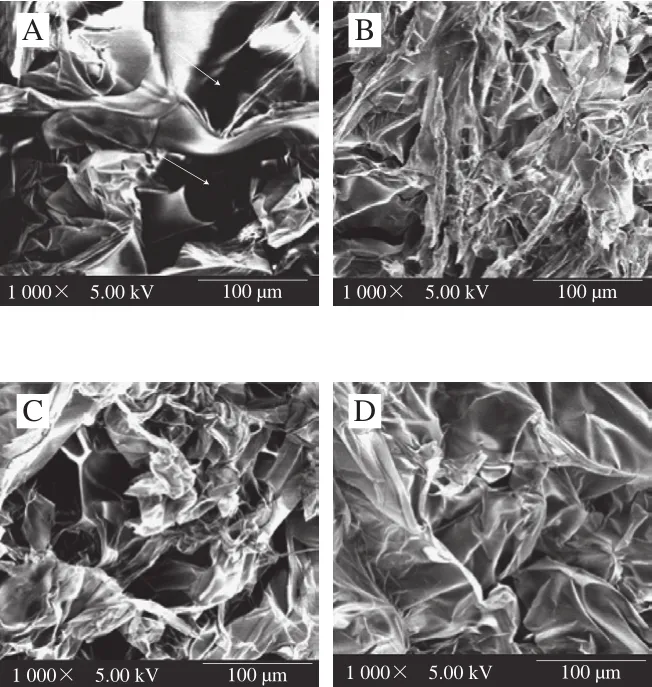

图3 鱼鳞经不同方式贮藏后制备的明胶微观结构图(×1 000)Fig. 3 SEM micrographs of fish gelatin extracted from bighead scales under various storage conditions (× 1 000)
由图3可知,不同方式贮藏鱼鳞会导致明胶具有不同的微观结构。新鲜和60 ℃热风干燥的鱼鳞制备得到的明胶微观结构呈现出较大孔洞。太阳晒干、4 ℃和-20 ℃贮藏的鱼鳞制备得到的明胶具有致密的网络结构外观。明胶的微观结构受其组分影响,高含量的α链有利于明胶凝胶的形成[15],β链和HMWP也能促进凝胶网络形成,然而低分子质量的明胶碎片将起到相反的影响[24]。因此,相比于新鲜和60 ℃热风干燥鱼鳞制备的明胶,太阳晒干、4 ℃贮藏和-20 ℃贮藏鱼鳞制备的明胶含有更多的α链、β链和HMWP,继而呈现了更好的凝胶状态,即更致密的网络微观结构。
2.4 鱼鳞明胶的凝胶强度分析
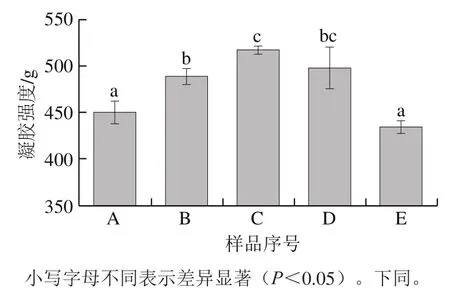
图4 鱼鳞经不同方式贮藏后制备的明胶凝胶强度Fig. 4 Gel strength of fish gelatin extracted from bighead scales under various storage conditions
凝胶强度是一项重要的凝胶性能表征指标,本实验测定了不同方式贮藏鱼鳞后制备得到的明胶凝胶强度,如图4所示。新鲜、太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥的鱼鳞制备的明胶凝胶强度分别为(450.33±12.12)、(488.86±8.40)、(516.91±4.50)、(497.65±22.44)g和(434.25 ±7.01)g。相比于新鲜和60 ℃热风干燥方式,太阳晒干和低温(4 ℃和-20 ℃)贮藏鱼鳞使得明胶具有更强的凝胶强度(P<0.05)。值得特别指出的是,鱼鳞经过4 ℃贮藏1 个月,制备得到的明胶凝胶强度比新鲜鱼鳞制备的明胶凝胶强度高出66.58 g。在4 ℃的保藏温度下,鱼鳞脱水可能会促进其蛋白质间的相互作用,进而增强其凝胶强度。此外,4 ℃贮藏能较好地防止鱼鳞胶原蛋白变性,提高鱼鳞明胶的品质。在许多情况下,高凝胶强度的明胶是应用过程中所需要的。例如,高Bloom值的A型明胶特别适用于生产低脂黄油或人造奶油[8]。因此,将鱼鳞贮藏在4 ℃,可能是一种简单而有前景的改善明胶凝胶强度的方法。
凝胶强度与多种结构特征有关,其中,包括分子质量分布[15]、氢键[20]和微观结构[25]。结合图4的凝胶强度和图1的SDS-PAGE结果可知,α链、β链和HMWP是增强鱼鳞明胶凝胶强度的重要组分,此外,减少低分子质量的组分含量也将提升鱼鳞明胶的凝胶强度。以前的许多研究报道也得到了一致的结果,例如,含有更多α链的明胶呈现了更好的功能特性,包括凝胶强度[15,26];Kaewruang等[27]的研究结果表明α链和β链会影响凝胶强度,增加这两个组分的含量将增强明胶结构的稳定性;HMWP与明胶的凝胶强度有着高度的正相关性[28];降解的明胶片段与低凝胶强度相关[29]。
由图2、4可知,4 ℃贮藏的鱼鳞制备的明胶具有最强的凝胶强度和最强的氢键(基于FTIR中酰胺A带的最低波数);太阳晒干和-20 ℃贮藏的鱼鳞制备的明胶具有中等强度的凝胶强度和氢键;新鲜和60 ℃热风干燥的鱼鳞制备的明胶具有最低的凝胶强度和最弱的氢键(基于FTIR中酰胺A带的最高波数)。上述结果表明,凝胶强度可能和氢键强度有关。不同方式贮藏鱼鳞可能会导致明胶具有不同的氢键强度,进而影响其凝胶强度。
低凝胶强度的鱼鳞明胶(新鲜和60 ℃热风干燥鱼鳞制备得到的明胶)有着松散的网络结构,这说明鱼鳞明胶的微观结构可能在一定程度上反映其凝胶强度。伴随着致密的网络结构,鱼鳞明胶有更好的能力以抵制外部破坏力,因此显示出高的凝胶强度。Wangtueai等[30]通过比较狗母鱼鱼鳞明胶的微观结构发现,狗母鱼鱼鳞明胶的微观结构可能和凝胶强度相关。Benjakul等[31]指出凝胶物质中蛋白质分子的排列和连接直接影响黄笛鲷鱼皮明胶的凝胶强度。Jongjareonrak等[32]研究表明,谷氨酰胺转胺酶处理的明胶具有更高的凝胶强度和更致密的凝胶网络结构。
2.5 鱼鳞明胶的界面性质分析
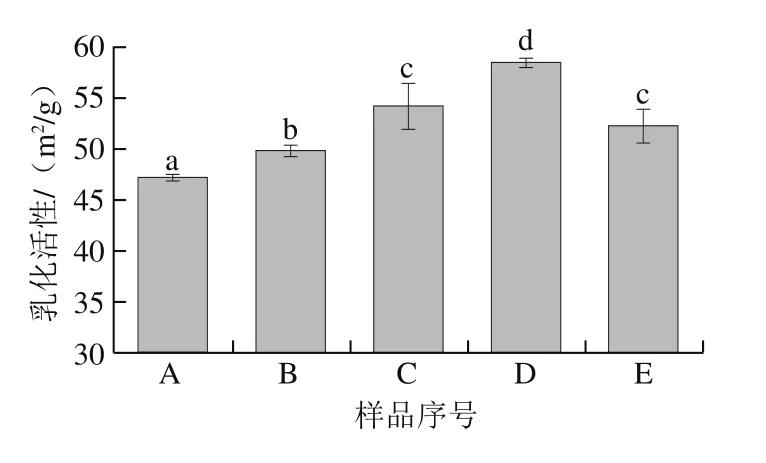
图5 鱼鳞经不同方式贮藏后制备的明胶乳化活性Fig. 5 Emulsifying activity of fish gelatin extracted from bighead scales under various storage conditions
如图5所示,各种鱼鳞贮藏方式显著改善了明胶的乳化活性,新鲜、太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥的鱼鳞制备的明胶乳化活性分别为47.26、49.87、54.26、58.56 m2/g和52.29 m2/g。在上述所有的鱼鳞贮藏方式中,-20 ℃贮藏是最有效的改善明胶乳化活性的手段。
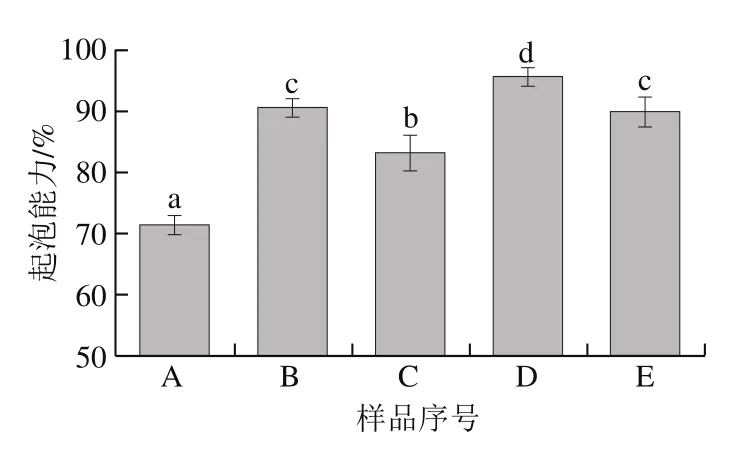
图6 鱼鳞经不同方式贮藏后制备的明胶起泡能力Fig. 6 Foaming ability of fish gelatin extracted from bighead scales under various storage conditions
图6 为不同方式贮藏后的鱼鳞制备的明胶起泡能力,太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥的鱼鳞制备的明胶起泡能力分别为90.83%、83.33%、95.83%和90.00%,显著高于新鲜鱼鳞制备的明胶起泡能力(71.67%)。其中,-20 ℃贮藏鱼鳞的方式提升明胶起泡能力的幅度达到33.71%。
最低的鱼鳞贮藏温度(-20 ℃)能显著提高明胶的乳化活性和起泡能力,这也许归因于冰冻贮藏过程中表面疏水性的改变。在长期的冰冻贮藏过程中,蛋白质会经历构象的改变,暴露蛋白质的部分疏水性区域[33]。Wang Pei等[21]也指出冰冻能使更多的谷蛋白疏水性基团暴露。表面疏水性是改变蛋白质乳化特性和起泡特性的重要因素。表面疏水性影响蛋白质吸附到油-水界面层的能力,此时,更强的吸附特性将显示更高的乳化能力[34]。疏水性对蛋白质起泡性发挥作用的原因可能部分源于其快速吸附到空气-水界面,也可能与疏水性蛋白质间的相互作用有关[35-36]。Moro等[37]的研究结果亦表明,增加表面疏水性可能是改善起泡能力的决定性因素。
3 结 论
太阳晒干后室温贮藏、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥后室温贮藏均不会破坏明胶的特征性结构(所有的鱼鳞明胶样品都含有α链、β链和HMWP,且具有4 个类似的酰胺带吸收峰:酰胺A带、酰胺I带、酰胺II带和酰胺III带)。相比新鲜鱼鳞和60 ℃热风干燥鱼鳞制备得到的明胶,太阳晒干和低温方式(4 ℃和-20 ℃)贮藏的鱼鳞制备得到的明胶结构特征如下:含有更多的α链、β链和HMWP;酰胺A带吸收峰的波数较低,表明包含更强的氢键;呈现更致密的网络结构外观。这些结构特征的变化可能是导致太阳晒干和低温(4 ℃和-20 ℃)贮藏鱼鳞制备得到的明胶呈现更强凝胶强度的主要原因。太阳晒干、4 ℃贮藏、-20 ℃贮藏和60 ℃热风干燥鱼鳞均能提升明胶的乳化活性和起泡能力,其中,-20 ℃贮藏鱼鳞1 个月对改善明胶乳化活性和起泡能力的效果最佳。
