干燥方式对白三叶多糖理化性质和抗氧化活性的影响
2018-09-26段梦颖尚红梅杨君研
李 然,段梦颖,尚红梅*,杨君研
白三叶(Trifolium repens L.)别名白车轴草、荷兰翘摇等,是豆科三叶草属多年生草本植物,原产于欧洲和小亚细亚,16世纪在荷兰首先栽培[1]。我国自20世纪20年代引种以来,全国各省区均有栽培。白三叶茎叶细软、叶量丰富,粗蛋白含量高、纤维含量低,是一种优良牧草,可作为饲料或加工调制后利用。
多糖是一类由10 个以上单糖通过糖苷键连接所组成的高分子化合物,广泛存在于微生物、植物和动物中[2]。多糖具有抗氧化、抗肿瘤、免疫调节等多种生物活性,被广泛应用于食品业和医药业[3]。目前,糖生物学的时代正在加速到来,21世纪会是多糖生命科学蓬勃发展的黄金时期[4]。欧阳克蕙等[5]采取热水浸提法提取白三叶草多糖并优化多糖提取条件,但目前尚鲜见关于白三叶多糖干燥方式的研究报道。干燥是多糖加工的重要工艺,对多糖的理化性质和生物活性有显著影响[6]。本实验通过研究干燥方式(热风干燥、真空干燥和冷冻干燥)对白三叶多糖理化性质和抗氧化活性影响,以期找到一种有利于保持白三叶多糖抗氧化活性的干燥方法,为白三叶的加工利用提供理论依据。
1 材料与方法
1.1 材料与试剂
白三叶开花期,取其地上部分,留茬5 cm,于吉林农业大学采收。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 东京化成工业株式会社;2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2’-azino-bis(3-ehtylbenzothiazoline-6-sulfonic acid),ABTS) 北京博奥拓达科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
HX-J漩涡混合器 常州朗越仪器制造有限公司;752紫外-可见分光光度计 上海现科分光仪器有限公司;101-2-BS电热恒温鼓风干燥箱、XMTD-204数显式电热恒温水浴锅 上海跃进医疗器械有限公司;SCIENTZ-12N真空冷冻干燥机 宁波新芝生物科技股份有限公司;2XZ-2旋片式真空泵 临海市谭氏真空设备有限公司;JJ-5控温电动搅拌器 金坛市医疗仪器厂;DZF真空干燥箱 上海龙跃仪器设备有限公司;NDJ-8S黏度计 上海绩泰电子科技有限公司。
1.3 方法
1.3.1 白三叶多糖提取
将新鲜白三叶放入电热恒温鼓风干燥箱50 ℃下烘干,粉碎后过0.45 mm筛,得白三叶粉末。用体积分数95%乙醇溶液预处理(40 ℃)24 h,以除去单糖、色素和脂类等分子[7],抽滤、干燥后得到多糖提取原料。称取25 g预处理的白三叶粉末,加入500 mL去离子水提取白三叶多糖,浸提温度90 ℃,浸提时间3 h。将提取液用6 层纱布过滤,收集滤液离心(3 000 r/min、10 min),合并上清液,60 ℃条件下减压浓缩至原体积的1/4,加入3 倍体积无水乙醇醇沉12 h,离心(3 000 r/min、10 min),将沉淀用去离子水溶解,用Sevag试剂(V(氯仿)∶V(正丁醇)=4∶1)除蛋白,透析(截留分子质量 1 400 Da,联合碳化),得白三叶多糖。
1.3.2 白三叶多糖干燥
将白三叶多糖溶液平铺于直径为10 cm的玻璃培养皿中,厚度2 mm,采用3 种干燥方式(热风干燥、冷冻干燥、真空干燥)进行干燥至恒质量。热风干燥在电热恒温鼓风干燥箱(50 ℃)中干燥4.5 h;冷冻干燥时,先将多糖溶液在真空冷冻干燥机内预冻30~60 min,然后进行干燥,干燥时间7 h;真空冷冻干燥冷阱温度为-66 ℃,真空度为0.19 Pa。真空干燥在真空干燥箱(50 ℃,0.09 MPa)中干燥3.5 h。干燥后按式(1)计算多糖得率。

1.3.3 多糖化学组成测定
总糖质量分数测定采用苯酚硫酸法[8];可溶性蛋白质量分数测定采用考马斯亮蓝G250染色法[9];氨基糖质量分数测定采用Elson-Morgan法[10];糖醛酸质量分数测定采用硫酸-间羟联苯法[11];硫酸基质量分数测定采用氯化钡-明胶比浊法[12];水分质量分数的测定采用恒质量法[13]。各组分以占干质量的百分比计算。
1.3.4 pH值和相对黏度测定
配制2 mg/mL多糖水溶液(25 ℃),用pH计读取5 min内的稳定数值,即为白三叶多糖的pH值[14]。配制10 mg/mL的白三叶多糖水溶液,在温度为25 ℃下测定黏度,同时测定去离子水黏度,计算相对黏度[15]。
1.3.5 溶解度的测定
取0.1 g白三叶多糖置于150 mL烧杯中,加入50 mL的蒸馏水。然后在不同温度(20、40、60、80 ℃和100 ℃)下水浴溶解,用磁力搅拌器搅拌(150 r/min),开始计时,直至完全溶解,记录溶解消耗时间[6]。
1.3.6 紫外光谱特征
配制白三叶多糖溶液(1 mg/mL),以蒸馏水为空白,采用紫外-可见分光光度计在波长200~400 nm范围内测定吸光度,每间隔10 nm测定1次,绘制白三叶多糖紫外光谱特征曲线,分析白三叶多糖中是否含有蛋白质和核酸[16]。
1.3.7 刚果红实验
称取5 mg多糖样品,加入2 mL蒸馏水和2 mL的刚果红试剂(80 μg/mL),逐渐加入1 mol/L的NaOH溶液,使溶液中NaOH终浓度由0 mol/L逐渐升高到0.5 mol/L,并用紫外分光光度计进行扫描,测得各NaOH浓度条件下的最大吸收波长。不加多糖样品,按相同方法测定各NaOH浓度条件下的最大吸收波长,作为空白对照。以NaOH浓度为横坐标,最大吸收波长为纵坐标作图。通过是否存在吸收峰判断白三叶多糖糖链是否具有三股螺旋结构[17]。
1.3.8 不同干燥方式多糖抗氧化活性测定
1.3.8.1 DPPH自由基清除活力测定
于1 mL 0.10 mmol/L DPPH溶液(用无水乙醇现用现配)中分别加入3 mL系列质量浓度(0.025、0.050、0.100、0.200、0.400、0.600 mg/mL)的白三叶多糖溶液,混匀。室温下在暗处反应30 min。用无水乙醇作空白调零,在517 nm波长处测定吸光度,以VC作阳性对照。以白三叶多糖浓度为横坐标,DPPH自由基清除活力为纵坐标作图[18]。DPPH自由基清除活力按式(2)进行计算。
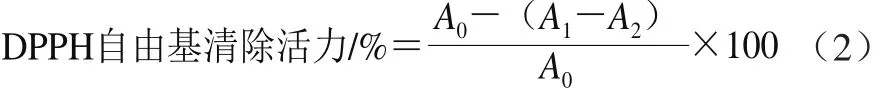
式中:A0表示用蒸馏水代替多糖样品按上述步骤测定的吸光度;A1表示按上述步骤测定多糖样品的吸光度;A2表示用无水乙醇代替DPPH溶液按上述步骤测定的吸光度。
1.3.8.2 ABTS+·清除活力测定
ABTS工作液的配制:将5 mL 7 mmol/L ABTS溶液和1 mL 15 mmol/L过硫酸钾溶液混合,在室温、避光条件下反应12 h,得到ABTS储备液。使用时用蒸馏水稀释成工作液,使其在室温下、734 nm波长处的吸光度为0.70±0.02。
3 mL ABTS工作液与0.75 mL不同质量浓度(0.050、0.125、0.250、0.500、0.750、1.000、1.250 mg/mL)的多糖溶液混合,室温反应15 min。用蒸馏水作空白调0,在734 nm波长处测定吸光度,以VC作阳性对照。以白三叶多糖浓度为横坐标,ABTS+·清除活力为纵坐标作图[19]。ABTS+·清除活力按式(3)进行计算。
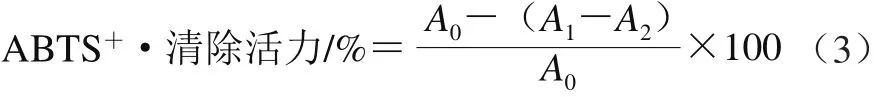
式中:A0表示用蒸馏水代替多糖样品按上述步骤测定的吸光度;A1表示按上述步骤测定多糖样品的吸光度;A2表示用蒸馏水代替ABTS溶液按上述步骤测定的吸光度。
1.3.8.3 还原力测定
于1.5 mL系列质量浓度(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL)多糖溶液中分别加入1.5 mL磷酸盐缓冲液(0.2 mol/L、pH 6.6)和1.5 mL 10 g/L铁氰化钾溶液,混合物在50 ℃条件下水浴20 min。冷却后加入1.5 mL 100 g/L三氯乙酸溶液,混合,然后取该混合物1.5 mL,加入1.5 mL去离子水和0.3 mL 1 g/L氯化铁溶液,室温下反应10 min后,在700 nm波长处测定吸光度,以蒸馏水为空白调零[20]。VC作阳性对照,按式(4)计算还原力。

式中:A1为按上述步骤测定多糖样品的吸光度;A2为用蒸馏水代替氯化铁溶液按上述步骤测定的吸光度。
1.4 数据统计与分析
多糖提取和干燥实验设4 个重复(n=4),计算多糖提取率,其他指标测定重复3 次(n=3)。采用SPSS 22.0统计软件进行数据方差分析,用Duncan法进行多重比较。多糖质量浓度对抗氧化活性指标的影响用Regression-Curve Estimation程序进行回归分析。数据以平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 干燥方式对白三叶多糖理化性质的影响
2.1.1 干燥方式对白三叶多糖化学成分的影响
不同干燥方式对白三叶多糖理化性质的影响见表1。冷冻干燥多糖的得率(10.92%)显著高于热风干燥(9.06%)和真空干燥(9.63%)(P<0.05)。多糖的生物活性受其化学组成的影响[14],因此有必要测定不同干燥方式所获得白三叶多糖的化学组成。干燥方式对白三叶多糖蛋白质、氨基糖和水分质量分数无显著影响(P>0.05)。干燥方式对白三叶多糖的总糖质量分数、硫酸基质量分数和糖醛酸质量分数有显著影响(P<0.05),总糖和糖醛酸质量分数由高到低的干燥产品顺序依次为:冷冻干燥>真空干燥>热风干燥,可能原因是热风干燥和真空干燥过程中较高温度条件(50 ℃)导致糖醛酸等化学成分的变性,而冷冻干燥较低的温度条件利于多糖活性成分的保存[21]。干燥方式对白三叶多糖pH值和相对黏度无显著影响(P>0.05)。由以上分析可知,冷冻干燥法是保存白三叶多糖中活性成分(如总糖、糖醛酸和硫酸基)的较有效手段。
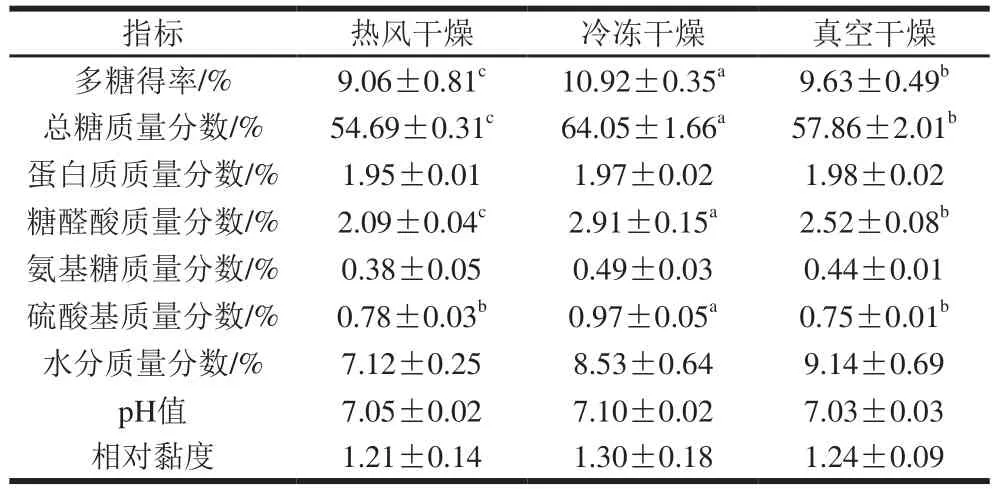
表1 干燥方式对白三叶多糖化学组成、pH值和相对黏度的影响Table 1 Effects of drying methods on chemical composition, pH and relative viscosity of polysaccharides from Trifolium repens L.
2.1.2 干燥方式对白三叶多糖溶解度的影响
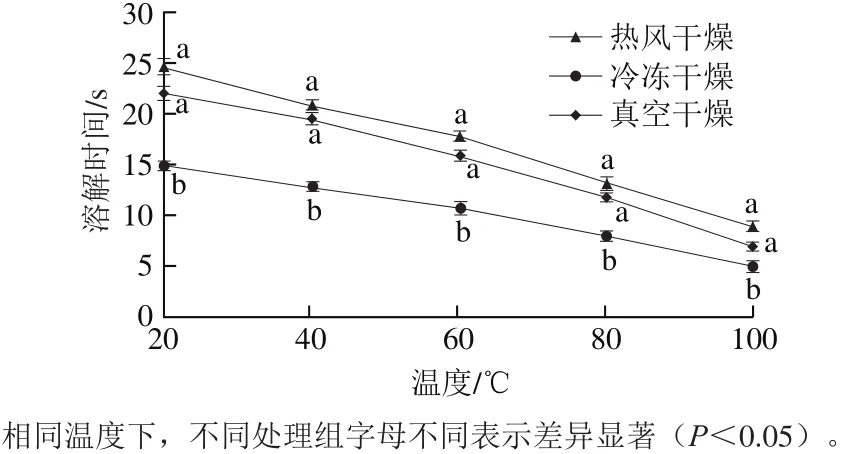
图1 干燥方式对白三叶多糖溶解度的影响Fig. 1 Effects of drying methods on solubility of polysaccharides from Trifolium repens L.
由图1可知,干燥方式对白三叶多糖溶解度有显著影响(P<0.05)。溶解时间随着温度的升高逐渐缩短。在20~100 ℃下,冷冻干燥多糖的溶解时间显著短于热风干燥多糖和真空干燥多糖(P<0.05),可能原因是冷冻干燥多糖结构疏松,更容易溶解。
2.1.3 干燥方式对白三叶多糖紫外光谱的影响
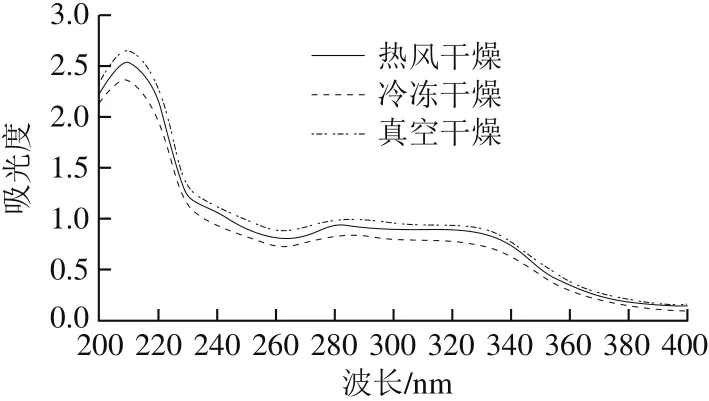
图2 干燥方式对白三叶多糖紫外光谱的影响Fig. 2 Effects of drying methods on UV spectrum of polysaccharides from Trifolium repens L.
由图2可以看出,3 种干燥方式多糖的紫外光谱相似。在280 nm波长处的吸收峰归因于蛋白质吸收,表明这3 种多糖含有少量的蛋白质或多肽。
2.1.4 白三叶多糖刚果红实验结果
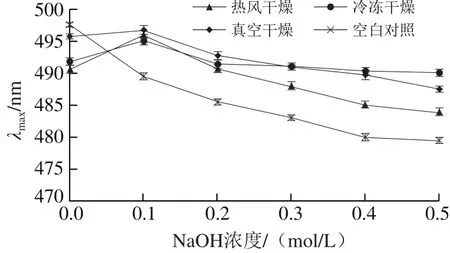
图3 不同NaOH浓度刚果红-白三叶多糖络合物紫外光谱最大吸收波长Fig. 3 UV spectrum maximum absorption wavelength of Congo red-polysaccharides from Trifolium repens L. at various NaOH concentrations
在碱性条件下,与刚果红空白对照相比,具有三股螺旋结构的多糖与刚果红形成的络合物,溶液最大吸收波长会发生变化,而如果待测多糖不具有三股螺旋结构,其形成的络合物将会与空白对照溶液最大吸收波变化趋势相近[22]。如图3所示,在NaOH浓度为0.0~0.1 mol/L时,3 种干燥方式所得多糖样品的光吸收移向长波,表明样品能与刚果红形成络合物,样品有三股螺旋结构;NaOH浓度继续增大时,最大吸收波长下降,表明多糖螺旋结构解体,变成无规则的线团形式,即样品在弱碱性范围内可形成有序的三股螺旋结构,在强碱性条件下,分子间氢键破坏,三股螺旋结构解体为单股,不能与刚果红形成络合物。在植物多糖中,具有三股螺旋型的多糖具有较高的生物活性。X射线衍射实验表明,香菇多糖具有三股螺旋结构,并表现出抗癌活性;由于二甲基亚砜和尿素能够改变香菇多糖的空间结构,在加入上述任意一种物质后香菇多糖空间结构发生改变,随之香菇多糖的抗癌活性也消失[23]。
2.2 干燥方式对白三叶多糖抗氧化活性的影响
2.2.1 DPPH自由基清除活力
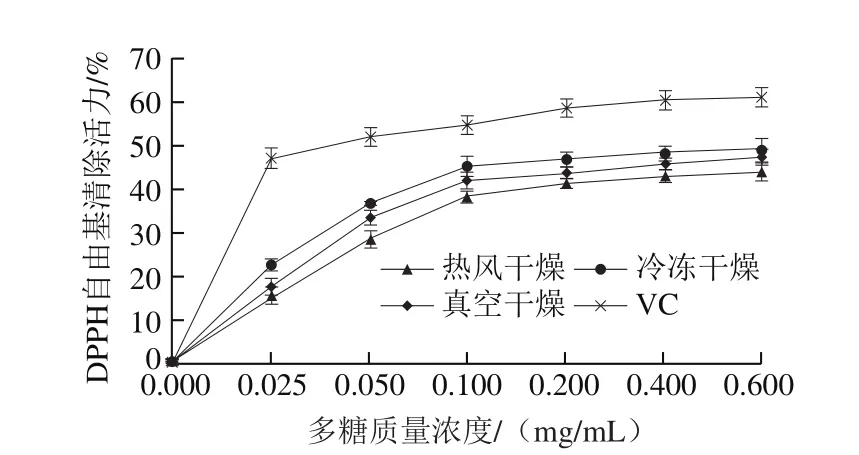
图4 干燥方式对白三叶多糖DPPH自由基清除活力的影响Fig. 4 Effects of drying methods on DPPH radical scavenging activity of polysaccharides from Trifolium repens L.
由于实验操作的简便性和稳定性,DPPH自由基清除活力被广泛应用于测定样品的抗氧化能力[17]。如图4所示,Regression-Curve Estimation结果表明,随着多糖质量浓度的增加,热风干燥多糖(R2=0.943,P<0.05)、冷冻干燥多糖(R2=0.897,P<0.05)和真空干燥多糖(R2=0.912,P<0.05)的DPPH自由基清除活力均增加。冷冻干燥多糖的DPPH自由基清除活力显著高于热风干燥多糖和真空干燥多糖(P<0.05),可能是不同干燥方式导致多糖有效成分(总糖、糖醛酸和硫酸基等)含量产生差异所致,据报道多糖的糖醛酸含量与其自由基清除活力显著正相关[24],而本实验研究结果发现,冷冻干燥多糖的糖醛酸质量分数显著高于热风干燥多糖和真空干燥多糖(P<0.05);因此,冷冻干燥多糖的DPPH自由基清除活力较高。3 种干燥方式多糖的DPPH自由基清除活力均显著低于VC(P<0.05)。据报道,在多糖质量浓度为1.0 mg/mL时,真空干燥、热风干燥和冷冻干燥法获得桦褐孔菌多糖的DPPH自由基清除活力大约为40%[25],灵芝多糖的DPPH自由基清除活力范围为20%~40%[26]。本实验中,在多糖质量浓度为0.6 mg/mL时,白三叶多糖(冷冻干燥多糖)的DPPH自由基清除活力达到49.66%,说明白三叶多糖具有较强的DPPH自由基清除活力。
2.2.2 ABTS+·清除活力
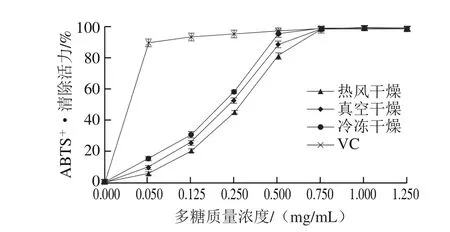
图5 干燥方式对白三叶多糖ABTS+·清除活力的影响Fig. 5 Effects of drying methods on ABTS+· activity of polysaccharides from Trifolium repens L.
ABTS+·清除活力测定方法操作简单快速,被广泛应用于样品的抗氧化活性评估[19]。该方法是基于抗氧化剂可提供电子或氢原子灭活自由基,导致ABTS溶液颜色发生变化,再通过分光光度计进行测定的一种方法[27]。3 种干燥方式多糖的ABTS+·清除活力如图5所示。Regression-Curve Estimation结果表明,随着多糖质量浓度的增加,热风干燥多糖(R2=0.996,P<0.05)、冷冻干燥多糖(R2=0.981,P<0.05)和真空干燥多糖(R2=0.991,P<0.05)的ABTS+·清除活力均与多糖质量浓度呈二次曲线关系。当质量浓度为0.050~0.750 mg/mL时,冷冻干燥多糖的ABTS+·清除活力显著高于热风干燥多糖和真空干燥多糖(P<0.05),半抑制浓度(half maximal inhibitory concentration,IC50)由低到高的顺序为:冷冻干燥多糖(0.203 mg/mL)<真空干燥多糖(0.234 mg/mL)<热风干燥多糖(0.281 mg/mL);说明冷冻干燥多糖的ABTS+·清除活力最高,热风干燥多糖的ABTS+·清除活力最低。据报道,羟基在多糖ABTS+·的清除活力中起重要作用[14];但是,在有氧条件下,羟基很容易发生氧化反应,热风干燥过程中多糖暴露在有氧条件下,因此,热风干燥多糖的ABTS+·清除活力较低。当质量浓度达到0.75 mg/mL后,3 种干燥方式所得多糖的ABTS+·清除活力达到VC水平;在质量浓度为1.25 mg/mL时,白三叶多糖(冷冻干燥多糖)的ABTS+·清除活力达到最大(99.74%);据报道,亚侧耳冷冻干燥多糖(4 mg/mL)的ABTS+·清除活力大约为30%[13],芜菁多糖(2 mg/mL)的ABTS+·清除活力大约为23%[28],以上几点说明白三叶多糖具有较强的ABTS+·清除活力。
2.2.3 还原力
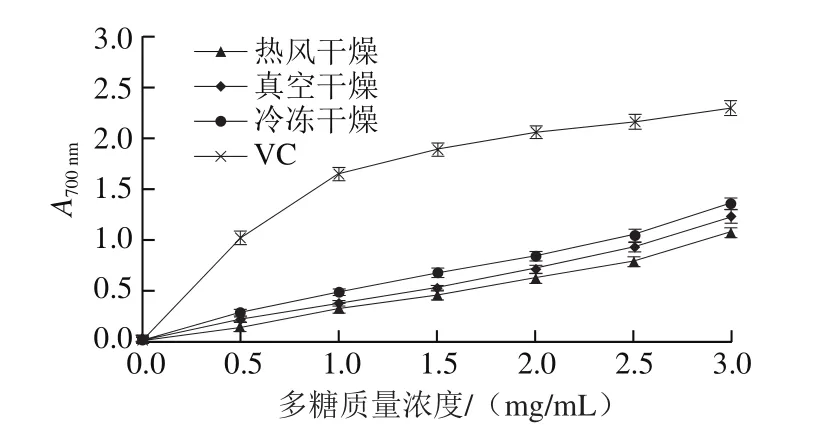
图6 干燥方式对白三叶多糖还原力的影响Fig. 6 Effects of drying methods on reducing power of polysaccharides from Trifolium repens L.
还原力是评价天然产物抗氧化能力的重要指标[20]。3 种干燥方式多糖的还原力如图6所示,Regression-Curve Estimation结果表明,随着多糖质量浓度的增加,热风干燥多糖(R2=0.987,P<0.05)、冷冻干燥多糖(R2=0.992,P<0.05)、真空干燥多糖(R2=0.988,P<0.05)和VC(R2=0.819,P<0.05)的还原力均呈线性升高。在实验质量浓度范围(0.5~3.0 mg/mL)内,冷冻干燥多糖的还原力显著高于热风干燥多糖和真空干燥多糖(P<0.05)。3 种干燥方式多糖的还原力均显著低于VC(P<0.05)。据报道,在多糖质量浓度为10 mg/mL时,大蒜[29]和亚侧耳[14]多糖的还原力约为0.5。本实验研究结果表明,在质量浓度为3 mg/mL时,白三叶冷冻干燥多糖的还原力达到1.36,说明白三叶多糖具有较强的还原力。
本实验研究发现,白三叶多糖具有较强的还原力、DPPH自由基清除活力和ABTS+·清除活力。实际上,多糖发挥抗氧化作用的机制有多种。首先,多糖可能含有一些其他的抗氧化成分,比如肽类、黄酮、色素、多酚和蛋白质,这些成分可能对多糖的抗氧化活性有贡献[30]:其次,多糖的金属螯合能力与其抗氧化活性有关,而多糖分子结构中的硫酸基和糖醛酸是多糖发挥金属螯合作用的基本要素[31]。白三叶冷冻干燥多糖的蛋白质、糖醛酸和硫酸基质量分数分别为1.97%、2.91%和0.97%,这些化学成分可能对白三叶多糖的抗氧化活性起到一定的作用。
3 结 论
本实验研究了干燥方式(热风干燥、冷冻干燥、真空干燥)对白三叶多糖得率、化学组成和抗氧化活性的影响,结果表明,干燥方式对白三叶多糖化学组成(总糖、糖醛酸和硫酸基质量分数)和溶解度等理化性质及抗氧化活性有显著影响(P<0.05)。与热风干燥多糖和冷冻干燥多糖相比,冷冻干燥多糖具有更强的还原力、DPPH自由基清除活力和ABTS+·清除活力(P<0.05)。因此,冷冻干燥法是制备白三叶多糖较好的干燥方式。
