血管紧张素Ⅱ体外诱导大鼠骨髓间充质干细胞心肌样细胞分化研究
2018-09-26邢玉洁朱火兰朱舜明张荣怀崔倩卫刘小祥王军奎
邢玉洁,朱火兰,朱舜明,张荣怀,崔倩卫,刘小祥,王军奎
陕西省人民医院心内一科(西安 710068)
主题词 血管紧张素Ⅱ @心肌样细胞 骨髓间充质干细胞 动物,实验 大鼠
缺血性心脏病是一种对人类健康能够造成严重危害的疾病,目前的发病率也在不断的增加[1]。面对药物治疗的局限性,近年来兴起的细胞移植术为治疗缺血性心脏病带来了希望,这项技术的应用能够使坏死的心肌得以修复,提高心脏功能[2]。目前,这项技术多选用各种干细胞,而BMMSCs是其中研究比较广泛的一种干细胞[3-4], 有相关报道指出血管紧张素Ⅱ(Angiotensin Ⅱ, AngⅡ)在诱导BMMSCs分化为心肌细胞的过程中占据十分重要的作用[5]。本实验拟观察血管紧张素Ⅱ对大鼠BMMSCs向心肌细胞分化的可行性及有效性。
材料和方法
1 主要实验试剂和实验动物 AngⅡ ( Sigma, USA), Ficoll 淋巴细胞分离液(1.077 g/ml, TBD公司),胎牛血清(Gibco, USA), MTT (Sigma,USA),L-DMEM 培养基(Hyclone, USA),胰蛋白酶(Sigma, USA),Hoechst 33258 (Sigma, USA)。4周龄、质量约为80~100 g的健康雄性SD大鼠,购于西安交通大学医学院动物实验中心。
2 实验方法
2.1 BMMSCs的分离与培养:SD大鼠断颈处死后取双下肢长骨,在培养皿中将股骨、胫骨分别分离出来,然后酒精(75%)消毒5 min。消毒结束后,用培养液多次冲洗股骨、胫骨的骨髓腔,收集冲洗液,然后加入淋巴细胞分离液(1.077 g/ml),开始离心(2000 r/min,20 min)。离心完毕后,可以看到分为三层,用吸管将中间云雾状的有核细胞层吸出,然后加入不完全培养液进行离心(1500 r/min,10 min),之后用完全培养液重悬后于25 cm2的培养瓶中接种, 最后置于5%CO2的孵箱中培养。隔3 d换1次液,到80%细胞聚集时,按照1∶2比例传代,传到第3代备用。
2.2 BMMSCs的诱导分化:选用第3代BMMSCs,对照组只加入基本的培养基,试验组加入AngⅡ (0.1μmol/L) 诱导。诱导24 h后,用吸管将诱导液轻轻的吸弃,然后分别添加完全的培养基,3 d换液1次,共培养4周。
2.3 形态学鉴定:在BMMSCs的分离培养及Ang Ⅱ诱导前后,在倒置相差显微镜下进行密切观察,重点记录细胞的生长及形态学的改变。
2.4 MTT法检测细胞活性并描绘细胞增殖曲线:将第三代BMMSCs以1×105/ml接种于24孔板中,分为两组,每组12孔,每孔接种细胞悬液200 μl。培养24 h之后进行诱导,试验组加入含Ang Ⅱ 的诱导培养基,对照组只加入基本的培养基。于1、3、5、7 d在每孔加入MTT溶液20 μl (浓度5 mg/ ml),孵育4 h后吸弃各孔内的上清液,然后加入DMSO150 μl,振荡10 min,最后在酶联免疫检测仪上选择490 nm的波长进行比色,测定各孔的光吸收值(A),记录结果,以时间为横坐标,吸光值为纵坐标,绘制增殖曲线。
2.5 免疫荧光染色:将诱导4 周后的细胞进行爬片,4%多聚甲醛固定,山羊血清封闭30 min,cTnI抗体4 ℃过夜,然后加入二抗(FITC标记)避光染色40 min,最后用Hoechst 33258孵育10 min,甘油封片后荧光显微镜下拍照。
2.6 流式细胞检测:调整诱导4 w后的细胞密度达到1×106个/ml, 加入cTnI抗体染色1h,再加入二抗避光染色40 min,然后40 g/L多聚甲醛固定20 min,最后流式细胞仪检测,计算染色阳性的细胞数占总细胞数的百分率。
2.7 透射电镜:离心使诱导4w后的细胞成团,于4 ℃用3%戊二醛前固定2 h,再进行后固定(1%四氧化锇,2 h),然后依次进行漂洗、梯度脱水、包埋(按照环氧丙烷∶包埋剂=1∶1比例配置)、切片和铅铀染色,并于透射电镜下拍照。

结 果
1 BMMSCs的形态学变化 BMMSCs原代培养后具有较强的折光性,形状为圆形 (图1A)。培养3天后形态呈多样化,可见短纺锤形,也可见三角形的、星形的或是扇形的(图1B)。与原代细胞相比,传代后细胞的体积增大,大多数呈梭形, 偶有一些呈多角形或三角形(图 1C)。经过Ang Ⅱ诱导后,主要表现为细胞体积逐渐增大,4周以后细胞形状变为长梭形,而且排列均一、整齐(图 1D)。
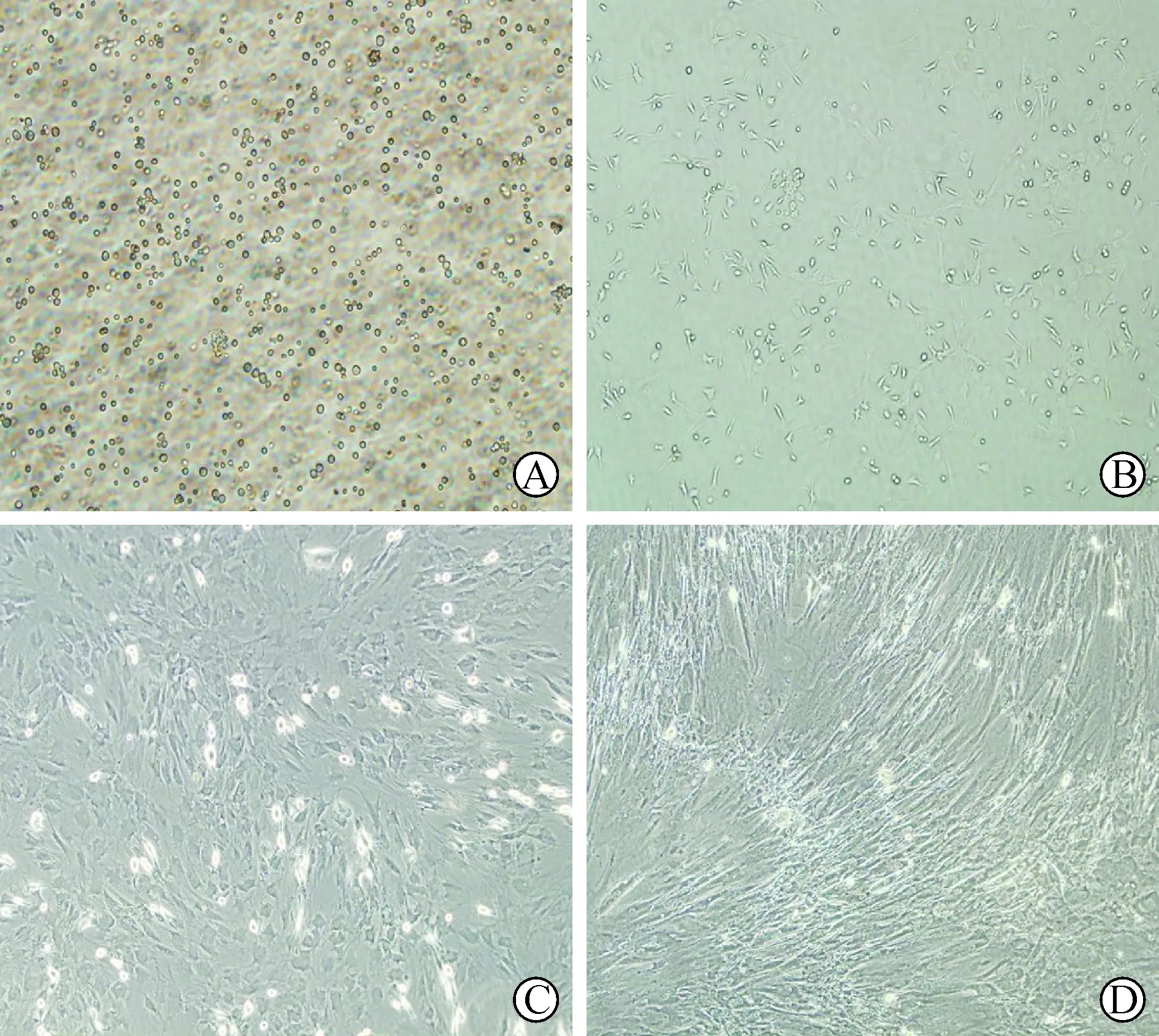
A : 初次分离的BMMSCs (×100倍); B:原代培养第3d的BMMSCs(×100倍);C:传代培养的BMMSCs(×200倍); D: Ang Ⅱ诱导4周的BMMSCs沿细胞长轴呈一致性排列(×400倍)
图1 AngⅡ诱导大鼠骨髓间充质干细胞
不同时间段细胞形态的变化
2 细胞增殖能力检测结果 MTT法检测结果显示:在第3d两组细胞的增殖能力被抑制,此后再逐渐变强(图2)。且AngⅡ组细胞的增殖能力较对照组明显增强。
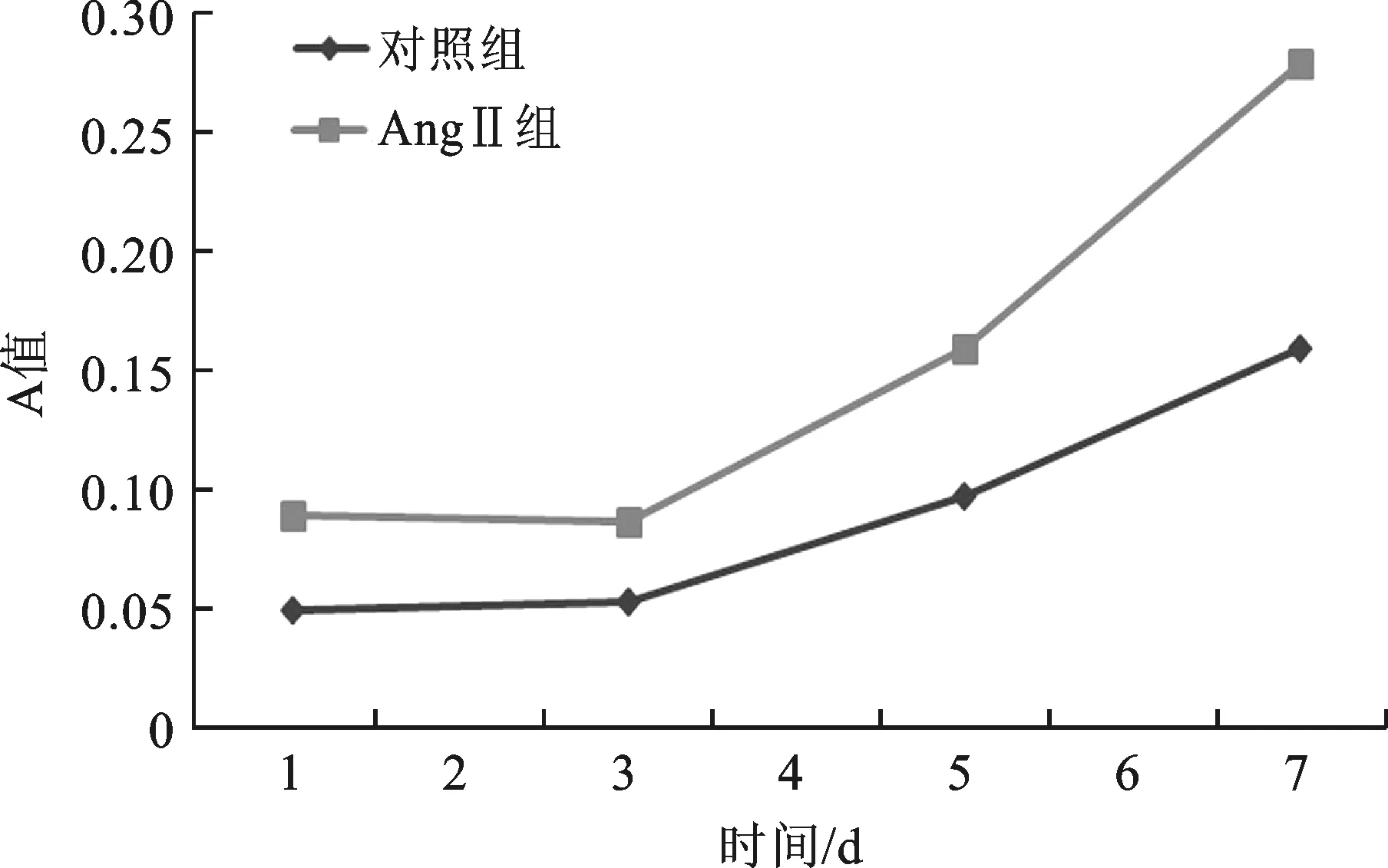
图2 细胞的增殖曲线
3 免疫荧光染色结果 经AngⅡ诱导的BMMSCs第4周阳性表达cTnI, 细胞质呈现绿色荧光,而细胞核呈现蓝色荧光(图3)。而对照组的细胞cTnI为阴性表达。
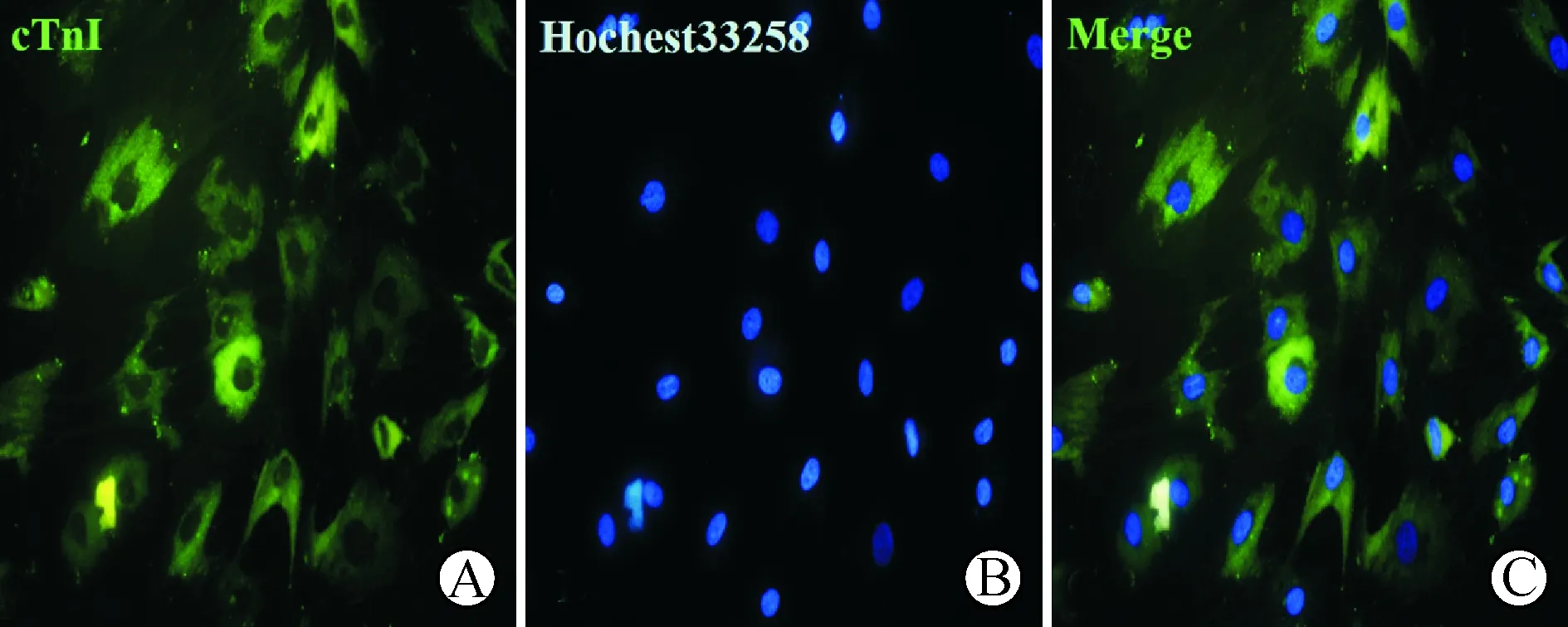
A:被AngⅡ诱导的细胞表达cTnI,呈绿色荧光(×200);B:细胞核被Hoechst33258染色,呈蓝色荧光(×200);C:图A与图B合并后呈图C(×200)
图3 AngⅡ诱导4周后cTnI荧光染色
4 流式细胞仪检测结果 流式细胞仪检测结果示:在对照组中FITC阳性细胞占细胞总数 (1.0±0.2) %,在AngⅡ组中 FITC阳性细胞占细胞总数 (25.3±2.2) %。AngⅡ组心肌样细胞诱导分化率较对照组显著增高,差异有统计学意义(P<0.05),见图4。
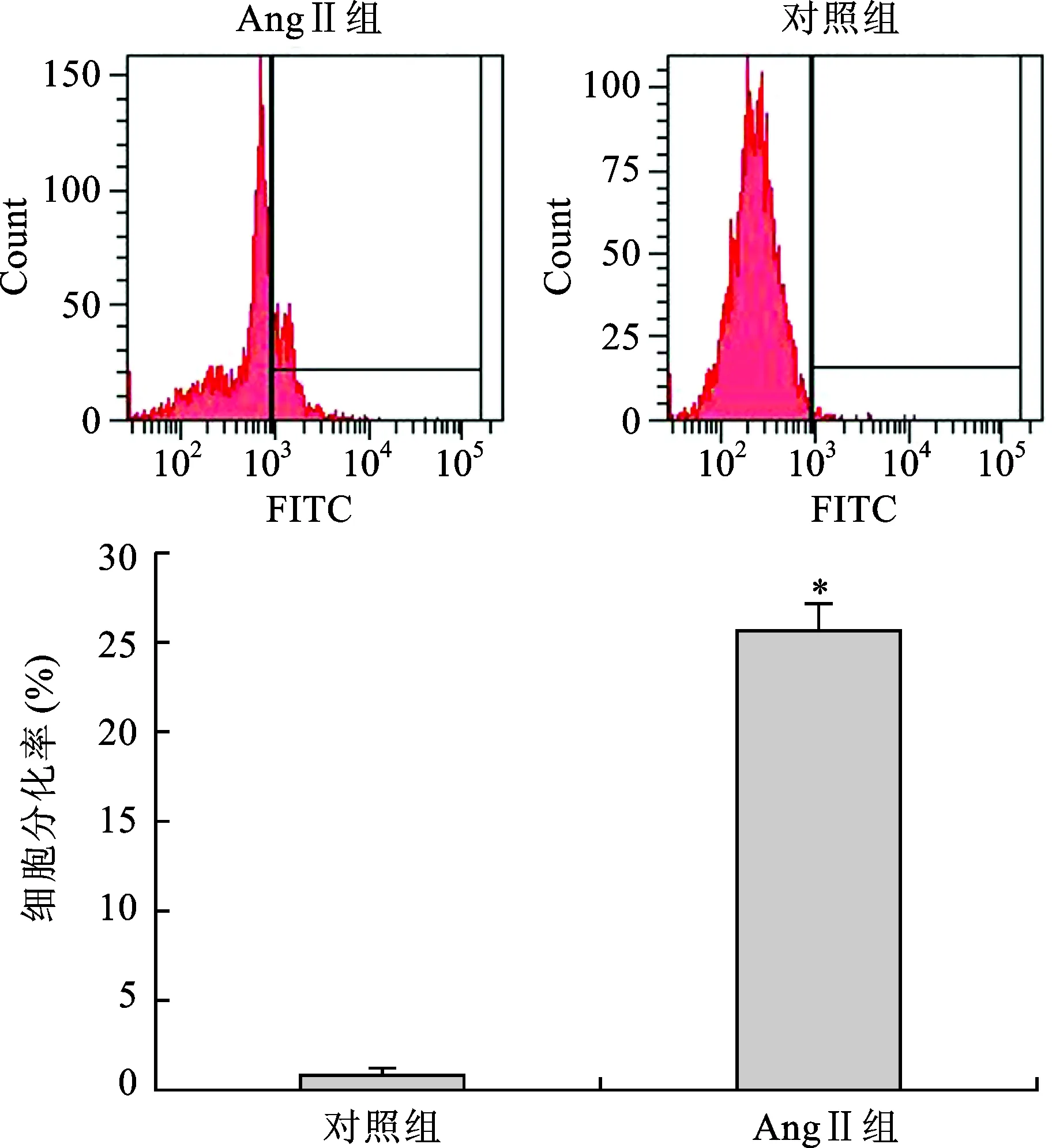
注:与对照组比较,*P<0.05图4 经AngⅡ诱导4周后细胞诱导分化率检测结果
5 透射电镜结果 透射电镜结果示:经过AngⅡ诱导的BMMSCs细胞器聚集在核周围,含有大量内质网和线粒体,还有Z线样物质、肌丝 (图5)。而对照组未见Z线样物质和肌丝。
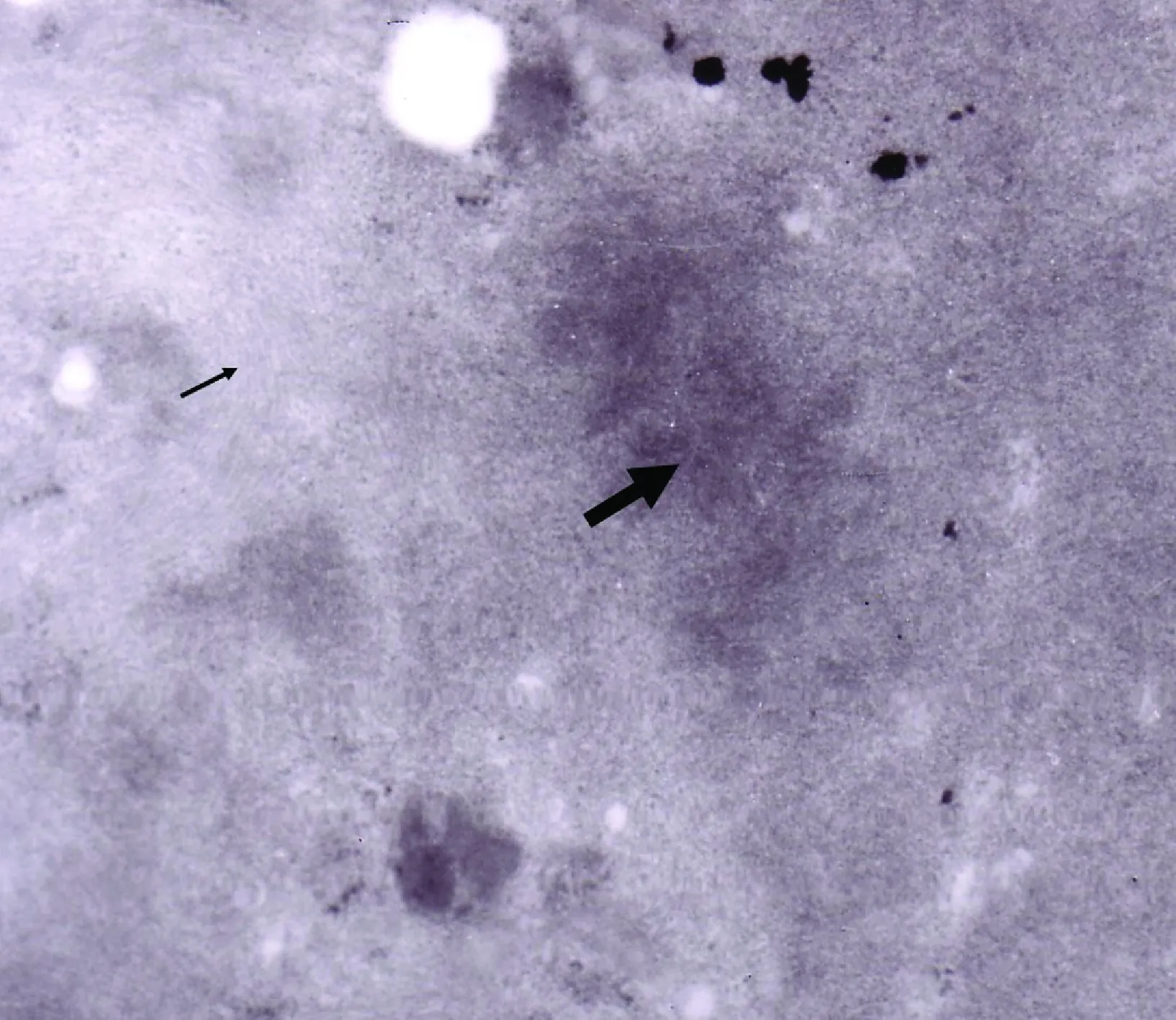
注:细箭头所示为肌丝,粗箭头所示为Z线样物质图5 透射电镜检测结果(×80K)
讨 论
众所周知,5-氮杂胞苷可诱导BMMSCs分化为心肌样细胞[6],然而其本身具有一定的毒性,诱导率也不是很高,所以临床有效性和安全性不是十分明确。因此,目前迫切需要寻找一种药物,既具有安全性又具有有效性,而且还要有较高的诱导分化率。有学者指出,Ang Ⅱ可在体外诱导人BMMSCs分化为心肌样细胞,但此方面的研究相对较少,且其具体的诱导分化有效性也不十分明确。
AngⅡ属于肽类激素,也是一种生长因子,具有调节血管张力和水钠代谢的作用,还可以刺激成纤维细胞和血管平滑肌细胞的增殖。研究表明:AngⅡ是血管平滑肌细胞强大的丝裂原,能够通过旁分泌或自分泌方式去刺激血管平滑肌细胞,使其蛋白质和DNA的合成增加,进而使细胞的数目增多[7]。此外,在碱性成纤维细胞生长因子和血小板衍生生长因子的合成与释放中,AngⅡ发挥促进作用,最终可引起血管平滑肌细胞分裂和增殖增加[8-9]。因此,本实验选择 Ang Ⅱ作为诱导剂,期望能够促进BMMSCs分化为心肌样细胞。通过MTT检测示,AngⅡ组细胞的增殖能力优于对照组,表明AngⅡ可以诱导且促进BMMSCs向心肌样细胞的增殖与分化。
肌钙蛋白(Troponin, Tn)一般位于收缩蛋白的细肌丝上,它是一种调节肌肉组织收缩的蛋白,包括TnI、TnT和TnC三个亚单位。cTnI是一种心肌特异性蛋白,对于鉴定心肌细胞具有很强的特异性。在我们的研究中,通过免疫荧光染色发现在Ang Ⅱ诱导组细胞cTnI表达阳性, 而在对照组cTnI表达则呈阴性,这表明我们通过Ang Ⅱ诱导的BMMSCs包含了心肌特异性蛋白。
此外,我们通过MTT检测显示:AngⅡ组细胞的增殖能力显著高于对照组。流式细胞仪检测结果显示:AngⅡ组心肌样细胞诱导分化率显著高于对照组[(25.3±2.2)% vs (1.0±0.2)%]。且AngⅡ诱导后的细胞可见肌丝、Z线样物质,符合心肌细胞超微结构。以上结果均说明我们成功用AngⅡ诱导BMMSCs分化为心肌样细胞,且诱导分化率较高。
尽管取得了以上结果,但Ang Ⅱ的作用机制仍然不是很明朗[10-11]。包括 Ang Ⅱ在内的多种细胞因子与其相应受体结合,导致ERK信号通路被激活,进一步增加了一些早期的即刻基因如erl-1、c-fos、c-jun等表达[12]。也有观点认为,细胞TGF-β1基因和TGF-β受体基因的表达能够被Ang Ⅱ增强[13], 而MAPK、PKA以及PKC等细胞信号通路又可因TGF-β基因表达增强而被激活。此外,磷脂酰肌醇4,5-二磷酸(PIP2)的水解也与Ang Ⅱ激活磷脂酶C有关,最终生成二酰甘油 (Diacyl glycerol , DG)与肌醇1 ,4 ,5-三磷酸 (Inositol trisphosphate , IP3 )[14],这两者作为第二信使进一步激动两条信号通路:即IP3/Ca2+及DG/PKC信号通路,参与调节一些生理过程。因此,AngⅡ诱导 BMMSCs分化为心肌样细胞可能与其能够使多条信号转导通路得以活化有关,也或许与其分泌一些诱导因子有关, 但是确切的机制尚需深入探讨。
综上所述,本实验发现AngⅡ可以诱导BMMSCs向心肌样细胞分化,分化的细胞具有心肌细胞的特性,且诱导分化率高。这为推动应用BMMSCs治疗心力衰竭等心血管疾病提供了一种新的策略。
