一株产普鲁兰酶菌株的筛选鉴定、酶学性质 及海带多糖酶解产物的抗氧化活性
2018-09-22王淑军吕明生房耀维焦豫良
吴 永,王淑军,吕明生,房耀维,刘 姝,严 翠,焦豫良,*
(1.淮海工学院海洋生命与水产学院,江苏连云港 222005; 2.江苏省海洋药物活性分子筛选重点实验室,江苏连云港 222005)
普鲁兰酶(Pullulanase,EC 3.2.1.41)能够特异性地水解普鲁兰多糖及淀粉中的α-1,6糖苷键,得到直链淀粉,属于淀粉脱支酶的一种,在淀粉相关行业已得到广泛应用[1]。全酶法工艺具有安全、高效、成本低等特点,广泛应用于淀粉行业。在此工艺中加入普鲁兰酶可优化工艺、充分利用原料、提高生产效率、改善品质。目前普鲁兰酶已成功应用于啤酒生产[2]、高麦芽糖浆制备[3]、玉米淀粉改性[4]等淀粉相关行业。在工业生产应用中,普鲁兰酶还可以与其他酶类协同作用于不同底物,得到不同的终产物,应用于化工、制药等行业[5-6]。所以普鲁兰酶的开发研究具有重要价值。
不同来源普鲁兰酶的酶学特性各有不同,为适应不同生产需求,研究者们不断从不同样品中筛选产酶菌株,以获得性质独特的普鲁兰酶。近年来,报道的产酶菌株有盐球菌(Halococcussp.)[7],肺炎克雷伯氏菌(Klebsiellapneumonia)[8],不动杆菌(Acinetobactersp.)[9]等。从研究现状看,已有普鲁兰酶在其性质上尚不能满足工业需求,因此寻找酶学性质良好的产生菌种仍然是必不可少的任务之一。海洋具有丰富的生物资源,海洋来源的普鲁兰酶具有耐盐、耐碱、耐低温等特性,在食品工业中具有更广阔的应用前景,为研究者提供了新的研究方向。本文从连云港海域的海泥中筛选目的菌株,以获得性质良好的出发菌株。
海带多糖(Laminariajaponicapolysaccharide)具有生物量大、生物活性多样、毒性较低等特点,在医药保健食品等行业都有不错的应用前景[10]。目前,已报道的海带多糖生物活性主要有降血脂、降血糖和抗氧化等[11-12]。近年来植物多糖酶解产物的研究已成为研究热点[13]。报道显示超声和双氧水法降解海带多糖,能产生抗氧化性增强的产物[14],但是酶解产物抗氧化活性的研究较少。
本试验从连云港海域海泥中筛选得到一株产普鲁兰酶的巨大芽孢杆菌P6,对该菌株进行了发酵纯化及酶学性质分析,并选取海带多糖为酶解底物,对其水解产物的抗氧化活性进行了初步研究。
1 材料与方法
1.1 材料与仪器
海泥样品 采集于连云港低潮海岸带海域;普鲁兰多糖、麦芽糖、α-中温淀粉酶(1000 U/g) 江苏锐阳生物科技有限公司;酵母粉、琼脂、K2HPO4、KH2PO4、(NH4)2SO4、3,5-二硝基水杨酸(DNS)、聚乙二醇20000等 均为分析纯,国药集团化学试剂有限公司;结晶紫、预染蛋白Marker II、果胶酶(20 U/mg)、木瓜蛋白酶(15 U/mg) 上海生工生物工程有限公司;葡聚糖凝胶(SephadexTMG-100) GE Heathcare公司;聚氰基丙烯酸正丁酯(BCA)试剂盒 Coolaber公司;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂 均购自宝生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) ALDRICH公司。
JSM-6390LA扫描电镜 日本TEOL;Nikon SMZ18体式显微镜 北京新卓仪器有限公司;PCR仪、酶标仪 BIO-RAD公司;HD-4电脑核酸蛋白检测仪 上海沪西分析仪器厂有限公司;日立CR22G高速冷冻离心机 日本HITACH;85-2型恒温磁力搅拌器 上海司乐仪器厂;DK-BD型电热恒温水槽 上海一恒科学仪器有限公司;DYY-2C型电泳仪 北京市六一仪器厂。
1.2 实验方法
1.2.1 产普鲁兰酶菌株筛选鉴定
1.2.1.1 主要培养基的配制 筛选培养基:普鲁兰多糖0.3%,酵母粉0.5%,琼脂2%,海水。发酵培养基:普鲁兰多糖1%,酵母粉1%,磷酸缓冲液,pH6.5。
1.2.1.2 菌株的筛选 称取1 g海泥于10 mL无菌海水中混匀,梯度稀释至10-6,取10-3、10-4、10-5、10-6各50 μL涂布于以普鲁兰多糖为唯一碳源的筛选培养基上,于25 ℃培养箱倒置培养24 h,将长有单菌落平板的平皿盖倒入适量乙醇,倒置于4 ℃冰箱,8 h后观察,挑取有透明圈的菌落进行划线纯化培养,并斜面保存。
1.2.1.3 菌株的鉴定 将纯化后的P6菌株进行形态学观察,挑菌涂布于盖玻片,戊二醛、磷酸缓冲液固定,不同浓度乙醇脱水处理,干燥后喷金,扫描电镜观察;参考伯杰氏细菌手册对菌株P6进行生理生化鉴定[15]。
1.2.1.4 P6菌株16S rRNA与gyrB序列分析 芽孢杆菌属16S rRNA序列具有高度相似性,单一用16S rRNA鉴定不够可靠[16]。将16S rRNA、gyrB序列分析相结合[17],可获得更可靠的结果。以P6菌株细胞为模板进行PCR扩增,16S rRNA引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′),gyrB引物(上游:5′-GGCGGCGGCGGCTATAA-3′,下游:5′-TAGCTGCCATTCTTGC-3′)。反应体系:2×Taq Mix(12.5 μL),上下游引物(各0.3 μL),模板(OD6000.5细胞悬液0.5 μL),dd H2O(11.4 μL)。反应程序:94 ℃变性10 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸45 s,30个循环;72 ℃终延伸10 min。PCR纯化产物送上海生工测序,测序结果提交至GenBank。利用Mega 7.0.14软件分别基于16S rRNA和gyrB基因序列对菌株P6进行系统进化分析,选择邻接法构建系统发育树。
1.2.2 产酶培养与纯化
1.2.2.1 产酶曲线的测定 将处于生长期的P6菌株稀释成OD600为0.05的细胞悬液,按0.1%(v/v)接种于100 mL发酵培养基中,25 ℃、180 r/min摇床培养72 h,每6 h取样分别测菌体与上清的酶活。
普鲁兰酶活力测定方法(DNS法):发酵液12000 r/min、4 ℃离心,取上清100 μL,加100 μL 1%普鲁兰多糖溶液(pH6.5磷酸缓冲液配制),45 ℃反应2 h,加DNS 100 μL,沸水浴10 min,以相同溶液的混合液沸水浴10 min作对照;100 μL离心菌体沉淀加100 μL pH6.5磷酸缓冲液,后续步骤同上清,测定反应液540 nm处吸光值。酶活力定义:在45 ℃条件下,单位时间(h)内分解普鲁兰糖生成1 μmol还原糖所需的酶量为一个活力单位(U)。
酶活(U)=W×1000/M×T×V
式中:W:麦芽糖(mg),标准曲线求得;M:麦芽糖分子量,360.32;T:反应时间(h);V:酶用量(mL)。
1.2.2.2 普鲁兰酶的纯化 收集发酵48 h的菌体,pH6.5磷酸缓冲液重悬,超声波破碎1 h(250 W,破碎2 s间隔3 s),12000 r/min、4 ℃离心25 min,取上清作为纯化粗酶液,进行硫酸铵梯度盐析,收集盐析沉淀,用pH6.5磷酸缓冲液重溶,透析脱盐,聚乙二醇20000浓缩至2 mL,过葡聚糖凝胶柱进一步纯化,收集有普鲁兰酶活性的组分,进行SDS-PAGE电泳分析。
1.2.3 酶学性质的测定 酶活力测定方法参照1.2.2.1。以1%普鲁兰多糖为底物,在pH6.5下,将反应物分别置于30~60 ℃下,每5 ℃为间隔,反应2 h,测定酶活力,分析其最适反应温度。在pH为3~8.5,每0.5个pH为间隔,45 ℃反应2 h,测定酶活力,分析其最适反应pH。将该酶在30、40、45、50、65 ℃下分别保温5 h,每1 h取样,加入底物,45 ℃反应2 h,测定其残余酶活,分析温度稳定性。在pH为5、6、6.5、7、7.5、8下45 ℃保温12 h,每2 h取样,测定其残余酶活,分析pH稳定性。取每组的最高酶活作为100%,计算不同条件下的相对酶活力,以温度或pH为横坐标,以相对酶活力为纵坐标,分析其酶学性质。
1.2.4 海带多糖普鲁兰酶水解产物的抗氧化研究
1.2.4.1 海带多糖的提取 参考翟为等[18]的方法提取海带多糖。
1.2.4.2 海带多糖普鲁兰酶水解物的制备 取1 mL 1%(w/v)海带多糖溶液(pH6.5磷酸缓冲液配制),加1 mL纯化后pH6.5磷酸缓冲液透析得到的普鲁兰酶溶液(58 U/mL),45 ℃反应12 h,反应液作为海带多糖普鲁兰酶反应组。取上述1 mL普鲁兰酶溶液100 ℃灭活10 min,加入1 mL1%海带多糖溶液,45 ℃保温12 h,混合液作为海带多糖普鲁兰酶灭活组。α-淀粉酶操作同上,反应温度为60 ℃。
1.2.4.3 海带多糖水解产物抗氧化活性的测定 实验共7组样品。样品1:pH6.5磷酸缓冲液作空白对照组;样品2∶1.2.4.2中海带多糖普鲁兰酶灭活组;样品3:1.2.4.2中海带多糖普鲁兰酶反应组;样品4:1.2.4.2中海带多糖α-淀粉酶灭活组;样品5:1.2.4.2中海带多糖α-淀粉酶反应组;样品6:1.2.4.2中1 mL 1%海带多糖溶液加1 mL pH6.5磷酸缓冲液的混合液作为酶灭活组对照;样品7:pH6.5磷酸缓冲液配制0.5%(w/v)维生素C(VC)溶液作为阳性对照。
抗氧化活性测定方法:清除DPPH自由基活性测定方法参照Amarowicz等[19];清除·OH自由基活性测定方法参照刘俊的结晶紫法[20]。
1.3 数据处理与分析
每组实验设三组平行,实验结果用平均值±标准差(n=3)表示,采用Origin 9.0、SPSS V17.0对试验结果进行统计分析,以p<0.05为差异显著。
2 结果与分析
2.1 产普鲁兰酶菌株鉴定
2.1.1 菌株P6的形态学特征 菌株P6菌落呈白色、不透明、边缘圆润、表面粗糙,中间稍有隆起无褶皱(如图1a),生长后期菌落中间出现液化;显微观察:P6为革兰氏阳性杆状细菌,有芽孢,不能运动。菌体大小约为1.2~1.6×2.0~4.0 μm,长杆状,末端圆,两个或多个呈链状排列(如图1b);芽孢大小为0.7~1.1×1.2~2.0 μm,椭圆形,次端生。

图1 菌株P6菌落形态(a)和电镜观察的细胞形态(b)Fig.1 Colony morphology(a)and electron microcell microscopy(b)of Strain P6
2.1.2 菌株P6的生理生化特征 该菌株部分生理生化结果见表1,结合形态学特征,将P6菌株初步鉴定为巨大芽孢杆菌(Bacillusmegaterium)。

表1 菌株P6部分生理生化试验结果Table 1 Some physiological and biochemical test results of strain P6
2.1.3 P6菌株的16S rRNA、gyrB基因扩增 将菌株P6的16S rRNA、gyrB基因测序结果提交到GenBank(16S rRNA注册号:KU206387;gyrB注册号:KY412801)进行Blast比对,并利用Mega 7.0.14构建进化树(如图2、图3),发现P6菌株与Bacillusmegaterium的同源性最高,16S rRNA、gyrB相似度达100%、99%,且在同一分支上。该结果与形态学特征、生理生化分析结果一致,P6菌株鉴定为巨大芽孢杆菌。目前,国内尚无产普鲁兰酶巨大芽孢杆菌的报道,菌种保藏在中国典型培养物保藏中心,保藏编号为CCTCC M2017009。

图2 基于菌株P6 16S rRNA序列构建的系统进化树Fig.2 Phylogenetic tree of the strain P6 based on 16S rRNA sequences注:▲:目的菌株;图3同。

图3 基于菌株P6 gyrB序列构建的系统进化树Fig.3 Phylogenetic tree of the strain P6 based on gyrB sequences
2.2 产酶培养与纯化
2.2.1 产酶曲线的测定 测定菌株P6细胞内与上清中的普鲁兰酶活力,绘制曲线(图4)。由图4可以看出,P6发酵液上清中无酶活,细胞菌体有酶活,该普鲁兰酶为细胞壁结合型酶,目前已报道的细胞壁结合型普鲁兰酶较少;P6菌株生长至24 h时,酶活力约达最高酶活的60%,48 h酶活达到最高;48 h后P6菌的酶活力开始下降,72 h酶活力损失约30%。目前已报道的芽孢杆菌属的产普鲁兰酶时间多为54 h[21-22]。本结果表明,相较于其他杆菌,巨大芽孢杆菌P6产酶较快。

图4 发酵时间对P6产酶的影响Fig.4 Effect of the fermentation time on enzyme production of strain P6
2.2.2 酶的纯化 细胞壁结合型普鲁兰酶在提取过程无需对发酵液进行浓缩,直接收集菌体,破碎离心得到上清作为纯化粗酶液,进行硫酸铵盐析,测得普鲁兰酶活性最高的盐析梯度为60%~80%,收集该梯度盐析产物,然后进行SephadexTM G-100层析,BCA试剂盒分别测出每一步的总蛋白,计算出比活力,结果见表2。初步纯化后的普鲁兰酶的比活力为62.3 U/mg,回收率为9.1%。通过对凝胶过滤后不同组分的蛋白进行酶活测定和SDS-PAGE电泳分析,得出普鲁兰酶蛋白的分子量约为43 kDa(图5)。

表2 普鲁兰酶的纯化Table 2 Purification of pullulanase
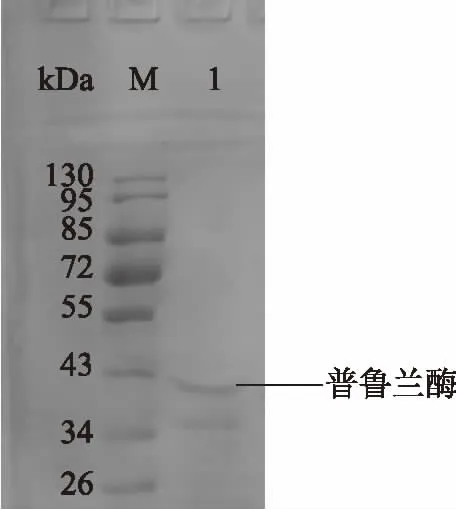
图5 纯化普鲁兰酶蛋白电泳Fig.5 Protein electrophoresis of purified pullulanse注:1:纯化后普鲁兰酶;M:预染蛋白Marker II。
2.3 酶学性质分析
P6产普鲁兰酶的最适反应温度为45 ℃(如图6)。在40 ℃保温5 h,仍有95%以上相对残余酶活;45 ℃保温5 h,残余酶活达70%;50 ℃保温5 h,酶活下降到30%;65 ℃保温1 h,酶活完全丧失(如图7)。该酶的最适pH为6.5(如图8),在pH5.0~8.0均有较强的酶活,说明该普鲁兰酶pH范围广泛,酸性或碱性条件都有一定酶活力。在pH6~7.5保温12 h,残余酶活仍有40%以上;在pH5.0~8.0保温2 h后,酶活力下降较快,在2~10 h保温过程中,酶活力保持稳定(如图9),说明该酶具有较好的pH稳定性。P6菌株所产普鲁兰酶最适温度和最适pH均低于已报道的海洋来源普鲁兰酶,其最适pH多为8,最适温度均在50 ℃以上[24-25],可能由于产酶菌株的来源不同显示出了地域差异。

图6 温度对普鲁兰酶酶活的影响Fig.6 Effect of temperature on the enzymatic activity of pullulanse

图7 温度对普鲁兰酶稳定性的影响Fig.7 Effects of temperature on the stability of pullulanse

图8 pH对普鲁兰酶酶活的影响Fig.8 Effect of pH on the enzymatic activity of pullulanse

图9 pH对普鲁兰酶稳定性的影响Fig.9 Effects of pH on the stability of pullulanse
2.4 海带多糖普鲁兰酶水解产物的抗氧化活性
从图10和图11可以看出,海带多糖对DPPH和·OH自由基的清除率均显著高于空白对照(p<0.05),显著低于VC(p<0.05),即海带多糖具有显著的抗氧化能力,但弱于VC,与文献[11]报道一致。海带多糖酶灭活组与海带多糖组的清除力无显著性差异(p>0.05),说明酶已灭活,海带多糖未被水解,样品保持了海带多糖的抗氧化活性。海带多糖普鲁兰酶反应组对DPPH和·OH自由基的清除率均显著高于普鲁兰酶灭活组(p<0.05),显著低于VC(p<0.05),说明海带多糖普鲁兰酶水解后抗氧化活性显著增强,抗氧化能力低于VC。α-淀粉酶海带多糖水解产物对DPPH和·OH自由基的清除率均显著低于普鲁兰酶海带多糖水解产物(p<0.05)。本研究对普鲁兰酶在最适条件下水解海带多糖的酶解产物进行了抗氧化研究,证明了海带多糖水解后抗氧化活性得到增强,不同条件下的酶解产物与抗氧化活性之间的关系还有待于进一步研究与探讨。

图10 α-淀粉酶、普鲁兰酶水解海带多糖的 水解产物清除DPPH自由基的能力Fig.10 Scavenging capacity of Laminaria japonica polysaccharide hydrolysate hydrolysised by α-amylase and pullulanse against DPPH free radicals

图11 α-淀粉酶、普鲁兰酶水解海带多糖的 水解产物清除·OH自由基的能力Fig.11 Scavenging capacity of Laminaria japonica polysaccharide hydrolysate hydrolysised byα-amylase and pullulanse against ·OH free radicals
3 结论
从连云港海域的海泥中筛选得到一株产普鲁兰酶的巨大芽孢杆菌P6(Bacillusmegaterium)。对该菌株进行了产酶培养纯化,纯化后普鲁兰酶比活力提高到62.3 U/mg,回收率为9.1%,蛋白电泳显示其分子量为43 kDa。该普鲁兰酶的最适温度为45 ℃,最适pH为6.5,在40 ℃具有良好的热稳定性。在pH4~8范围均有酶活性,在pH6~7.5具有良好的pH稳定性。海带多糖经普鲁兰酶水解后抗氧化活性显著增强(p<0.05),抗氧化能力显著低于VC,显著高于α-淀粉酶海带多糖水解产物。本研究为普鲁兰酶在抗氧化功能食品方面的研究提供参考。
