β-CD包络肽的介孔硅纳米塞的构建与控释性能研究
2018-09-20梅显斌阮丽萍
梅显斌,阮丽萍
(四川大学 化学工程学院,四川 成都 610065)
近年来,为减轻化疗对癌症患者的毒副作用[1-2],研究者们开发了多种药物控释系统[3-4],介孔硅因其独特优势而成为理想的药物控释载体[5-6]。谷胱甘肽(GSH)具备较强的还原性,很容易切断二硫键。研究表明,人类癌细胞内GSH的常见浓度为10 mmol/L,显著高于其在细胞外的浓度(2~10μmol/L)[3-7]。这种明显的差异性为氧化还原刺激响应体系的构建提供了必要的条件,研究者们已经设计出了多种基于GSH还原二硫键而实现药物控释的控释系统,但这些控释系统多采用高分子聚合物作为封堵分子,虽效果良好但其合成复杂[8-10]。
多肽是人体内普遍存在的一类非常重要的生物活性物质,多肽具有生物相容性好,易生物降解,降解产物对机体无二次伤害等优点[11],因此是一种理想的阀门分子,目前已报道的基于肽的控释阀门多是利用长链肽的自组装实现封堵,其合成也较为复杂。因此,本文拟在MCM-41型介孔硅上修饰二硫键,在二硫键另一端修饰只有两个氨基酸的二肽,末端氨基酸为含有疏水吲哚结构的色氨酸,并以二肽为“锚点”,通过β-CD的内部疏水空腔包络肽形成“纳米塞”实现对孔道的封堵。
1 实验部分
1.1 二肽修饰的介孔硅的制备
首先,按照文献[12]报道的方法略微调整后制备了MCM-41型介孔硅,巯基(-SH)修饰的介孔硅MCM41-SH 以及半胱氨酸(Cys)修饰的介孔硅MCM41-S-S-Cys。接着进一步与色氨酸(Trp)反应制得二肽修饰的介孔硅纳米颗粒MCM41-S-S-Cys-Trp,具体方法如下:在烧瓶里将40 mg 色氨酸(Trp)分散在2 mL 的MES 缓冲液(pH值=6.0,0.1mol/L)中,然后加入适量的DMSO使色氨酸溶解,再加入40 mg的EDC.HCl和20 mg的SULFO-NHS,室温下搅拌30min。40mg的MCM41-S-S-Cys分散于2 mL 的pH值=7.4的PBS缓冲液,然后将分散液加入到烧瓶中,室温下搅拌过夜。反应结束后,将溶液高速离心(10000 r/min,15min),分离出颗粒,然后用去离子水洗涤颗粒3次,得到二肽修饰的介孔硅MCM41-S-S-Cys-Trp。
1.2 纳米颗粒(MCM41-S-S-Cys-Trp)负载亚甲基蓝实验
实验采用亚甲基蓝(MB)作为模拟药物。取浓度为1×10-3mol/L的MB水溶液750μL与10 mg的纳米颗粒混合均匀,然后放在50℃水浴中加热2 h后关加热,常温下过夜。次日取5 mg 负载MB的纳米颗粒,加入5 mg β-CD后继续搅拌10 h,之后用去离子水洗4次。最后一次洗涤后,用200μL水溶解纳米颗粒,然后装到截留分子量为14kDa的半透膜里,将其放入25 mL 烧瓶后加入15 mL去离子水缓慢磁力搅拌,每天换3次水,洗2天,最后一次换水后加15 mL水过夜。
1.3 载药纳米颗粒的体外释放实验
先取3 mL烧瓶内液体测量吸光度,每隔10min取一个点,测量完吸光度后马上倒入烧瓶内,取6个点,完成后加入称量好的GSH粉末(溶液中GSH浓度为10 mmol/L),然后每10min取释放液测试吸光度,测量完尽快倒回体系中,连续测量4 h。最后通过作标准曲线将吸光度值换算成浓度值。
1.4 材料结构表征
高分辨透射电子显微镜(TEM 为JEM-2100Plus 型);N2吸附-脱附实验采用全自动比表面积及孔隙分析仪(Micromeritics-TristarII3020 型),样品在110 ℃下脱气12 h 后在77K下进行实验,数据采用BET-BJH 方法计算比表面积和孔径;Zeta 电位采用纳米粒度电位分析仪(Zetasizer Nano 型);热失重分析仪(TGA): HCT-2 型,升温速率10℃/min,载气为氮气,测量温度范围为100~700℃;吸光度用UV-1800PC紫外/可见分光光度计测量。
2 结果与讨论
2.1 表面肽修饰后的介孔硅纳米颗粒的形貌分析

图1 MCM41-S-S-Cys-Trp的TEM照片
采用高倍率透射电子显微镜(TEM)对制备的介孔硅纳米颗粒MCM41-S-S-Cys-Trp形貌进行了观察。从图1可以看到,MCM41-S-S-Cys-Trp为椭球形粒子,表面有明显的介孔,粒子尺寸大小为110nm左右。颗粒之间有部分交联的现象,这可能是由于介孔硅表面修饰的肽之间存在正负电荷的吸引力和苯环之间的疏水作用引起的,可见介孔硅纳米颗粒在修饰多肽后并未对介孔结构造成影响。
2.2 介孔硅纳米颗粒表面修饰基团的结构鉴定
在图2中可见,MCM-41在修饰不同基团前后,对应的红外谱图都出现了不同的峰位变化,但是作为本体的MCM-41特征峰没有发生很大变化。在波数3000~3700 cm-1之间,都存在着一个较宽的吸收峰,这是硅羟基(Si-OH)的伸缩振动峰。由于修饰巯基后MCM-41表面形成Si-O-Si键,使得硅羟基数量减少,所以在波数为3000~3700 cm-1之间的吸收峰强度不高;在波数1081 cm-1附近的一个相对较宽又较尖锐的吸收峰,应是MCM-41内、外表面上的硅氧四面体(SiO4)反对称伸缩振动峰;波数在500~1000 cm-1之间的几个吸收峰,归属于硅氧四面体的骨架振动谱带。以上结果说明在对MCM-41改性的过程中并没有破坏其主体结构。从图2(a)可知,将巯基(-SH)接枝到二氧化硅表面后,其FTIR光谱显示出1450 cm-1和2935 cm-1的新谱带,这分别属于-CH2-中的C-H伸缩振动和C-H不对称弯曲振动特征峰。此外,在2565 cm-1处出现了巯基吸收带,这更是直接表明了巯基(-SH)修饰成功。从图2(b)中FTIR谱图可见,2565 cm-1处的巯基吸收峰消失,而在1584 cm-1和1564cm-1处出现两个新的峰,这归属于芳环(骨架谱带)的伸缩振动,并且2930 cm-1处的峰表明-CH2- 的存在,这表明颗粒上存在吡啶环,说明MCM41-S-S-pridine制备成功。如图2(c)FTIR谱图所示,MCM41-S-S-Cys中,1584 cm-1和1564 cm-1处的两条谱带消失。与此同时,在1340 cm-1处出现了新谱带,这属于C-N伸缩振动,在1749 cm-1处的新谱带属于羰基中的C=O,这说明Cys接枝成功。从图2(d)中可见,在修饰色氨酸后出现了几个新的谱带。在1770 cm-1处出现的谱带属于羰基中的C=O伸缩振动,1650 cm-1处的新谱带属于N-H不对称弯曲震动峰,此外,在1458 cm-1和1525 cm-1处有两个新的谱带是由苯环中的C=C骨架振动引起的,这说明MCM41-S-S-Cys与色氨酸的酰化反应成功,制得MCM41-S-S-Cys-Trp纳米粒子。
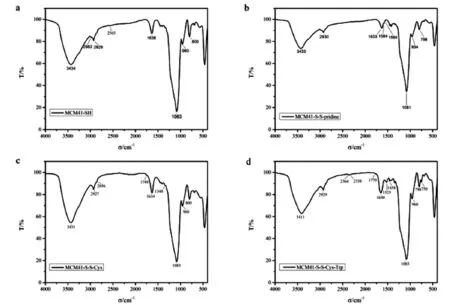
(a)脱模后MCM41-SH,(b)MCM41-S-S-pridine,(c)MCM41-S-S-Cys,(d)MCM41-S-S-Cys-Trp
图2 红外光谱
Fig.2 FT-IR spectra
2.3 表面修饰不同基团后的介孔硅纳米颗粒的Zeta电位
从表1和图3中可以看出,修饰了巯基的MCM41-SH显负电,其Zeta 电位值为-24.2 mV,这是因为巯基(-SH)在水中带负电。而带有吡啶环的MCM41-S-S-pridine的电负性增大至-26.8 mV,这是由于吡啶环上的氮原子的电负性较大所致。MCM41-S-S-Cys 纳米粒电负性降低至-22.2 mV,这是因为修饰的半胱氨酸含有氨基和羧基,其等电点为5.05,因此,MCM41-S-S-Cys 纳米粒在水溶液中表现为带负电。而与MCM41-S-S-pridine相比,MCM41-S-S-Cys 纳米粒缺少了带负电的吡啶环和增加了带正电的氨基,因此,其电负性降低。进一步修饰了色氨酸的MCM41-S-S-Cys-Trp电位值较MCM41-S-S-Cys变化不大,这是因为原来的半胱氨酸与新引入的色氨酸均含有氨基和羧基,两种氨基酸之间会发生酰胺化反应形成酰胺键,反应后体系仍然存在相当数量的氨基和羧基,MCM41-S-S-Cys-Trp带电荷的基团变化不大,因此,二者电位值变化也很小。

表1 介孔硅纳米粒子接枝化学基团后的Zeta 电位值

图3 介孔硅纳米粒子接枝不同基团后的Zeta电位变化趋势
Fig.3 The trend of Zeta-potential of MSNs after grafting with chemicals at each step
2.4 脱模后介孔硅纳米颗粒的介孔性质表征
通过N2吸附-脱附法对脱模后的介孔硅纳米粒MCM41-SH的比表面积、孔容积和孔径大小及分布情况进行测定,相关数据见表2,吸附-脱附曲线及孔径分布图见图4。从图4中可见,该吸附平衡等温曲线属IUPAC分类中的IV型,H1滞后环,与典型的MCM41型介孔材料相同。纳米颗粒在低压段吸附量平缓增加,此时N2分子经历了从单层到多层吸附在介孔的内表面,随着相对压力P/P0的不断增加,N2的吸附量也在增加。MCM41-SH在相对压力P/P0在0.3~0.4之间吸附曲线与脱附曲线出现比较明显的突跃且两条曲线距离很窄,表明含有介孔结构,且孔的均一性很好,这也与图中的孔径分布相一致,说明改性后的纳米颗粒介孔结构仍然存在。通过计算,MCM41-SH的比表面积高达1051.8 m2/g,BJH孔容积为1.00 cm3/g,孔径分布较窄,平均孔径为3.4 nm。

表2 MCM41-SH介孔硅纳米粒子的比表面积、孔容积和孔径值

图4 MCM41-SH纳米粒子的N2吸附-脱附等温曲线和BJH孔径分布
Fig.4 Nitrogen adsorption and desorption isotherms and pore size distribution of samples MCM41-SH
2.5 表面修饰后的介孔硅纳米颗粒的TG分析
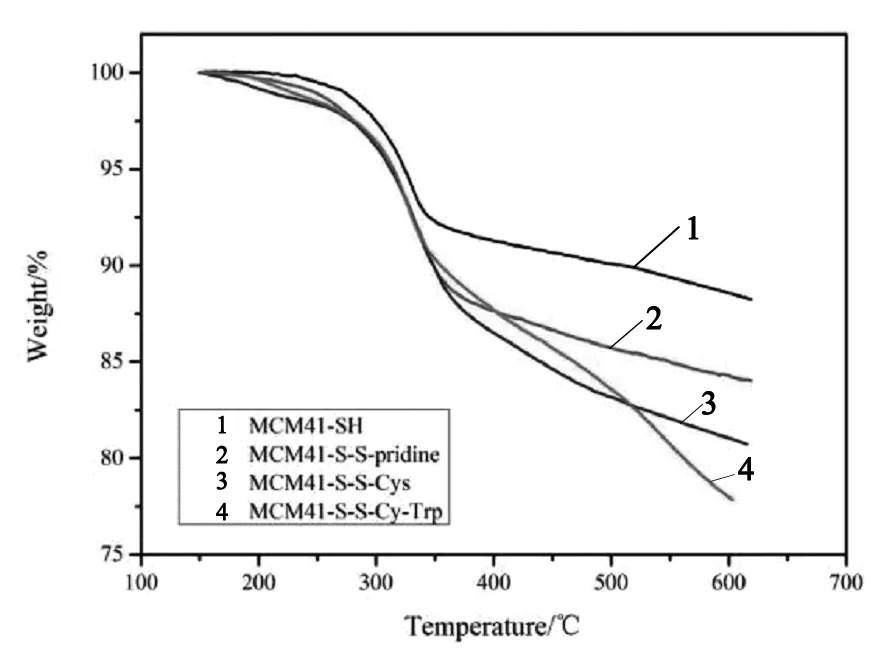
图5 MCM41-SH,MCM41-S-S-pridine,MCM41-S-S-Cys 和MCM41-S-S-Cys-Trp的热重曲线
从图5可见,巯基修饰的MCM41-SH在测试区间的失重为11.2%,这主要是因为在介孔硅表面的带巯基的硅烷偶联剂因高温失重而引起的。对MCM41-S-S-pridine而言,其在测试区间的失重增加至15.9%,这与其结构增加了硫和吡啶,有机物含量增加有关。从图5可看出,MCM41-S-S-Cys在测试区间的失重进一步增加至19.3%,这是因为修饰半胱氨酸后,纳米粒子中的有机物比重增加,当温度上升后有机物失重,造成失重增加。MCM41-S-S-Cys-Trp在测试区间的失重量均高于前面三种纳米粒,失重量增加至22.1%,这是因为在MCM41-S-S-Cys上接枝了色氨酸,纳米粒子的有机物比重进一步增加,从而引起测试区间的失重值进一步增加。热失重分析的结果说明了我们在对介孔硅改性的过程中,每一步反应均取得成功。
2.6 介孔硅纳米药物控释系统释放药物的定量分析
亚甲基蓝(MB)具有水溶性好,理化性质稳定,不易水解,便于检测等优点,其直径约为1.1~1.2 nm,在水溶液中带正电荷,是理想的模拟药物。以1 mmol/LMB载药的控释系统记为MB@MCM41-S-S-Cys-Trp@β-CD,并测定了该控释系统在无GSH和在10 mmol/L GSH刺激下在不同时间点的释放,结果如图6所示。
在图6中0~60min 内的5个点属于无GSH环境下的平衡数据,是该药物控释系统在纯水中浸泡12 h后的累计洗出量,并且在测量的1 h内其浓度值没有明显变化,说明“纳米塞”能有效的将MB封堵在孔道内,几乎无泄漏。当在第60min时,加入GSH使控释体系环境中的GSH浓度达到10 mmol/L后,释放液中的MB浓度值明显升高,第70min时的浓度值以达无GSH时的6倍,此后,随着药物不断地从孔道内释放出来,体系中的MB浓度值继续升高。在第240min以后,释放曲线趋于平缓,说明控释系统中MB的释放接近结束,最终在第300min时MB浓度值到达最初的22倍之多。以上结果说明GSH促使控释系统MB@MCM41-S-S-Cys-Trp@β-CD实现药物释放,结合其控释机理,只有封堵孔口的“纳米塞”被移除后,孔道内的MB才能快速释放出来。由此可以说明,在介孔硅纳米药物控释系统MB@MCM41-S-S-Cys-Trp@β-CD中,β-CD与二肽形成的“塞纳米塞”能有效封堵孔口,而当体系中存在10 mmol/L GSH时,连接肽的二硫键被打断,使得肽和β-CD一同脱离介孔硅表面,孔口被打开,孔道内的MB得以释放出来,实现了对药物的可控释放。

图6 纳米药物控释系统MB@MCM41-S-S-Cys-Trp@β-CD的释放曲线
3 结论
在MCM-41型介孔硅表面修饰了对GSH响应的二硫键及生物相容性优良的二肽小分子。以亚甲基蓝为模拟药物进行控释实验,以β-CD包络二肽的“纳米塞”在无GSH刺激时能保持良好的封堵能力,无亚甲基蓝释放,而当在10mmol/L GSH刺激下,能快速释放负载的大量亚甲基蓝,释放量为无GSH刺激的22倍。以上结果表明“纳米塞”具有良好的控制-释放性能,在药物控释方面具有应用潜力。
