调衡方多糖对Lewis肺癌荷瘤体红细胞免疫功能的影响
2018-09-20白志超张宏方于鹏龙李文侠于东波王媛媛王希胜
白志超,张宏方,于鹏龙,郑 玉,李文侠,于东波,王媛媛,王希胜
(1.中国人民解放军第二五二医院肿瘤血液科,保定 071000;2.陕西中医药大学病原微生物及检验学教研室,咸阳 712046)
扶正与祛邪是中医治疗恶性肿瘤的重要法则之一,扶正就是扶助正气,提高机体的抗病能力,祛邪就是祛除邪气,以减少荷瘤体的复发和转移,提高患者的生存质量。调衡方是以张锡纯《医学衷中参西录》中的理冲汤为基础方的古验方,对调衡方所做的前期实验及临床观察发现[1-2],该方不但对肿瘤有抑制作用,还有调节机体免疫功能的作用。CR1(即C3b受体)是红细胞表面的主要标志物之一,其化学组成为蛋白质,其主要功能是将机体内的循环免疫复合物(CIC)黏附、运载及最终将其清除,从而保持机体内环境的稳态平衡。近年临床报道发现[3-5],肿瘤病人的固有免疫红细胞CR1黏附功能紊乱,且肿瘤的发生与其CR1黏附功能低下关系密切。已有研究发现,多种植物和生物体内有大量活性多糖,这些活性多糖对机体的免疫功能有广泛影响[6-15],且这些活性多糖在抗肿瘤与调节机体免疫方面有广阔的应用前景。调衡方抑制肿瘤作用是否与其增强和改善荷瘤小鼠红细胞免疫功能有关仍不清楚。因此,本实验以Lewis肺癌荷瘤体小鼠红细胞补体受体CR1的活性为研究对象,探讨调衡方多糖(Tiaoheng Prescription Polysaccharides,THPPS)影响荷瘤机体红细胞免疫功能的作用机制。
1 仪器与材料
1.1仪器 单人双面超净工作台(苏州净化设备有限公司);低速离心机(上海安亭科学仪器厂);722E分光光度计(上海光谱仪器有限公司);电热恒温鼓风干燥箱,pH值测定仪(上海精宏实验设备有限公司);手提式压力蒸汽消毒锅(江阴滨江医疗设备厂);XD-101倒置显微镜(江南光电股份有限公司);数显恒温水浴箱(金坛市大地自动化仪器厂);MLS-3780全自动高压灭菌器(日本三洋公司);细胞计数板(上海市求精生化试剂仪器有限公司)。
1.2试药 唾液酸试剂盒(南京建成生物有限公司);黄芪多糖(astragalus polysaccharides,AGPS,黑龙江省生物制品一厂);酵母多糖(第二军医大学附属长海医院);戊二醛(北京化学试剂公司);瑞氏染液(上海试剂三厂)。
1.3材料 酵母菌种(陕西省微生物研究所);Lewis肺癌株(南京凯基生物科技发展有限公司)。
1.4动物 SPF级雄性C57BL小鼠(购自西安交通大学医学院实验动物中心),体质量20±2 g,6~8周龄,在陕西中医药大学二级动物实验室饲养。动物合格证号:SCXK(陕)2012-003。
2 方法
2.1调衡方多糖的制备 调衡方由黄芪30 g、山药30 g、白花蛇舌草30 g、西洋参15 g、天花粉12 g、天门冬10 g、生鸡内金10 g、莪术10 g和水蛭3 g等组成,诸药均经生药学鉴定,符合《中国药典》2015年版规定。称取以上调衡方中药,用无水乙醇浸没,恒温水浴85 ℃回流萃取90 min,滤过后使其在自然条件下干燥,按照料液比为1∶8加纯化水400 mL,恒温水浴96 ℃回流萃取2 h,经抽滤获取滤液,再加入400 mL蒸馏水置于药渣中,提取2 h,合并2次滤液,将此合并滤液置于旋转蒸发仪中,50~60 ℃浓缩得复方中药调衡方水提物。将此水提物用无水乙醇按照体积比1∶4 混合并不断进行搅拌,用离心机以4 500 r·min-1离心3 min,沉淀用无水乙醇洗3次,将获取的沉淀置于真空干燥箱中(60 ℃干燥90 min),即得调衡方复方中药多糖,为棕褐色粉末,经多糖含量测定,THPPS含量为56.40%,将此THPPS粉末用双蒸水配制成质量浓度为10 mg·mL-1的溶液,过滤除菌,密封,低温保存,备用。
2.2造模、分组及用药 选用C57BL小鼠,于右侧腋窝皮下接种6.5×106个·mL-1的Lewis肺癌细胞,每只0.2 mL制作荷瘤模型,随机将模型小鼠60只分为THPPS高、中和低剂量组(200,100和50 mg·kg-1·d-1),阳性组(黄芪多糖100 mg·kg-1·d-1)、Lewis肺癌小鼠模型对照组和正常组(均给予同体积生理盐水,NS)。共6组,每组10只。第2 天灌胃给药,每只0.2 mL,给药8 d,于停药后24 h眼球采血。
2.3THPPS观察指标
2.3.1对荷瘤小鼠抑瘤及脾脏、胸腺指数的影响 于给药24 h后,对荷瘤小鼠行脱臼处死,剥离瘤块、脾脏和胸腺,并用电子天平称定质量,计算各组瘤块、脾脏和胸腺质量,按照常规方法[16]统计各组瘤块平均质量及脾脏、胸腺指数。
2.3.2对荷瘤小鼠肿瘤红细胞花环(RBC-TRR)的影响 在小鼠眼球采血,置于有肝素的玻璃试管中,以1 500 r·min-1离心10 min,弃上清液,按照1∶3加入质量浓度为9 g·L-1的氯化钠注射液,离心3次,洗涤,用适量质量浓度为9 g·L-1的氯化钠液调整红细胞悬液为1×108个·mL-1,待用。人的新鲜血清制备:于实验前采人血,以2 000 r·min-1离心8 min,取上清液,置于2~10 ℃冰箱中待用。无菌操作,取8 d龄Lewis肺癌细胞,用生理盐水洗涤3次,调为1×106个·mL-1瘤细胞悬液。取人的新鲜血清0.1 mL与瘤细胞悬液等体积汇合,37 ℃水浴1 h,洗涤3次,弃上清液,使其成为人血清致敏的瘤细胞,再将0.05 mL制备好的红细胞悬液加入其中,37 ℃水浴30 min后,用质量浓度为0.5 g·L-1的戊二醛固定,轻轻吹打,取适量涂片,按照瑞氏试剂盒要求染色,依据红细胞结合3个及3个以上肿瘤细胞为红细胞肿瘤免疫花环统计,镜下计数100个红细胞,计算红细胞肿瘤花环百分率。
2.3.3对荷瘤小鼠红细胞免疫复合物花环(RBC-ICR)的影响 实验前取适量酵母多糖试剂,加1 mL生理盐水,置于37 ℃水中温育30 min,吹打混匀,待用。从1 mL抗凝血管中取100 μL红细胞液加入100 μL生理盐水,以1 500 r·min-1离心3次,弃上清液,再加适量生理盐水,轻轻吹打,混匀,使红细胞悬液为1.25×107个·mL-1,取配好的酵母多糖试剂与红细胞液各50 μL,吹打混匀,37 ℃水中温育30 min,加30 μL质量浓度为2.5 g·L-1的戊二醛固定,轻轻吹打,取适量涂片,按照瑞氏试剂盒要求染色,依据红细胞结合3个及3个以上酵母多糖为红细胞免疫复合物花环统计,镜下(酵母多糖多呈蓝色,红细胞呈紫红色)计数100个红细胞,计算花环率。
2.3.4对荷瘤小鼠红细胞受体花环率(RBC-C3bRR)的影响 实验前先配制好补体致敏的酵母菌试剂[17],从1 mL抗凝血管中取100 μL红细胞液,加100 μL生理盐水,以1 500 r·min-1离心3次,弃上清液,再加适量生理盐水,轻轻吹打,混匀,使红细胞悬液为1.25×107个·mL-1,取配好的酵母菌悬液与红细胞液各50 μL,吹打混匀,37 ℃水中温育30 min,加30 μL质量浓度为2.5 g·L-1的戊二醛固定,轻轻吹打,取适量涂片,按照瑞氏试剂盒要求染色,依据红细胞结合3个及3个以上酵母菌为红细胞受体花环统计,镜下(酵母菌多呈蓝色,红细胞呈紫红色)计数100个红细胞,计算其花环率。
2.3.5对荷瘤小鼠红细胞唾液酸含量的影响 各组连续给药8 d,于末次给药24 h后,摘眼球取血,参照文献[4,16]进行红细胞膜影泡制备。取小鼠血液1 mL,以3 000 r·min-1离心10 min,用生理盐水-Tris-HCl缓冲液(pH值为7.4),使红细胞溶血1 h,以3 000 r·min-14 ℃离心40 min,弃上清液,红细胞膜再用上述缓冲液冲洗3次,得到乳白色红细胞膜,存放于-70 ℃冰箱中备用。取制备好的红细胞膜影泡悬液1 mL,加Bialsche试剂,严格按照试剂盒中唾液酸的说明书,比色法检测并计算唾液酸的含量。
3 结果
3.1THPPS对荷瘤小鼠抑瘤及脾脏、胸腺指数的影响 黄芪多糖组和THPPS各剂量组对荷瘤小鼠的抑瘤作用均低于荷瘤模型组,抑瘤率分别为48.44%,21.58%,40.30%和49.78%。THPPS中、高剂量组及黄芪多糖组瘤体质量均低于荷瘤模型组(P<0.01),而与调衡方低剂量组比较差异无统计学意义(P>0.05);与荷瘤模型组相比,THPPS各剂量组与黄芪多糖组的脾脏指数、胸腺指数均明显提高,其中THPPS中剂量组和黄芪多糖组脾脏指数提高较显著(P<0.05);而THPPS高剂量组对脾脏、胸腺指数提高最显著(P<0.01);其他各组脾脏、胸腺指数与模型组比较差异无统计学意义(P>0.05),见表1。
表1THPPS对荷瘤小鼠抑瘤及脾脏、胸腺指数的影响


组别剂量/mg·kg-1瘤块质量/g脾脏指数/mg·g-1胸腺指数/mg·g-1正常组NS—3.97±0.303.07±0.23荷瘤模型组NS1.14±0.223.32±0.24##2.56±0.22黄芪多糖组1000.59±0.21**3.77±0.42*2.77±0.23调衡方低剂量组500.89±0.29△3.55±0.182.54±0.26△调衡方中剂量组1000.68±0.23**3.64±0.23*2.73±0.17调衡方高剂量组2000.57±0.21**3.86±0.28**2.96±0.23**
注:正常组与荷瘤模型组比较##P<0.01;荷瘤模型组与各给药组比较*P<0.05,**P<0.01;黄芪多糖组与调衡方各剂量组比较△P<0.05。-表示无瘤块。
3.2THPPS对荷瘤小鼠肿瘤红细胞花环(RBC-TRR)的影响 与正常组比较,荷瘤模型组表现出红细胞肿瘤花环率极度降低,而THPPS干预各组的红细胞肿瘤花环率,均有不同程度升高。与荷瘤模型组比较,THPPS高、中剂量组及黄芪多糖100 mg·kg-1组的花环率显著提高(P<0.01),THPPS低剂量组花环率有所提高,但差异无统计学意义(P>0.05),结果见表2和图1。
表2THPPS对荷瘤小鼠红细胞RBC-TRR和RBC-ICR的影响


组别剂量/mg·kg-1肿瘤红细胞花环数/%RBC-ICR数/%正常组NS17.24±2.9040.23±4.27荷瘤模型组NS4.98±2.56##7.89±3.46##黄芪多糖组10010.95±2.71**32.47±3.71**调衡方低剂量组507.79±3.4411.56±4.41△△调衡方中剂量组10014.03±3.56**34.48±4.15**调衡方高剂量组20014.36±4.68**35.22±4.70**
注:正常组与荷瘤模型组比较##P<0.01;荷瘤模型组与各给药组比较**P<0.01;黄芪多糖组与调衡方各剂量组比较△△P<0.01。
3.3THPPS对荷瘤小鼠红细胞免疫复合物花环实验(RBC-ICR)的影响 与正常组比较,荷瘤模型组红细胞免疫复合物花环率极度降低,而THPPS干预各组的红细胞免疫复合物花环率,均有不同程度升高。与荷瘤模型组比较,THPPS高、中剂量组及黄芪多糖100 mg·kg-1组的花环率显著升高(P<0.01),THPPS低剂量组花环率有所升高,但差异无统计学意义(P>0.05),结果见表2和图2。
3.4THPPS对荷瘤小鼠红细胞C3b花环(RBC-C3bRR)的影响 与正常组比较,荷瘤模型组红细胞C3b黏附花环的能力下降,经过调衡方的治疗后各组均有不同程度的提高。与荷瘤模型组比较,THPPS 高、中剂量组及黄芪多糖100 mg·kg-1组的花环率显著升高(P<0.01),THPPS低剂量组花环率有所升高,但差异无统计学意义(P>0.05),结果见表3和图3。
3.5THPPS对荷瘤小鼠红细胞唾液酸含量的影响 见表3。由表3可知,与正常组比较,荷瘤模型组红细胞唾液酸含量极度降低(P<0.01),与荷瘤模型组比较,THPPS干预各组的红细胞唾液酸含量,均有不同程度升高,高、中剂量组差异有统计学意义(P<0.01)。与黄芪多糖组比较,THPPS高、中剂量组差异有统计学意义(P<0.05,P<0.01)。
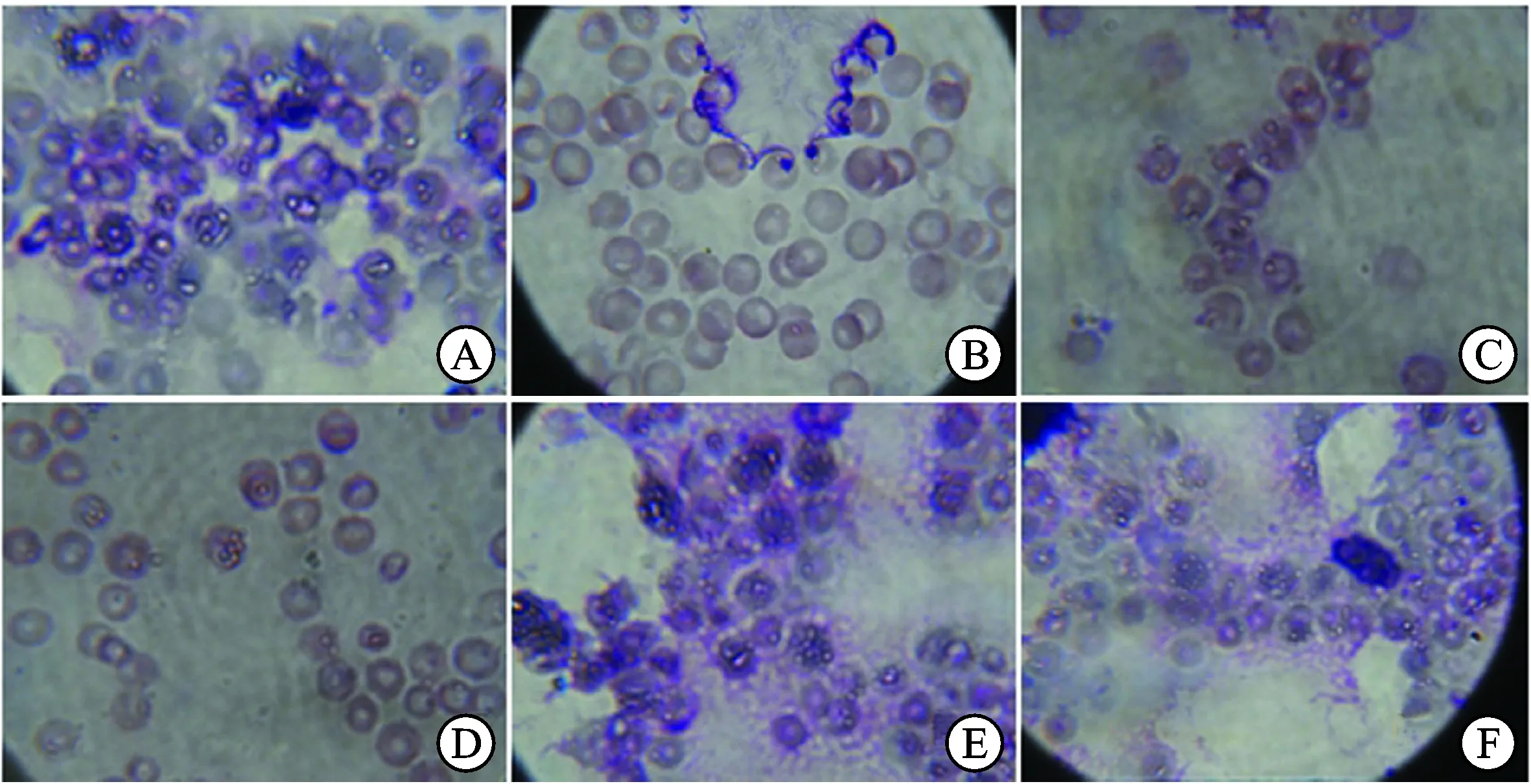
图1不同组Lewis肺癌荷瘤小鼠红细胞RBC-TRR的花环图
A.正常组(×100);B.荷瘤模型组(×100);C.黄芪多糖组(×100);D.调衡方低剂量组(×100);E.调衡方中剂量组(×100);F.调衡方高剂量组(×100)。
Fig.1 Comparison of tumor-bearing mice RBC-TRR garlands between different groups
A.control group (×100);B.model group (×100);C.AGPS group (×100);D.THPPS low dose group (×100);E.THPPS middle dose group (×100);F.THPPS high dose group (×100).
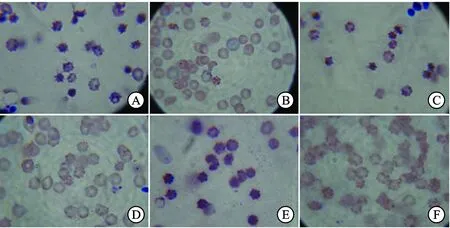
图2不同组Lewis肺癌荷瘤小鼠红细胞RBC-ICR的花环图
A.正常组(×100);B.荷瘤模型组(×100);C.黄芪多糖组(×100);D.调衡方低剂量组(×100);E.调衡方中剂量组(×100);F.调衡方高剂量组(×100)。
Fig.2 Comparison of tumor-bearing mice RBC-ICR garlands between different groups
A.control group (×100);B.model group (×100);C.AGPS group (×100);D.THPPS low dose group (×100);E.THPPS middle dose group (×100);F.THPPS high dose group (×100).

图3不同组Lewis肺癌荷瘤小鼠RBC-C3bRR的花环图
A.正常组(×100);B.荷瘤模型组(×100);C.黄芪多糖组(×100);D.调衡方低剂量组(×100);E.调衡方中剂量组(×100);F.调衡方高剂量组(×100)。
Fig.3 Comparison of tumor-bearing mice RBC-C3bRR garlands between different groups
A.control group (×100);B.model group (×100);C.AGPS group (×100);D.THPPS low dose group (×100);E.THPPS middle dose group (×100);F.THPPS high dose group (×100).
表3THPPS对荷瘤小鼠RBC-C3bRR及红细胞唾液酸含量的影响
Tab.3 The effects of THPPS on the content of sialic acid in red blood cells and RBC-C3bRR in tumor bearing mice

组别剂量/mg·kg-1RBC-C3bRR数/%唾液酸含量/mmol·L-1正常组NS43.80±5.182.10±0.29荷瘤模型组NS27.64±4.35##0.85±0.25##黄芪多糖组10034.13±3.35**1.35±0.27**调衡方低剂量组5028.57±2.06△△1.11±0.30调衡方中剂量组10037.35±4.16**1.79±0.35**△△调衡方高剂量组20037.71±5.07**1.82±0.50**△
注:正常组与荷瘤模型组比较##P<0.01;荷瘤模型组与各给药组比较**P<0.01;黄芪多糖组与调衡方各剂组比较△P<0.05,△△P<0.01。
4 讨论
自20世纪50年代发现真菌多糖抗肿瘤活性以来,对植物多糖的研究便成为一大热点,发现许多中药多糖除有抗肿瘤、抗衰老和调控细胞增殖分化外,还对红细胞免疫功能有促进和调节作用[3-5],如对黄芪、党参、当归和茯苓多糖研究发现,这些中药多糖均可提升机体红细胞表面CR1的数量与活性,尤其是黄芪多糖效果最明显。本次实验结果显示,THPPS具有一定的抗肿瘤作用,其高剂量对Lewis肺癌的抑瘤率为49.78%。同时THPPS还能明显提升脾脏、胸腺指数,说明其对脾脏、胸腺的发育有一定的促进作用。对调衡方已有的研究表明,该方不但对肿瘤有抑制作用,还有调节机体免疫功能的作用[1-2]。机体自身抗肿瘤过程除淋巴的细胞免疫、体液免疫之外,红细胞也具有免疫和抗肿瘤作用,故本实验把固有免疫红细胞表面CR1受体作为研究核心靶标,以探讨调衡方多糖对荷瘤小鼠固有红细胞免疫黏附功能的影响。
红细胞是构成机体免疫系统的重要组成部分之一,大量研究显示,机体内红细胞也具有一定的免疫功能[18]。血循环中红细胞数为有核细胞数的1 000倍,分布于红细胞上95%的CR1存在于血液循环中,因此红细胞是IC(免疫复合物)主要清除者而非白细胞。研究发现,红细胞除清除IC外,还能直接增强NK细胞的抗肿瘤活性,同时红细胞可使人T细胞活性增加及表面IL-2受体表达增多,可增加TNF(肿瘤坏死因子)与IFN-γ(干扰素)的产生[19]。现已发现许多不同肿瘤患者(乳腺、胃、大肠、肝、卵巢癌)体内CR1(补体C3b受体)活性降低[20],荷瘤体瘤块小,机体无远处转移者,红细胞免疫功能受抑制较轻,反之,红细胞免疫受抑显著增强。影响荷瘤体红细胞免疫功能抑制的因素:荷瘤体内抑制性T细胞(Treg)增多,而释放抑制性因子,使CR1的活性受抑,如肿瘤微环境中产生的TGF-β和IL-10等抑制免疫活性的因子升高,而抑制红细胞在骨髓中CR1的合成;荷瘤体内CR1的数量仅为正常机体的一半,使红细胞黏附肿瘤细胞的能力降低,加之瘤细胞产生的抗原如CEA、AFP释放增多,即所产生大量的IC占用了CR1,使有用的CR1减少;荷瘤体免疫功能紊乱,产生针对CR1的自身抗体,使CR1减少,同时,红细胞在循环中,将结合在其上的IC递交给肝、脾中的巨噬细胞处理时,CR1损伤丢失。CR1的降低意味着红细胞免疫黏附促吞噬调理作用及清除IC功能低下,使IC在血液循环中增多,随着体内IC的升高,使机体抗肿瘤免疫遭受严重的破坏,这种恶性循环,最终导致瘤细胞转移与免疫逃逸的后果。而多糖类可能修饰改变红细胞膜的结构,从而使CR1活性增强。
红细胞对肿瘤的免疫是通过其表面CR1免疫黏附(瘤细胞)以达到清除肿瘤细胞的目的。肿瘤红细胞免疫的机制是荷瘤体的瘤细胞一方面激活旁路途径产生C3b,另一方面能与补体C3b黏附,使RBC(红细胞)通过C3b与肿瘤细胞形成红细胞免疫复合物,促进吞噬细胞的吞噬,发挥抗肿瘤作用,因此,本实验通过观察THPPS对荷瘤小鼠红细胞黏附肿瘤细胞的能力,与正常组比较,荷瘤模型组表现出红细胞肿瘤花环率极度降低。这与临床报道基本一致。经过THPPS的治疗后,THPPS干预各组的红细胞肿瘤花环率,均有不同程度升高。
CR1是Fearon(1979年)从人RBC膜上纯化分离得到的一种糖蛋白,作为RBC免疫重要物质基础的CR1(C3b受体),其可黏附循环免疫复合物,通过提升吞噬细胞吞噬而增强荷瘤体对循环免疫复合物的清除能力[20]。荷瘤体内因抗原产生的免疫复合物急聚增多,大大超出红细胞免疫黏附清除的能力,导致荷瘤体红细胞CR1的数量降低并失去活性,从而使荷瘤体抗肿瘤免疫力出现障碍,最终导致机体内红细胞C3b受体的量降低。与正常组比较,荷瘤模型组红细胞C3b黏附花环的能力下降,经过调衡方的治疗后各组均有不同程度的提高。结果表明,该方多糖能提升荷瘤小鼠红细胞C3b受体数量,使其红细胞免疫黏附作用增强,从而促进红细胞对癌细胞的调理吞噬能力,可及时将循环免疫复合物清除。通过荷瘤体红细胞C3b受体活性酵母花环实验发现,Lewis肺癌荷瘤小鼠模型对照组的花环率较正常组明显降低,说明荷瘤小鼠体内RBC C3b受体活性与数量均降低,经过THPPS的治疗后,Lewis肺癌荷瘤小鼠的C3b受体活性及数量较模型对照组均有不同程度的升高,且与剂量呈正相关,提示THPPS可提升荷瘤小鼠红细胞CR1的数量和活性,以抑制瘤细胞的生长。
唾液酸是红细胞膜上CR1组分的重要构成之一,其化学本质是由膜糖蛋白构成,红细胞的许多功能与其含量密切相关,如膜表面受体功能、免疫应答等均与其相关,因此,一旦红细胞CR1唾液酸的含量降低,红细胞免疫功能就降低,最终导致清除循环免疫复合物(CIC)出现障碍,CIC剧增,之后补体被激活而致病理免疫损伤。实验观察了该方多糖对红细胞膜唾液酸量的变化,结果发现,与正常组比较,荷瘤模型组红细胞唾液酸含量极度降低,而THPPS干预各组的红细胞唾液酸含量均有不同程度升高,与荷瘤模型组比较,THPPS高、中剂量组差异有显著统计学意义。
实验结果表明,荷瘤小鼠红细胞膜上的唾液酸通过THPPS的干预,可使其含量及功能增强,使红细胞膜上CR1的数量与活性得到提升,从而使荷瘤小鼠红细胞免疫黏附能力增强,肿瘤细胞生长繁殖受到抑制,从而起到抗肿瘤的作用。
