丹参素通过激活Wnt/β-catenin通路促进大鼠原代成骨细胞的分化
2018-09-20闫小飞张富军杜小娟武丽涛李冬民
闫小飞,张富军,杜小娟,武丽涛,李冬民,韩 燕
(西安交通大学基础医学院生物化学与分子生物学系,西安 710061)
骨质疏松症是由多种原因导致的骨密度和骨质量下降、骨超微结构破坏,造成骨脆性增加,从而易发生骨折的全身性骨病。目前,全球约有2亿人患有骨质疏松症[1-2]。在骨中,成骨细胞负责骨质形成,破骨细胞参与骨质吸收。骨形成减少、骨吸收增加或不变,导致骨质净流失均会造成骨质疏松[3]。增强成骨细胞活性与分化,促进骨质生成,是有效预防骨质疏松的方法之一。
丹参是著名的传统中药,具有抗氧化、改善微循环和防止血栓形成等多种功能[4-6]。近年来研究发现,丹参可促进骨愈合,预防股骨头坏死,有效降低绝经期妇女骨质疏松相关生化指标[7-8]。目前,已知丹参中含有丹参素、丹酚酸A和丹酚酸B等多种单体成分。丹参素(β-3,4-dihydroxyphenyl-lactic acid)是中药丹参主要的水溶性提取物之一[9]。丹参素单体在成骨细胞发育中的作用及机制还不清楚。本研究通过观察丹参素对体外培养大鼠成骨细胞分化的影响,为阐明丹参素是否具有调节骨生成和防治骨质疏松提供实验证据。
1 仪器与材料
1.1仪器 Millipore Elix 纯水制备系统(美国Millipore公司);Eppendorf AG 22331 Hamburg高速离心机(德国Eppendorf公司);Mx3000P/3005P实时荧光定量PCR仪(美国安捷伦公司);SYNGENE G:BOX F3凝胶成像分析系统(英国SYNGENE公司);TECAN Infinite®M1000 Pro全波长多功能酶标仪(瑞士Tecan公司);Nikon DS-Ri1-U3 数码显微成像系统(日本Nikon公司)。
1.2试药 丹参素(相对分子质量为198.17,质量分数为98%),购自陕西易飞生物科技有限公司;Wnt/β-catenin抑制剂KYA1797K,分析纯,购自美国Selleck公司。
1.3材料 胶原酶Ⅳ和alpha-MEM培养基,购自美国GIBCO公司;胎牛血清(fetal bovine serum,FBS)、青霉素/链霉素和胰酶,购自美国Hyclone公司;碱性磷酸酶(alkaline phosphatase,ALP)染色试剂和茜素红染色试剂,购自南京建成生物工程研究所;iScriptTM cDNA 合成试剂盒,实时定量荧光PCR试剂盒,均购自美国Thermo公司。
2 方法
2.1大鼠原代成骨细胞的获取与培养 大鼠原代成骨细胞的获取参照文献[10]进行。选取2~4 d新出生的SD大鼠,用断头法处死,在无菌条件下取出颅骨,剔净后剪成1 mm3的碎块,用质量浓度为2 g·L-1的胶原酶Ⅳ消化15 min以去除纤维细胞。将碎骨块用质量浓度为2 g·L-1的胶原酶Ⅳ消化45 min,收集成骨细胞。加入含100 mL·L-1血清的a-MEM培养液,放入37 ℃、50 mL·L-1的CO2培养箱中继续静置培养。此后每间隔3 d换液1次,待细胞生长至培养瓶底80%时,用胰蛋白酶-EDTA消化液消化,按照1∶2传代培养。取第3~10代的细胞进行实验。在诱导细胞分化时,在细胞培养液中另外添加质量浓度为50 μg·mL-1的抗坏血酸和5 mmol·L-1的β-甘油磷酸钠[11]。
2.2细胞毒性实验 以4×103个·孔-1的细胞密度将原代成骨细胞接种于96孔板中,培养过夜。次日分别加入0,0.1,1和10 μmol·L-1的丹参素,分别于药物作用24,48,72和96 h后,在各细胞培养孔中分别加入20 μL MTT溶液(质量浓度为0.5 mg·mL-1)继续孵育4 h后,吸去孔内液体,再加入150 μL DMSO,振荡10 min,在490 nm波长处测定各孔的光密度(optical density,A)值。
2.3Real-time PCR 参照RNA提取试剂盒说明书提取RNA,将提取到的总RNA用分光光度计定量。测定RNA的浓度后取1 μg逆转录成cDNA。运用real-time PCR检测成骨细胞分化标志基因Runx2和Osterix mRNA的表达,选择GAPDH作为内参。数据采用ΔΔCT法进行分析,为3次重复实验的平均值。用到的引物序列如下。Osterix上游引物序列:5′-GGAAAGGAGGCACAAAGAAGC-3′,下游引物序列:5′-CCCCTTAGGCACTAGGAGC-3′。Runx2上游引物序列:5′-GACTGTGGTTACCGTCATGGC-3,下游引物序列5′-ACTTGGTTTTTCATAACAGCGGA-3′。GAPDH上游引物序列:5′-CCTCAAGATTGTCAGCAAT-3′,下游引物序列:5′-ACCACAGTCCATGCCATCAC-3′。
2.4ALP染色 将大鼠成骨细胞以5×104个·孔-1的密度接种于24孔板中,待细胞生长至细胞培养孔底80%后,更换培养基对细胞进行诱导培养,7 d后弃上清液,用PBS缓冲液冲洗2遍,乙醇固定30 min后用PBS缓冲液冲洗2遍,加入按照试剂盒要求配制的染液染色10 min,蒸馏水冲洗2遍后镜下观察成像。
2.5钙化结节染色 将大鼠成骨细胞以5×104个·孔-1的密度接种于24孔板中,待细胞生长至细胞培养孔底80%后,更换培养基对细胞进行诱导培养,20 d后去除细胞培养上清液,用PBS缓冲液冲洗细胞2遍,乙醇固定30 min后用PBS缓冲液冲洗2遍,加入质量浓度为2 g·L-1的茜素红染液(pH值为8.4),37 ℃染色30 min,蒸馏水冲洗2遍后显微镜下观察成像。
2.6Western Blotting检测蛋白表达 用Western Blotting检测细胞核内β-catenin含量时,按照碧云天细胞核提取试剂盒方法提取核蛋白。取20 μg蛋白行聚丙烯酰胺凝胶电泳,转膜,用质量浓度为100 g·L-1的脱脂奶粉封闭,4 ℃特异性单克隆抗体孵育过夜,再用HPR标记的相应二抗室温孵育1 h,以上各步骤间用TBST洗膜5 min。增强ECL显影液显影。用Image J分析软件测定图像条带灰度值,计算蛋白相对含量。
2.7统计学处理 采用SPSS 19.0软件的单因素方差分析对实验数据进行处理,以P<0.05为差异有统计学意义。
3 结果
3.1丹参素对原代成骨细胞的增殖活性无影响 通过MTT法检测丹参素对原代成骨细胞增殖活性的影响。结果发现,0,0.1,1和10 μmol·L-1的丹参素对原代成骨细胞增殖活性均无影响,见图1。

图1不同浓度的丹参素对大鼠成骨细胞增殖的影响
Fig.1 Effect of different concentration of tanshinol on rat osteoblastic cell proliferation
3.2丹参素提高原代成骨细胞分化基因Runx2和Osterix的mRNA表达 原代成骨细胞在不同条件培养基中培养48 h后,应用Real-time PCR检测成骨细胞分化基因Runx2和Osterix的mRNA表达。结果发现,与丹参素未处理的细胞相比,在1和10 μmol·L-1丹参素处理的成骨细胞中Runx2和Osterix的mRNA表达明显升高(P<0.05);然而0.1 μmol·L-1丹参素处理的成骨细胞中Runx2和Osterix的 mRNA无明显改变。见图2。
3.3丹参素增强原代成骨细胞ALP的活性 ALP是成骨细胞分化的标志物。ALP染色结果发现,1和10 μmol·L-1丹参素处理组细胞质蓝染较深且阳性部位较多。结果表明,1和10 μmol·L-1丹参素处理组细胞ALP染色强度均明显高于丹参素未处理组,见图3。提示ALP的活性随丹参素浓度的升高而增强。
3.4丹参素促进成骨细胞钙化 细胞培养21 d后,茜素红染色结果显示,丹参素未处理组细胞未见钙化结节形成。而1和10 μmol·L-1丹参素处理组成骨细胞可见大量矿化结节,见图3。研究结果表明,一定浓度的丹参素能够促进成骨细胞分化并形成钙化结节。

图2不同浓度丹参素对Runx2和OsteorixmRNA表达的影响
注:*P<0.05,**P<0.01。
Fig.2 Effect of different concentration of tanshinol on Runx2 and Osteorix mRNA expression
Note:*P<0.05,**P<0.01.

图3成骨细胞染色结果
Ⅰ.ALP染色;Ⅱ.茜素红染色。A.0 μmol·L-1丹参素处理组(×40);B.0.1 μmol·L-1丹参素处理组(×40);C.1 μmol·L-1丹参素处理组(×40);D.10 μmol·L-1丹参素处理组(×40)。
Fig.3 Staining results of osteoblastic cell
Ⅰ.ALP staining;Ⅱ.ARS staining.A.0 μmol·L-1tanshinol-treated group (×40);B.0.1 μmol·L-1tanshinol-treated group (×40);C.1 μmol·L-1tanshinol-treated group (×40);D.10 μmol·L-1tanshinol-treated group (×40).
3.5Wnt/β-catenin通路活化参与丹参素对成骨细胞的分化调控 文献报道,Wnt/β-catenin信号通路在调节成骨细胞分化及骨形成过程中具有重要作用[12]。β-catenin由胞浆移至核内是这一信号通路活化的重要环节[13]。原代成骨细胞在不同条件培养基中培养48 h后,收集细胞,提取核蛋白。Western Blotting检测结果显示,1和10 μmol·L-1丹参素处理组成骨细胞β-catenin的核内表达量明显高于丹参素未处理组(P<0.05),见图4A和4B。KYA1797K是有效的、高度选择性的Wnt/β-catenin抑制剂[14]。丹参素处理成骨细胞前10 min,在细胞培养基中加入KYA1797K (0.1 μmol·L-1)。分析KYA1797K联合丹参素共同处理组和丹参素单独处理组中成骨细胞分化基因Runx2的mRNA表达。结果发现,与丹参素单独处理组相比,Runx2基因mRNA表达水平在KYA1797K联合丹参素共同处理组细胞中明显降低(P<0.05)。结果表明,Wnt/β-catenin通路参与丹参素对成骨细胞分化过程的调控,见图4C。
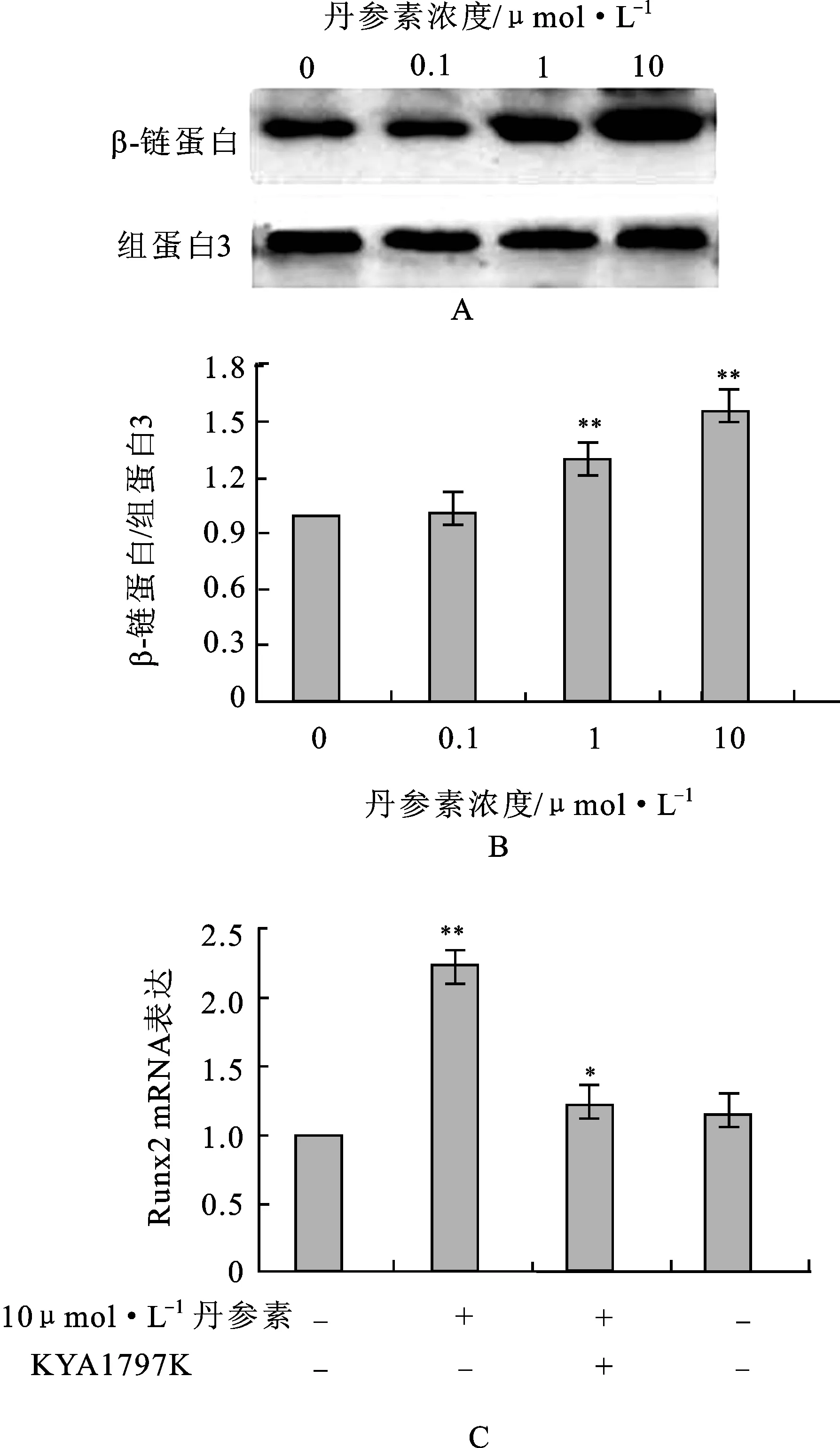
图4Wnt/β-catenin通路活化参与丹参素对成骨细胞的分化调控
A.β-catenin免疫印迹代表图;B.β-catenin免疫印迹统计结果;C.不同处理条件下Runx2的mRNA表达。*P<0.05,
**P<0.01。
Fig.4 Activation of Wnt/β-catenin pathway was involved in the effect of tanshinol on osteoblastic cell differentiation
A.representative Western blotting ofβ-catenin;B.statistic result on Western blotting data ofβ-catenin;C.Runx2 mRNA expression on different culture condition.*P<0.05,**P<0.01.
4 讨论
丹参是被广泛应用的一味中药,具有抗氧化、改善微循环、防止血栓形成等多种功能[6,15]。近年来研究发现,丹参能够促进骨愈合,对预防股骨头坏死及治疗骨质疏松有很好的功效[7]。SD大鼠模型已证实丹参提取物能有效治疗由糖皮质激素引起的骨质疏松症[8]。体外实验也已证实丹参注射液能够增强小鼠成骨细胞ALP的活性以及抑制小鼠破骨细胞的生成[16]。
丹参素是中药丹参的主要水溶性提取物之一。崔燎等[8]在对比研究丹参提取物和丹参素对体外培养成骨细胞ALP活性的影响时发现,丹参提取物的作用与丹参素作用一致,因此推测丹参提取物的作用成分很可能就是丹参素[7,17]。在本研究中,我们用大鼠原代成骨细胞为模型,多指标综合观察丹参素对体外培养大鼠成骨细胞分化的影响。Runx2和Osterix是成骨细胞早期分化的标志性基因[18]。Real-time PCR检测结果显示,一定浓度的丹参素能够促进Runx2和Osterix的 mRNA表达,说明丹参素具有促进成骨细胞早期分化的作用。ALP是促进骨间质矿化的重要酶,能够促进局部钙、磷浓度升高,有助于骨的钙化。ALP活性反映成骨细胞的分化状态[19]。研究发现,丹参素能够增强原代成骨细胞ALP的活性,且这种增强作用具有剂量依赖性,ALP活性随丹参素浓度的升高而提高。钙盐沉积导致钙化结节形成是成骨细胞分化至中晚期的主要指标。在诱导分化3周后,我们用茜素红染色法证实,丹参素能够促进成骨细胞分化形成钙化结节。成骨细胞分化是多因子、多通路参与的复杂过程。Wnt/β-catenin是调节成骨细胞分化及骨形成中的一条重要信号通路[12]。当Wnt信号通路活化时,胞质内β-catenin由胞浆转运至胞核,进而调控下游成骨细胞分化基因转录和表达[13,20]。我们用Western Blotting实验证实,丹参素处理组成骨细胞β-catenin的细胞核内表达量明显高于对照组,提示丹参素通过激活Wnt/β-catenin通路促进成骨细胞分化。应用Wnt/β-catenin信号通路抑制剂进一步证实,抑制Wnt/β-catenin通路活化能够抑制丹参素对成骨细胞分化的调控。
成骨细胞的骨形成与破骨细胞的骨吸收两者间保持动态平衡是维持骨正常状态的基础。增强成骨细胞分化是抑制骨质疏松的重要手段。本研究证实,一定浓度的丹参素可有效促进成骨细胞的分化;且丹参素促进成骨细胞的分化与激活Wnt/β-catenin通路有关。本研究为阐明丹参素是否具有抗骨质疏松作用提供了新的实验依据。
