两色金鸡菊提取物中3种黄酮苷在大鼠胃肠道的水解代谢研究
2018-09-20韩海霞朱金芳蒋惠娣
韩海霞,朱金芳,王 娟,蒋惠娣
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052;2.浙江大学药学院,杭州 310058)
两色金鸡菊为菊科(Compositae)金鸡菊属植物两色金鸡菊(CoreopsistinctoriaNutt.)的干燥头状花序,以新疆南疆的和田地区为其主要生产区。《新华本草纲要》记载:两色金鸡菊,味甘、性平,归肝、大肠经,功效清热解毒、化湿止痢[1-2]。现代药效学研究表明,两色金鸡菊提取物具有降血压[3]、降血脂[4]、抗炎[5]、降血糖[6]和心肌保护[7]等作用,其化学成分主要以黄酮类化合物为主[8-9],本研究已从中分离鉴定出马里苷(CCT-1)、异奥卡宁-7-O-β-D-吡喃葡萄糖苷(CCT-2)和花旗松素-7-O-β-D-吡喃葡萄糖苷(CCT-3)等黄酮苷类物质[10],结构见图1。
很多黄酮苷类物质可被胃肠道菌群中的酶水解代谢生成苷元,并发挥药理作用[11-12],也是导致某些黄酮类物质的吸收和生物利用度低的重要原因[13]。但这些代谢酶在胃肠道各段组织中分布不同,具有底物选择性,所以糖种类、苷元类型和糖苷键的位置在很大程度上导致黄酮苷代谢的差异[14-15]。两色金鸡菊提取物中3个黄酮苷CCT-1、CCT-2和CCT-3含量依次为18.3%,7.6%和1.8%,且均被证明具有显著抗氧化活性[16],CCT-1还被证明是两色金鸡菊防治糖尿病的重要成分[17-18]。本文建立此3种黄酮苷的苷元(奥卡宁、异奥卡宁和花旗松素)的HPLC测定方法,应用胃肠道组织提取物体外孵育法,测定三者的质量浓度,研究两色金鸡菊中3种黄酮苷在肠道是否发生水解代谢及代谢程度。
1 仪器与试药
1.1仪器 1260型液相色谱仪(美国安捷伦公司);Centrifuge 5415 R型低温离心机(德国Eppendorf公司);IKAT10 basic型电动组织匀浆机(德国IKA公司);AL104-S电子分析天平,320 pH计(瑞士Mettler Toledo公司);GBL-88B涡旋震荡仪(海口其林贝尔仪器制造有限公司);HH-2型数显恒温水浴锅(国华电器有限公司)。
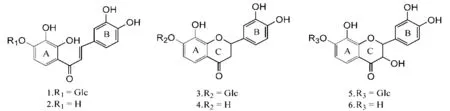
图1黄酮苷及其苷元的化学结构
1.马里苷(CCT-1);2.奥卡宁;3.异马里苷(CCT-2);4.异奥卡宁;5.花旗松素-7-O-β-D-吡喃葡萄糖苷(CCT-3);6.花旗松素。
Fig.1 The chemical structures of flavonoid glycosides and their aglycones
1.marein (CCT-1);2.okanin;3.flavanomarein (CCT-2);4.isookanin;5.taxifolin-7-O-β-D-glucopyranoside (CCT-3);6.taxifolin.
1.2试药 CCT-1、CCT-2、CCT-3、奥卡宁和异奥卡宁(均为实验室自制,经UV法、1H-NMR法、13C-NMR法和 Q-TOF法结构鉴定,并应用HPLC法测定质量分数均≥98.5%);花旗松素(质量分数为98%,HPLC级,南京苏郎生物科技有限公司);甲醇为色谱纯(上海阿拉丁生化科技股份有限公司);乙腈为色谱纯(美国天地有限公司);其他试剂均为分析纯。
2 方法与结果
2.13种黄酮苷元的对照品溶液和质控溶液 精密称取奥卡宁、异奥卡宁和花旗松素适量,用DMSO溶解,分别配制成质量浓度均为30.0 mg·mL-1的储备液;精密移取适量储备液混合,用体积分数为50%的甲醇逐步稀释得到质量浓度分别为0.15,0.3,0.6,2.4,9.6和19.2 g·mL-1的对照品溶液;同法制得质量浓度分别为0.15,0.3,9.6和15.0 g·mL-1的质控溶液。
2.2色谱条件 色谱柱为Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm);以1 mL·L-1甲酸(A)-乙腈(B)为流动相,梯度洗脱(0~2.5 min,10%B~16.5%B;2.5~5.0 min,16.5%B~34%B;5.0~5.1 min,34%B~50%B;5.1~7.0 min,50%B~50%B;7.0~7.1 min,50%B~16%B;7.1~10 min,16%B~16%B);柱温:30 ℃;检测波长:380 nm(CCT-1,奥卡宁)、284 nm(CCT-2,异奥卡宁;CCT-3,花旗松素);流速:1.0 mL·min-1;进样体积:5 μL;分析时间:10 min。
2.3大鼠胃肠道组织提取物的制备 大鼠断头处死,迅速取出胃、十二指肠、空肠、回肠、结肠和盲肠,用生理盐水冲洗,加磷酸盐缓冲溶液 (10 mmol·L-1,pH值为7.0),制备匀浆,匀浆液离心,上清液即为组织提取物,分装后于-80 ℃保存备用。BCA法测定蛋白质量浓度[19]。
2.4黄酮苷在组织提取物中的孵育 取适量组织提取物与磷酸盐缓冲溶液,混匀,加黄酮苷溶液适量,反应终体系为100 μL(甲醇含量不得超过1%),于37 ℃孵育。加乙腈200 μL,涡旋,离心,取上清液100 μL,进样,用于HPLC分析。
2.5CCT-1、CCT-2和CCT-3去糖基代谢率的计算 以胃肠道组织提取物孵育液中测得的黄酮苷元质量浓度换算发生去糖基代谢的黄酮苷质量浓度,求得黄酮苷去糖基代谢率(%)=Ci/C0×100%,Ci为发生去糖基代谢的黄酮苷质量浓度,C0为反应体系中加入的黄酮苷初质量浓度。
2.6HPLC方法学考察
2.6.1奥卡宁、异奥卡宁和花旗松素在孵育体系中的选择性 见图2。由图2可知,在本色谱条件下,在380 nm波长处检测奥卡宁,在284 nm波长处检测异奥卡宁和花旗松素,三者峰形良好,孵育体系中相关物质不干扰三者测定,奥卡宁、异奥卡宁和花旗松素的出峰时间依次为7.1,6.3和6.5 min。
2.6.2奥卡宁、异奥卡宁和花旗松素在组织提取液中的标准曲线和线性关系 按照2.1和2.4项下方法进行操作,取上清液进行HPLC分析,各质量浓度进行3样本分析,记录色谱图。以分析物的质量浓度为横坐标(x)、分析物的峰面积为纵坐标(y),进行回归运算,制得标准曲线。结果表明,奥卡宁、异奥卡宁和花旗松素均在0.15~19.2 μg·mL-1范围内线性良好(r≥0.999)。
2.6.3奥卡宁、异奥卡宁和花旗松素在组织提取液中的回收率 按照2.1项下方法配制奥卡宁、异奥卡宁和花旗松素的质控溶液,按照2.4项下方法处理样品溶液,取上清液进行HPLC分析,各质量浓度进行5次样本分析,记录色谱图中奥卡宁、异奥卡宁和花旗松素的峰面积Ai,另取以初始流动相直接配制相同理论质量浓度的奥卡宁、异奥卡宁和花旗松素溶液,同法进样,记录峰面积A0,绝对回收率=Ai/A0×100%。结果表明,奥卡宁、异奥卡宁和花旗松素在组织提取液中的绝对回收率在85.1%~100.7%之间。
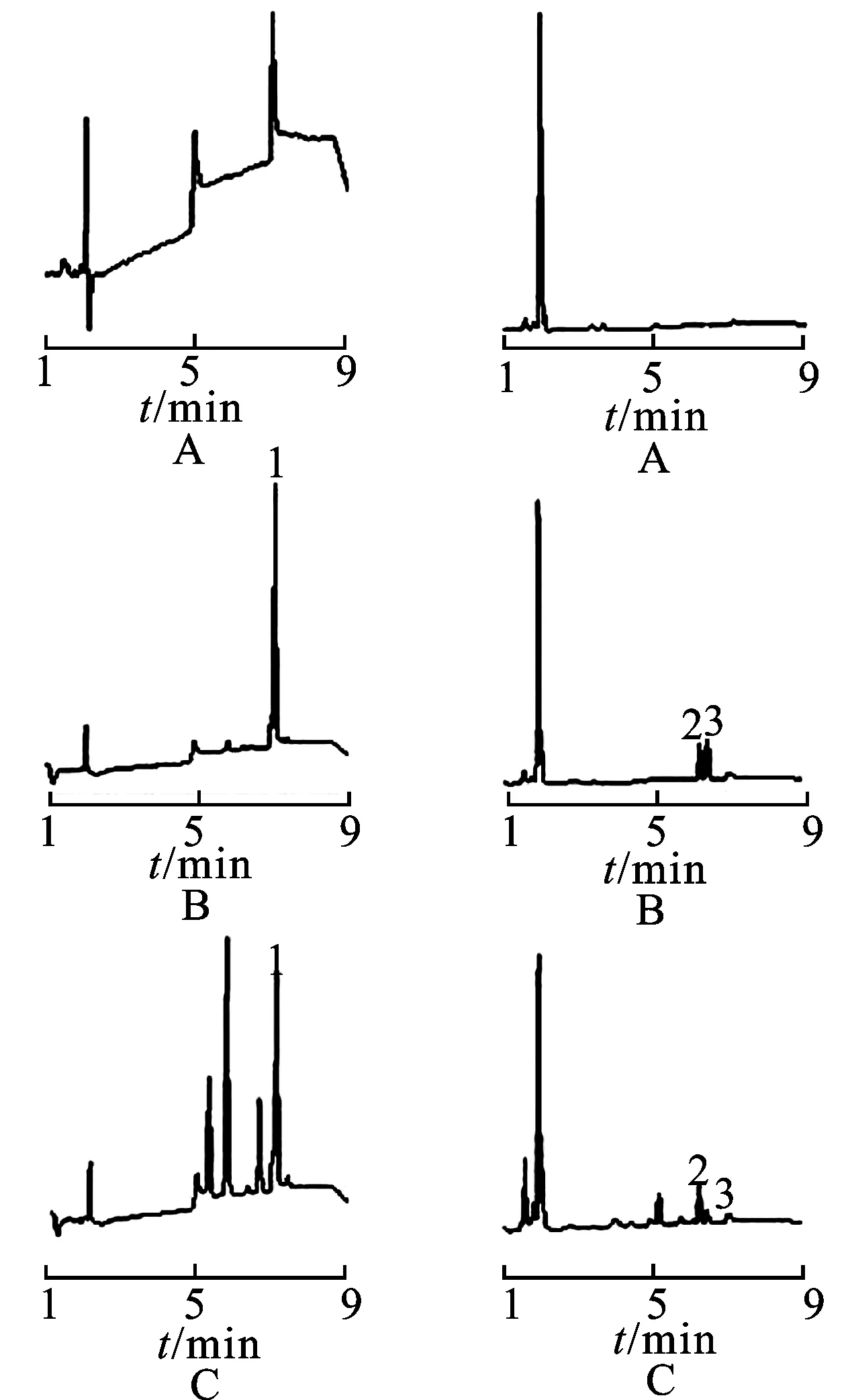
图2组织提取液中奥卡宁、异奥卡宁、花旗松素的HPLC图
A.空白样品;B.对照样品;C.被测样品;1. 奥卡宁; 2.异奥卡宁; 3.花旗松素。
Fig.2 HPLC chromatograms of okanin,isookanin,taxifolin in cell free fractions
A.blank; B.control samples; C.measured samples;1.okanin; 2.isookanin; 3.taxifolin.
2.6.4奥卡宁、异奥卡宁和花旗松素在组织提取液中的精密度 按照2.6.3项下方法操作,各质量浓度进行5次样本分析。将奥卡宁、异奥卡宁和花旗松素的峰面积代入标准曲线。结果表明,日内精密度(RSD)在1.4%~12.8%之间,日间精密度(RSD)在1.8%~14.7%之间,表明该方法精密度符合要求。
2.7孵育体系中底物质量浓度、酶质量浓度及孵育时间的选择 见图3。由图3A可知,质量浓度为4.5~144.0 μg·mL-1CCT-1、CCT-2、CCT-3与蛋白质量浓度为1.5 mg·mL-1的组织提取物孵育30 min,产生的奥卡宁、异奥卡宁和花旗松素随底物质量浓度的增加而增加。因此,本实验选择底物质量浓度为36.0 μg·mL-1。由图3 B可知,酶蛋白质量浓度在0.75~1.5 mg·mL-1范围内与CCT-1、CCT-2和CCT-3孵育30 min,产生的奥卡宁、异奥卡宁和花旗松素质量浓度呈线性上升趋势,因此,选择酶质量浓度为1.5 mg·mL-1。由图3C可知,酶蛋白溶液与CCT-1、CCT-2和CCT-3孵育20~45 min,产生的奥卡宁、异奥卡宁和花旗松素呈线性增加,因此确定孵育时间为45 min。
2.8大鼠胃肠道不同部位对黄酮苷水解代谢的影响 在2.7项下优化的孵育条件下,考察黄酮苷在大鼠胃肠道不同部位提取物中的水解代谢率。结果见图4。CCT-1、CCT-2和CCT-3在大鼠小肠提取物中均能发生水解代谢,生成相应的苷元奥卡宁、异奥卡宁和花旗松素,但在胃、结肠和盲肠中不能发生水解代谢。CCT-1、CCT-2和CCT-3在空肠和回肠中的去糖基代谢率高于十二指肠中的代谢率,分别为61.8%~64.8%,29.7%~35.3%和13.7%~20.5%。
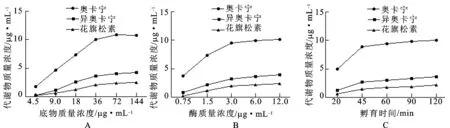
图3孵育体系中底物质量浓度(A)、酶质量浓度(B)及孵育时间(C)对黄酮苷水解代谢的影响(n=3)
Fig.3 Effect of substrate concentration (A),protein concentration (B) and incubated time (C) on the hydrolyzed metabolism of flavone glycosides in incubation system (n=3)
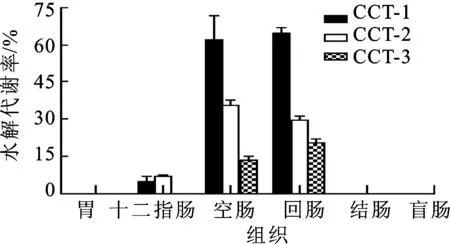
图4CCT-1、CCT-2和CCT-3在大鼠胃肠道组织提取物中的代谢率(n=6)
Fig.4 Hydrolyzation ratio of CCT-1,CCT-2 and CCT-3 in cell-free extract from rat gastrointestinal tract (GIT)(n=6)
3 讨论
文献报道,黄酮苷元母核类型、糖类型、糖与苷元连接的位置与数量等均可影响黄酮苷去糖基代谢的程度[14]。CCT-1、CCT-2和CCT-3基本母核分别属于查尔酮类(CCT-1)、二氢异黄酮类(CCT-2)和黄酮醇类(CCT-3)。由去糖基代谢实验结果可知,3个黄酮苷在胃肠道中的去糖基代谢程度有很大差异,在大鼠组织提取物中,去糖基代谢程度由高到低依次为CCT-1>CCT-2>CCT-3,这可能是由肠道酶对3种黄酮苷的去糖基代谢具有底物选择性所致。有研究报道,落新妇苷(花旗松素-3-O-鼠李糖苷)口服给药后,血浆中并未检测到其苷元花旗松素[20],而本文证实CCT-3(花旗松素-7-O-葡萄糖苷)能在胃肠道发生去糖基代谢,异槲皮苷(槲皮素-3-O-葡萄糖苷)能在胃肠道去糖基代谢生成异槲皮素而吸收,而金丝桃苷(槲皮素-3-O-半乳糖苷)却以糖苷的形式吸收入血[15],这些都验证了去糖基代谢酶的底物选择性。本研究体外孵育实验表明,两色金鸡菊中CCT-1、CCT-2和CCT-3均可被胃肠道黏膜水解酶代谢为相应苷元,CCT-1的去糖基代谢程度最大,最弱的是CCT-3,提示两色金鸡菊进入体内后,其苷和水解代谢生成的苷元均有可能为有效成分之一,该结果为两色金鸡菊药效物质基础的研究提供理论依据。
