槲皮素对非对称性二甲基精氨酸诱导损伤的脑血管内皮细胞的保护作用及其机制研究
2019-08-28任锟李彦杰邢若星赵晶张志鑫
任锟 李彦杰 邢若星 赵晶 张志鑫
缺血性脑血管病是严重危害人类生命健康的常见病和多发病。研究表明内皮功能障碍是缺血性脑血管病发病的早期事件[1]。非对称性二甲基精氨酸 (asymmetric dimethylarginine,ADMA)是一种一氧化氮合成酶的内源性抑制剂,血清中ADMA水平升高可降低一氧化氮的生物利用度,诱发内皮功能障碍。有研究结果显示,ADMA对内皮细胞氧化应激反应具有促进作用[2],血清ADMA水平升高可诱导血管发生炎性反应[3],加速脑血管疾病的进程。因此,抑制ADMA诱导的内皮细胞损伤和氧化应激可能是缺血性脑血管病的一个有效治疗靶点。
槲皮素是一种天然的黄酮类化合物,存在于多种植物的花、叶、果实中,具有抗氧化、抗炎、抑制新生血管生成等作用[4]。研究表明,槲皮素能抑制牙龈上皮细胞内多种炎性因子的表达,增加小鼠视网膜中的抗氧化物质以减轻糖尿病视网膜氧化应激状态,通过抗内质网应激、抗凋亡的机制发挥心血管保护作用[5-8]。但是,槲皮素对脑缺血性损伤是否也具有保护作用及其作用机制相关报道较少。
笔者通过建立ADMA诱导人脑血管内皮细胞(human brain microvascular endothelial cells,HBMECs)氧化应激损伤模型,模拟缺血性脑血管病发生后血管内皮细胞的损伤,分析槲皮素对损伤后脑血管内皮细胞的保护作用,并进一步探讨其作用机制,从而为缺血性脑血管病的临床治疗提供理论依据。
1 材料与方法
1.1 材料
HBMEC细胞株(上海中乔新舟生物科技有限公司);RPMI 1640培养液(批号:8116492,GIBCO公司,美国);胎牛血清(批号:111005,杭州四季青公司);3-(4,5-二里基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT;Sigma公司,美国];兔抗人Bcl-2、Bax、p38、磷酸化p38(phosphorylated p38,p-p38)、c-Jun氨基末端激酶 (c-Jun N-terminal kinase,JNK)、磷酸化JNK(phosphorylated JNK,p-JNK)、β-actin抗体(Abcam 公司,美国);茴香霉素(anisomycin,ANISO)和 P79350(Calbiochem公司,美国);槲皮素(批号:008129304,中国药品生物制品检定所); ADMA和caspase-3检测试剂盒(Sigma公司,美国);乳酸脱氢酶(lactate dehydrogenase,LDH;批号:201706002)、超氧化物歧化酶(superoxide dismutase,SOD;批号:165857049)、活性氧(批号:146994049)、丙二醛(批号:20170117)、脑源性神经营养因子 (brain derived neurotrophic factor,BDNF;批号:20170817)检测试剂盒(南京建成生物科技有限公司)。
1.2 方法
1.2.1实验分组:RPMI 1640培养液(含10%胎牛血清、1%双抗)在37 ℃、5% CO2培养箱中常规培养细胞。取对数期生长的HBMECs接种于96孔板进行实验,每孔200 μl,约含2×104个细胞。第一部分实验分组如下:对照组(不加任何干预因素),ADMA组(在细胞培养体系中加入终浓度为30 μmol/L的ADMA作用24 h),ADMA+槲皮素处理组(加入终浓度分别为0.1、1、10、100 μmol/L的槲皮素预处理2 h后再加入终浓度为30 μmol/L 的ADMA作用24 h),100 μmol/L槲皮素处理组(100 μmol/l的槲皮素预处理2 h后换常规培养液),每组6个样本;第二部分实验分组如下:对照组(不加任何干预因素),ADMA组(在细胞培养体系中加入终浓度为30 μmol/L的ADMA作用24 h),ADMA+槲皮素处理组(加入终浓度为10 μmol/L的槲皮素预处理2 h后再加入终浓度为30 μmol/L的ADMA作用24 h),10 μmol/L槲皮素处理组(10 μmol/L的槲皮素预处理2 h后换常规培养液),ANISO/P79350+ADMA+槲皮素处理组(加入终浓度为10 μmol/L的槲皮素预处理2 h后再加入终浓度为30 μmol/L的ADMA作用24 h,实验结束前1 h加入10 μmol/L的ANISO或50 μmol/L的P79350),ANISO/P79350处理组(常规培养液培养,实验结束前1 h加入10 μmol/L的NAISO或50 μmol/L的P79350),每组6个样本。
1.2.2MTT法检测细胞存活情况:所有组细胞经相应处理后加入MTT溶液(5 g/L)10 μl,孵育4 h后吸出上清液,加入二甲基亚砜,震荡后,酶标仪490 nm处检测吸光度(A值)。每组设置6个复孔。
1.2.3酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测LDH、SOD、活性氧、丙二醛、BDNF水平:将所有组细胞接种于24孔板(5×104个/孔),相应药物处理后,收集上清液,ELISA法检测LDH、SOD、活性氧、丙二醛、BDNF的浓度。具体操作依据试剂盒说明书进行。每组设置6个复孔。
1.2.4Western blotting分析:采用0.05%胰蛋白酶消化第二部分实验分组各组细胞,磷酸盐缓冲液洗涤3次;常规方法裂解细胞,二喹啉甲酸法蛋白定量,聚丙烯酰胺凝胶电泳;转膜后,用5%脱脂奶粉封闭,洗膜3次,加入兔抗人Bcl-2、Bax、p38、p-p38、JNK、p-JNK、β-actin抗体,4 ℃孵育过夜,洗膜后加入辣根过氧化物酶标记的羊抗兔二抗,电化学发光法显色,Scion Image图像分析系统检测条带,蛋白相对表达量以目的蛋白与β-actin条带灰度比值表示。以JNK和p38蛋白磷酸化水平来衡量JNK/p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)信号通路活性。每个蛋白重复检测3次。
1.2.5逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)检测Bax、Bcl-2和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)基因表达水平: 对于第二部分实验分组各组,PCR扩增引物应用在线软件设计后交由上海生物工程有限公司合成,实验过程依据逆转录反应试剂盒说明进行,Bax上游引物为5′- TCATGGGCTGGACATTGGAC-3′,下游引物为5′- GAGACAGGGACATCAGTCGC-3′;Bcl-2上游引物为5′-TTCTTTGAGTTCGGTGGGGTC-3′,下游引物为5′-TGCATATTTGTTTGGGGCAGG-3′;eNOS上游引物为5′-CTTCAAGTTGCCCAT-3′,下游引物为5′-ATGGGCAACTTGAAG-3′;β-actin上游引物为5′-ACTCGTCATACTCCTGCT-3′,下游引物为5′-GAAACTACCTTCAACTCC-3′。每个基因重复检测3次。
1.2.6caspase-3活性检测(分光光度法):常规方法胰酶消化第二部分实验分组各组贴壁细胞,收集细胞,磷酸盐缓冲液洗涤,弃上清,以每2×106细胞50 μl裂解液的比例加入裂解液,重悬沉淀,冰浴裂解30 min。12 000 r/min(离心半径10 cm),4 ℃离心10~15 min,小心吸取上清,放置冰上待用,检测方法依据试剂盒说明书进行,每个实验组设置6个复孔。
1.3 统计学分析

2 结果
2.1 槲皮素对ADMA诱导的细胞活性及功能的影响
细胞活性检测结果显示:与对照组比较,ADMA组HBMECs活性明显降低,LDH水平明显升高,HBMECs上清液中BDNF浓度明显减低,差异均有统计学意义(均P<0.05) ,而100 μmol/L槲皮素处理组HBMECs活性和LDH、BDNF浓度差异均无统计学意义(均P>0.05);与ADMA组比较,ADMA+1 μmol/L槲皮素处理组、ADMA+10 μmol/L槲皮素处理组和ADMA+100 μmol/L槲皮素处理组细胞LDH水平均明显降低,BDNF水平均明显增高,ADMA+10 μmol/L槲皮素处理组和ADMA+100 μmol/L槲皮素处理组HBMECs活性均明显增高,差异均有统计学意义(均P<0.05);与ADMA+0.1 μmol/L槲皮素处理组比较,ADMA+10 μmol/L槲皮素处理组和ADMA+100 μmol/L槲皮素处理组细胞活性和BDNF水平均明显升高,LDH水平均明显降低,差异均有统计学意义(均P<0.05);与ADMA+1 μmol/L槲皮素处理组比较,ADMA+10 μmol/L槲皮素处理组和ADMA+100 μmol/L槲皮素处理组LDH水平均明显降低,BDNF水平明显增高,ADMA+100 μmol/L槲皮素处理组HBMECs活性明显增高,差异均有统计学意义(均P<0.05)。见表1。
2.2 槲皮素对ADMA诱导的细胞凋亡的影响
与对照组比较,ADMA组HBMEC中Bcl-2 mRNA水平明显降低,Bax mRNA表达水平和caspase-3活性明显增加,差异均有统计学意义(均P<0.05)。与ADMA组比较,ADMA+槲皮素处理组和10 μmol/L槲皮素处理组的Bcl-2 mRNA水平均明显升高,Bax mRNA表达水平和caspase-3活性均明显减低,差异均有统计学意义(均P<0.05,表2,图1)。
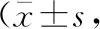
表1 槲皮素对ADMA诱导的HBMECs细胞活性 及LDH、BDNF水平的影响以对照组为参照)
注:ADMA为非对称性二甲基精氨酸,HBMECs为人脑血管内皮细胞,LDH为乳酸脱氢酶,BDNF为脑源性神经营养因子;与对照组比较,aP<0.05;与ADMA组比较,bP<0.05;与ADMA+0.1 μmol/L槲皮素处理组比较,cP<0.05;与ADMA+1 μmol/L槲皮素处理组比较,dP<0.05;与ADMA+10 μmol/L槲皮素处理组比较,eP<0.05;与ADMA+100 μmol/L槲皮素处理组比较,fP<0.05
表2 槲皮素对ADMA诱导的HBMECs细胞凋亡 相关基因/蛋白的影响以对照组为参照)
注:ADMA为非对称性二甲基精氨酸,HBMECs为人脑血管内皮细胞;A组为ADMA+槲皮素处理组,B组为10 μmol/L槲皮素处理组;与对照组比较,aP<0.05;与ADMA组比较,bP<0.05
2.3 槲皮素对ADMA诱导的氧化应激的影响
与对照组比较,ADMA组HBMECs的活性氧、丙二醛水平明显升高,SOD和eNOS mRNA表达明显下降,差异均有统计学意义(均P<0.05);与ADMA组比较,ADMA+槲皮素处理组和10 μmol/L槲皮素处理组活性氧、丙二醛水平明显降低,SOD和eNOSmRNA明显升高,差异均有统计学意义(均P<0.05,表3)。


表3 槲皮素对ADMA诱导的HBMECs细胞氧化/ 抗氧化因子水平的影响以对照组为参照)
注:ADMA为非对称性二甲基精氨酸,HBMECs为人脑血管内皮细胞,SOD为超氧化物歧化酶,eNOS为内皮型一氧化氮合酶;A组为ADMA+槲皮素处理组,B组为10 μmol/L槲皮素处理组;与对照组比较,aP<0.05;与ADMA组比较,bP<0.05
2.4 槲皮素抑制JNK/p38 MAPK 信号通路活性
与对照组比较,ADMA组JNK和p38磷酸化水平明显增高(均P<0.05);与ADMA组比较,ADMA+槲皮素处理组JNK和p38磷酸化水平明显降低(均P<0.05);与ADMA+槲皮素处理组比较,ANISO+ADMA+槲皮素处理组JNK磷酸化水平和P79350+ADMA+槲皮素处理组p38磷酸化水平均明显增高,差异均有统计学意义(均P<0.05,图2,表4)。
进一步检测细胞活性及功能,结果显示:与对照组比较,ADMA组细胞活性和BDNF水平明显降低,LDH水平明显增加,差异均有统计学意义(均P<0.05)。
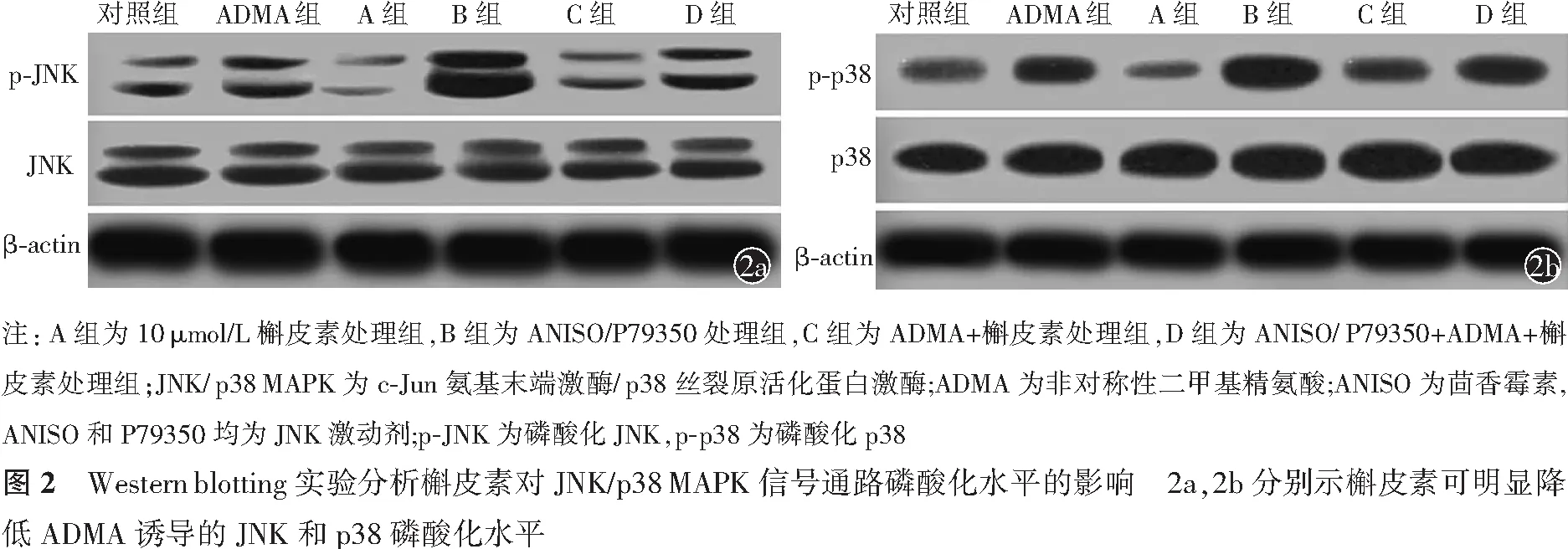

表4 槲皮素对JNK/p38 MAPK信号通路磷酸化 水平的影响以对照组为参照)
注: JNK/p38 MAPK为c-Jun氨基末端激酶/p38丝裂原活化蛋白激酶,ADMA为非对称性二甲基精氨酸;ANISO为茴香霉素,ANISO和P79350均为JNK激动剂;p-JNK为磷酸化JNK,p-p38为磷酸化p38;与对照组比较,aP<0.05;与ADMA组比较,bP<0.05;与ADMA+槲皮素处理组比较,cP<0.05;“-”表示无相关数据
与ADMA组比较,ADMA+槲皮素处理组细胞活性和BDNF水平明显增加,LDH水平明显减少,差异均有统计学意义(均P<0.05)。与ADMA+槲皮素处理组比较,ANISO+ADMA+槲皮素处理组和P79350+ADMA+槲皮素处理组细胞活性和BDNF水平明显降低,LDH水平明显增加,差异均有统计学意义(均P<0.05,表5)。
3 讨论
缺血性脑血管疾病发病机制错综复杂,内皮功能障碍在疾病的发生中起重要作用。有研究表明,某些心血管疾病的内皮功能障碍与血浆ADMA水平升高有关[9]。因此,保护内皮细胞免受ADMA诱导的损伤可能是防止缺血性脑血管损伤的有效治疗靶点。本研究中,在30 μmol/L ADMA预处理HBMECs 24 h后,细胞损伤明显,LDH释放增加,细胞活性降低,BDNF浓度降低,槲皮素能够以剂量依赖的方式显著降低ADMA诱导的LDH升高,促进细胞活力,改善细胞功能。

表5 槲皮素对ADMA诱导的HBMECs细胞活性的 影响以对照组为参照)
注:ADMA为非对称性二甲基精氨酸,HBMECs为人脑血管内皮细胞;ANISO为茴香霉素,ANISO和P79350均为JNK激动剂;LDH为乳酸脱氢酶,BDNF为脑源性神经营养因子;与对照组比较,aP<0.05;与ADMA组比较,bP<0.05;与ADMA+槲皮素处理组比较,cP<0.05
氧化应激是诱导内皮细胞凋亡的重要刺激因子之一,在内皮功能障碍的发病机制中起着重要作用[10]。活性氧的过度生成是氧化应激开始的标志之一[11]。有研究表明,ADMA可浓度依赖性地增加内皮细胞活性氧产生[12]。本研究中,ADMA能显著促进HBMEC活性氧的产生,下调eNOS的表达和SOD的浓度。槲皮素预处理可显著降低活性氧的产生,增强eNOS mRNA的表达水平,促进SOD的释放,减轻ADMA所引起的氧化应激。同时,槲皮素预处理还可以有效降低ADMA诱导的脂质过氧化,下调细胞上清液中丙二醛水平[13]。进一步对细胞凋亡相关蛋白Bcl-2、Bax、caspase-3的检测结果显示,ADMA可显著抑制细胞Bcl-2 mRNA表达,促进Bax mRNA表达,上调caspase-3活性,进而诱导细胞凋亡,而槲皮素可明显抑制这一作用。该结果提示槲皮素可通过抗氧化机制,发挥对ADMA诱导下损伤的脑血管内皮细胞的保护作用。
MAPKs家族可同时对丝氨酸和酪氨酸残基进行磷酸化,其经典的信号通路包括细胞外信号调节激酶、JNK和p38 MAPK。MAPKs可对多种刺激作出反应并参与细胞的凋亡[14]。研究结果表明,氧化应激/活性氧水平的增加可激活JNK/p38 MAPK信号,进而诱导缺血-再灌注损伤和糖尿病的发生[15-16]。本研究中,ADMA刺激可促进脑血管内皮细胞中JNK和p38 MAPK的磷酸化,而槲皮素预处理可抑制JNK和p38 MAPK信号的激活,应用JNK激动剂ANISO或p38 MAPK激动剂P79350预处理可显著抵消槲皮素的抗氧化作用。这些结果提示槲皮素可能是通过调节JNK/p38 MAPK信号通路来对ADMA刺激下的HBMECs起保护作用。
综上所述,槲皮素能够缓解氧化应激条件下脑血管内皮细胞的损伤,其抗氧化作用机制可能与JNK/p38 MAPK信号通路的抑制有关。
