泽泻与复方花旗泽仁给药后泽泻醇A-24-醋酸酯 在大鼠体内的比较药代动力学研究
2018-09-20李嘉欣韩东卫朱蕾葛鹏玲
李嘉欣,韩东卫,朱蕾,葛鹏玲
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
花旗泽仁是临床治疗2型糖尿病胰岛素抵抗(IR)的经验方。泽泻为本方主要药物之一,具有利水、渗湿、泄热之功。泽泻醇A-24-醋酸酯为泽泻的主要活性成分之一,具有明显的利尿、降血糖、降血脂及抗动脉粥样硬化、抗脂肪肝、免疫调节等功效[1-5]。
本研究基于HPLC-MS/MS技术,建立灵敏而可靠的方法检测花旗泽仁中主要活性成分——泽泻醇A-24-醋酸酯的血浆药物浓度,研究正常大鼠灌胃花旗泽仁全方及单味药泽泻水煎液后的药代动力学过程;比较复方花旗泽仁及单味药泽泻中泽泻醇A-24-醋酸酯在大鼠体内的药动学差异。揭示配伍用药后复方中其他成分对泽泻醇A-24-醋酸酯在大鼠体内药代动力学过程的影响,为进一步研究花旗泽仁的体内代谢和配伍规律奠定基础。
1 实验材料
1.1 药品及试剂
西洋参、泽泻、薏苡仁饮片(黑龙江省世一堂中药饮片厂);泽泻醇A-24-醋酸酯标准品(成都MUST生物技术有限公司);地西泮标准品(中国药品生物制品检定所)。
1.2 仪器
液相色谱/四级杆-飞行时间串联液质联用仪(美国Agilent公司);VORTEX-GENIE 2涡旋混合仪(美国Scientific公司);Centrifuge 5417R低温高速冷冻离心机(德国Eppendorf AG公司)。
1.3 实验动物
清洁级Sprague-Dawley(SD)大鼠12只,雄性,3月龄,体质量(200±20)g,由黑龙江中医药大学实验动物中心提供,动物合格证号:SCXK(黑)2013-004。实验动物适应性喂养1周,明暗周期12 h,房间温度(20±2)℃,相对湿度50%左右,空气新鲜,通风良好,勤换垫料,自由摄食和饮水。
2 实验方法
2.1 花旗泽仁水煎液的制备
取花旗泽仁中各药材,浸泡12 h,第1次加12倍水煎煮,水沸后文火煎煮1 h;第2次加8倍水煎煮,水沸后文火煎煮45 min;第3次加6倍水,水沸后文火煎煮30 min,合并3次水煎液,过滤后水浴浓缩至每毫升含0.54 g生药药液,4℃保存,使用前水浴加温至37℃。
2.2 储备液的配制
精密称取地西泮(Diazepam)5 mg,置25 mL容量瓶中,用甲醇溶解并定容至刻度,得到浓度为200 μg/mL的内标储备液。精密称取泽泻醇A-24-醋酸酯0.4 mg、4 mg、2 mg,置10 mL容量瓶中,用甲醇溶解并定容至刻度,制得浓度分别为40 μg/mL、400 μg/mL、200 μg/mL的储备液。所有储备液均置于-20℃保存。
2.3 标准品溶液的配制
精密移取各储备液适量,以甲醇配成浓度如下的混合工作溶液:0.02、0.04、0.1、0.2、0.4、1、2、4 μg/mL。
2.4 标准曲线血浆样品的配制
将上述浓度的标准品溶液,用空白血浆进行1∶20稀释,得到0.001~0.2 μg/mL的标准曲线血浆样品。
2.5 质控(quality control,QC)样品的配制
QC样品同法稀释配制,浓度为0.002、0.02、0.16 μg/mL。
2.6 液相色谱条件
色谱柱为C18柱(1.8 μm,100 mm×3.0 mm,Agilent Technologies,美国),流速0.3 mL/min;柱温40℃;进样体积10 μL;自动进样器温度4℃;流动相:A相为水(含0.1%甲酸),B相为乙腈。
泽泻醇A-24-醋酸酯洗脱方式为梯度洗脱,每个样品的分析周期为12 min。梯度洗脱程序见表1。
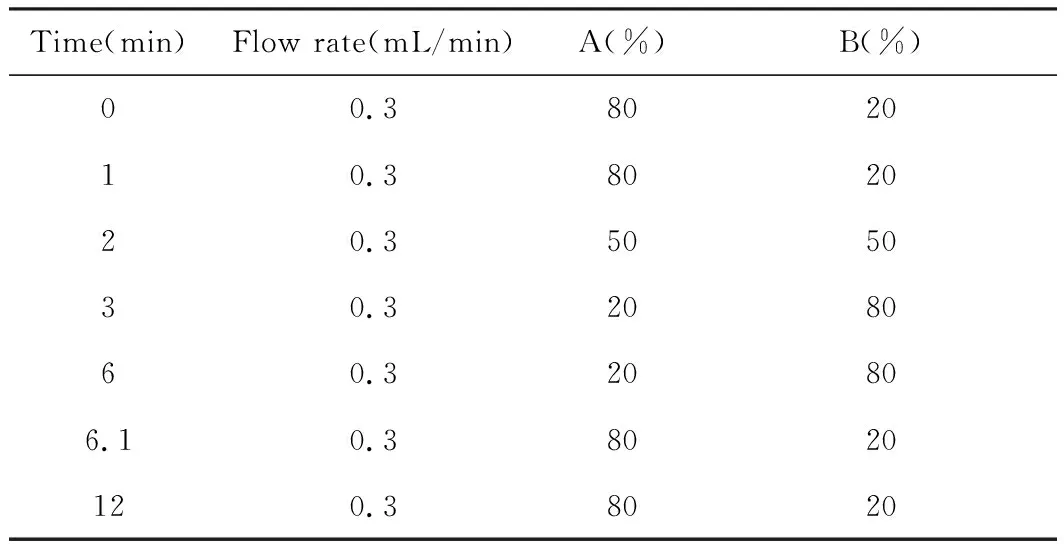
表1 流动相洗脱程序
2.7 质谱检测条件
采用ESI-离子源,离子源电压3 500 V、雾化器流速10 L/min、雾化器温度350℃、干燥气温度350℃、干燥气流速10 L/min、扫描频率2 amu/s、扫描范围100~1 300 amu、雾化器压力50 V、毛细管电压3 500 V,质谱参数577.368 1。
2.8 血浆样品采集
取雄性SD大鼠12只,随机分为两组,即泽泻组与花旗泽仁组(n=6),给药前禁食12 h,自由饮水,分别灌胃给予泽泻水煎液与花旗泽仁水煎液,剂量为泽泻组1 mL/100 g,花旗泽仁组1 mL/100 g体质量。于给药前及给药后0.25、0.5、0.75,1、2、3、4、6、8、12、24、48 h由眼眶静脉丛取血约0.5 mL,肝素抗凝,4 000 rpm离心5 min后取血浆,于-80℃保存,待测。
2.9 血浆样品处理
移取100 μL血浆样品,加入500 μL含地西泮(0.1 μg/mL)的甲醇溶液进行蛋白沉淀,涡旋2 min,4℃ 12 000 rpm离心10 min,移取上清液于30℃氮气流下吹干,于残渣中加入甲醇100 μL,涡旋使复溶,12 000 rpm离心10 min,取上清液进行HPLC-MS/MS分析,进样体积为10 μL。
2.10 方法学考察
2.10.1 选择性
取6个空白来源的血浆,加入泽泻醇A-24-醋酸酯标准样品制成浓度为0.2 μg/mL,并与空白血浆一同处理进样分析,得到色谱图。通过比较待测组分和内标的响应峰,判断空白血浆中的内源性成分是否对内标和待测组分存在干扰。
2.10.2 线性范围和定量限(LLOQ)
将配制好的6组泽泻醇A-24-醋酸酯标准曲线样品分别按照血浆处理方法进样分析,获得待测组分与内标峰面积值。以泽泻醇A-24-醋酸酯峰面积与内标物地西泮峰面积作比为纵坐标y,以标准血浆样品浓度为横坐标x,分别采用1/x加权最小二乘法进行线性回归,得到泽泻醇A-24-醋酸酯待测组分血浆样品标准曲线与线性回归系数R2。
LLOQ为标准曲线上的最低浓度点,其响应值应满足响应信噪比为1∶10,且精密度表示为相对标准偏差(Relative standard deviation,RSD)应≤20%,准确度表示为相对偏差(Relative error,RE)应在±20%范围内。
2.10.3 基质效应和提取回收率
将配制好的QC样品分别按照血浆样品处理方法进样分析,测得待测成分与内标峰面积A3。将不同个体的空白血浆样品(n=6)按照血浆样品处理方法操作后,加入与QC样品同等浓度的泽泻醇A-24-醋酸酯与内标混合标准溶液,进样分析测得峰面积A2。将上述混合标准溶液进样分析,得到峰面积A1。
基质效应为A2/A1;提取回收率为A3/A2,精密度RSD应≤20%。
2.10.4 精密度和准确度
将配制好的QC样品分别按照血浆样品处理方法进样分析,于同天进行6次测定,得到3种待测组分及内标峰面积值,分别带入回归方程计算浓度值,求算日内精密度与准确度。连续3天进样分析,共得到18个浓度值,求算日间精密度和准确度。
精密度表示为相对标准偏差(RSD)应≤20%,准确度表示为相对偏差(RE)应在±20%范围内。
2.10.5 样品稳定性
将配制好的QC样品分别做如下处理:1)反复冻融3次后按照血浆样品处理方法操作后进样分析;2)于室温下25℃放置4 h后按照血浆样品处理方法操作进样分析;3)置于-80℃冷冻2周后取出解冻后按照血浆样品处理方法操作进样分析;4)按照血浆样品处理方法操作后置于自动进样器(4℃)12 h后进样分析。将上述测得峰面积值带入回归方程求算血药浓度。
2.11 药代动力学数据处理
采用DAS2.0数据处理软件的非房室模型法(统计矩法)进行药代动力学参数Tmax、Cmax、AUC0-t、t1/2、MRT0-t及CL等参数的计算。
统计学差异采用软件SPSS 19.0进行分析。
3 结果
3.1 方法学验证
3.1.1 选择性
图1表明,在待测组分和内标的出峰位置,空白血浆中的其他内源性成分不造成干扰。在上述分析条件下,泽泻醇A-24-醋酸酯的保留时间为9.39 min,地西泮1. 67 min。
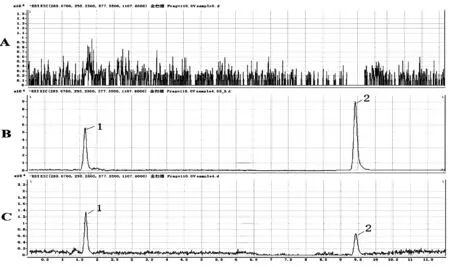
图1 地西泮(1)、泽泻醇A-24-醋酸酯(2) 血浆样品色谱图注:A为空白血浆;B为空白血浆标准添加LLOQ的待测组分和内标;C为给药2 h后的实测血浆样品
3.1.2 线性范围与定量限
标准曲线在考察的下列浓度范围内显示良好的线性关系,泽泻醇A-24-醋酸酯:0.001~0.2 μg/mL。待测组分的平均回归方程见表2。
将不同个体空白血浆新配LLOQ浓度点样品并按照血浆处理方法进样分析。结果显示,信噪比(S/N)为1∶10,精密度RSD<20%,准确度RE在±20%范围内。LLOQ点的准确度和精密度符合生物样品分析要求,所得到的标准曲线线性良好。
3.1.3 基质效应和提取回收率
表3列出了低、中、高QC浓度的泽泻醇A-24-醋酸酯和内标的基质效应和提取回收率考察结果。在低、中、高浓度下,泽泻醇A-24-醋酸酯存在一定的基质效应,但在85%~115%范围内,精密度RSD<20%,不影响本分析方法的准确性和重现性,符合生物样品分析要求。提取回收率结果显示在血浆样品前处理条件下,蛋白沉淀法对泽泻醇A-24-醋酸酯的提取回收率>80%,因此血浆处理方法对泽泻醇A-24-醋酸酯的提取回收率良好。

表2 待测组分的平均回归方程、相关系数、线性范围与LLOQ(n=6)
注:Alisol A 24-acetate:泽泻醇A-24-醋酸酯
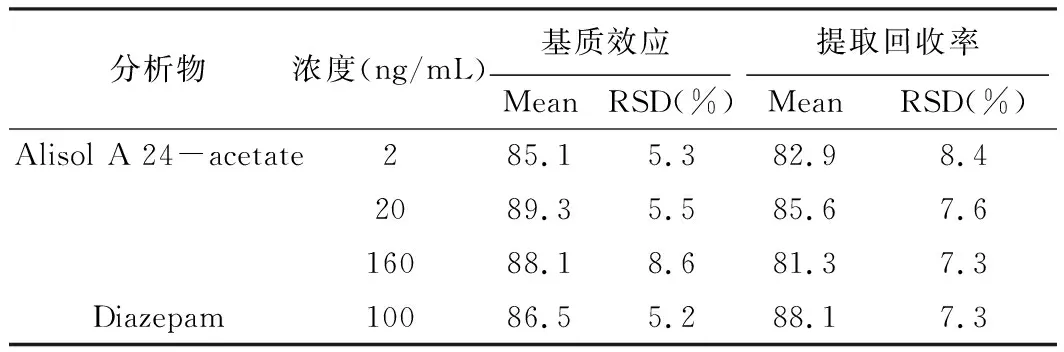
表3 待测组分在大鼠血浆中的基质效应和提取回收率(n=6)
注:Alisol A 24-acetate:泽泻醇A-24-醋酸酯;Diazepam:地西泮
3.1.4 精密度和准确度
如表4所示,泽泻醇A-24-醋酸酯日内精密度(RSD)为4.0%~9.8%,日间精密度(RSD)为5.7%~8.1%,日内与日间准确度(RE)分别为1.6%~6.7%与-2.1%~4.6%;数据表明待测组分在大鼠的血浆中准确度和精密度均符合分析要求。
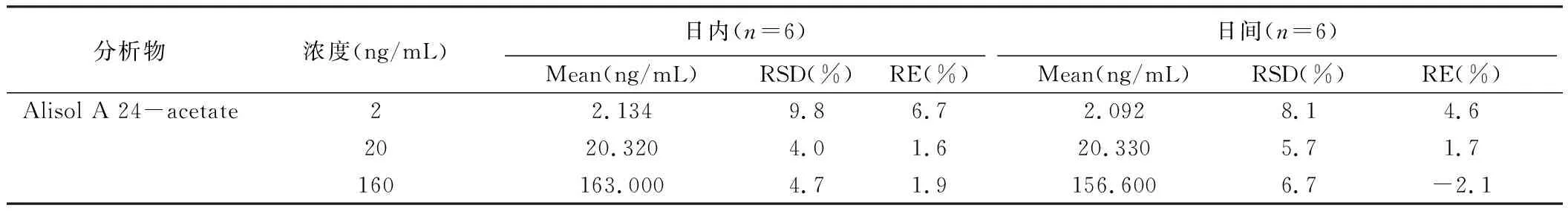
表4 待测组分在大鼠血浆中的精密度和准确度
注:Alisol A 24-acetate:泽泻醇A-24-醋酸酯
3.1.5 样品稳定性
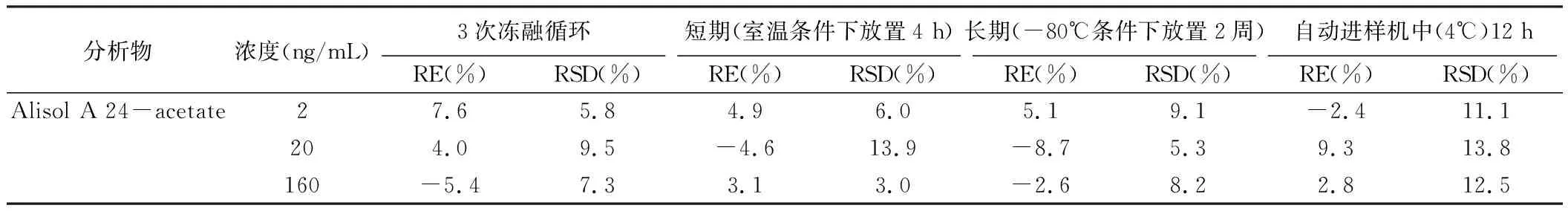
表5 待测组分在大鼠血浆中的稳定性
注:Alisol A 24-acetate:泽泻醇A-24-醋酸酯
如见表5所示,低、中、高3个QC浓度的标准血浆样品的3次冻融循环后的稳定性结果相对标准偏差RSD为5.8%~9.5%,相对偏差RE为-5.4%~7.6%;室温下25 ℃放置4 h的短期稳定性考察结果相对标准偏差RSD为3.0%~13.9%,相对偏差RE为-4.6%~4.9%;-80℃冷冻条件下保存2周的长期稳定性结果相对标准偏差RSD为5.3%~9.1%,相对偏差RE为-8.7%~5.1%;以及样品处理后置于自动机进样器(4℃)中12 h的稳定性结果相对标准偏差RSD为11.1%~13.8%,相对偏差RE为-2.4%~9.3%,RSD结果均小于20%,RE均在±20%范围内,表明待测组分在大鼠血浆中的稳定性符合生物样品的分析要求。
3.2 药代动力学结果
对两组共12只SD大鼠一次分别灌胃泽泻与花旗泽仁水煎液后,于系列时间点取血浆,并采用上述血浆样品前处理方法操作后进行进样分析,所测平均血药浓度-时间数据见表6。主要药代动力学参数结果见表7,其平均血药浓度-时间曲线如图2。结果表明,花旗泽仁组与泽泻组相比,药时曲线下面积显著增加,且依然成双峰现象,清除率显著降低,Cmax、Tmax、t1/2、MRT0-t均无显著性差异。
表6 大鼠口服不同水煎液后泽泻醇A-24-醋酸酯的血药浓度-时间数据
注:n.d.:未检出,低于定量下限

表7 大鼠口服不同水煎液后泽泻醇A-24-醋酸酯的主要药代动力学参数
注:与泽泻组比较,*P<0.05
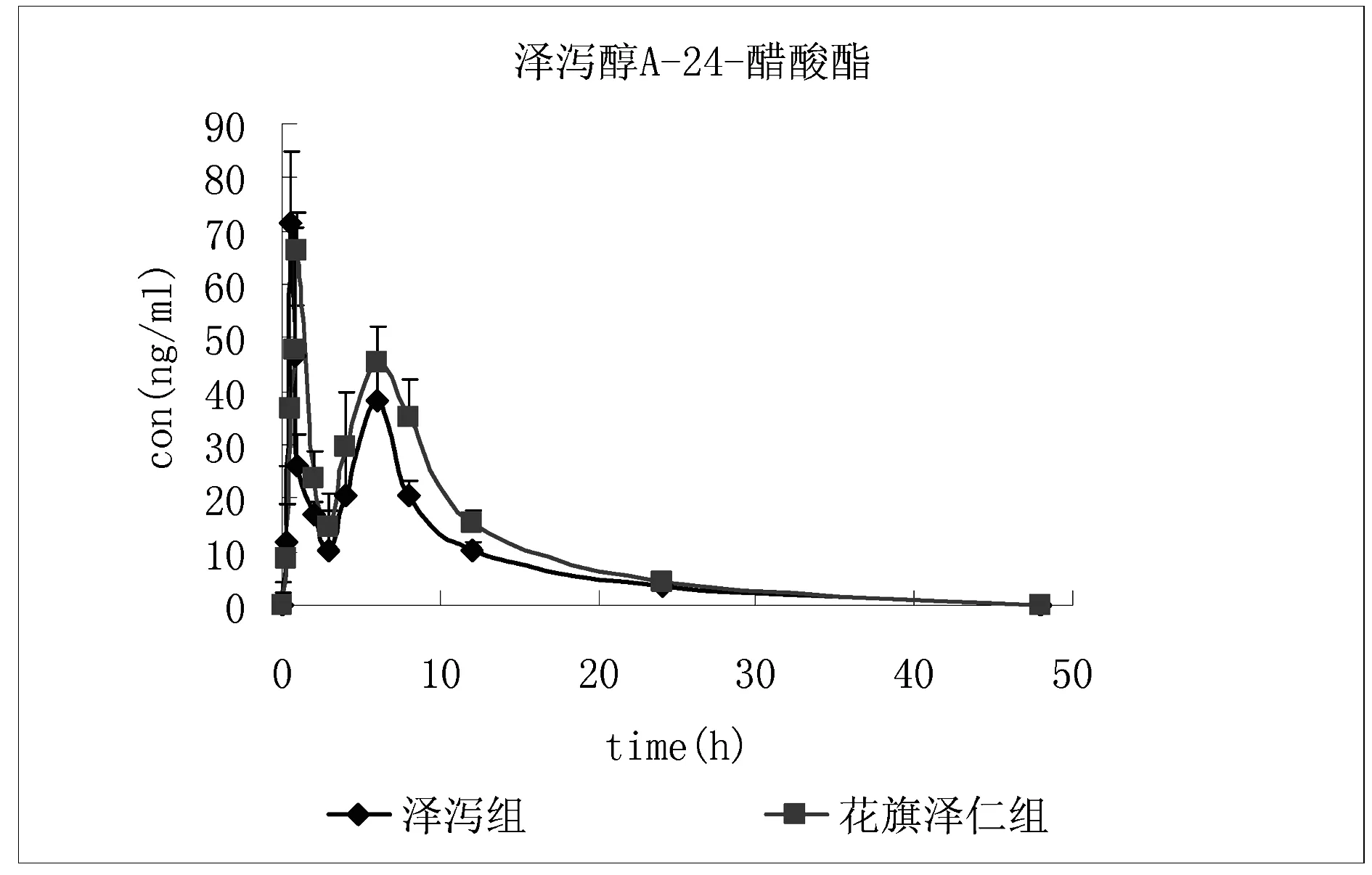
图2 大鼠口服不同提取物后泽泻醇A-24-醋酸酯 的平均血药浓度-时间曲线
4 讨论
本实验样品前处理选择蛋白沉淀(PP)法,以甲醇作为沉淀剂,沉淀蛋白后以氮气吹干浓缩进样分析。为提高实验方法准确性,本实验对血浆样品前处理方法进行筛选与优化,考察3、4、5、6、7倍体积甲醇沉淀血浆蛋白后的质谱响应值,发现5倍体积的甲醇处理,能将泽泻醇A-24-醋酸酯提取较为完全而稀释较少,从而获得最大的质谱响应。
本实验结果显示,配伍后泽泻的活性成分泽泻醇A-24-醋酸酯的平均药时曲线依然呈现明显的双峰现象,如图2所示,达峰时间为1 h,但在6 h有明显的浓度峰值,此前也有研究报道此双峰现象的存在[6]。对于此现象的原因,可能是由于泽泻醇A-24-醋酸酯经肠道吸收进入肝脏之后,通过胆汁排泄,随胆汁到达小肠后被重吸收,即通过“肝肠循环”而产生。药物吸收存在诸多因素的干扰,药物性质、生理学等方面的因素都可能造成不规则的药物吸收现象的发生,例如肝肠循环、胃排空、胃肠蠕动及药物相互作用等[7]。
比较配伍前后的药动学参数,在泽泻单独给药组中,泽泻醇A-24-醋酸酯于30 min血药浓度就迅速达峰,然而在花旗泽仁组中其达峰时间延长至1 h出现第一个峰值,药时曲线上吸收相明显延长,表明配伍后可明显改变其在大鼠体内的吸收行为。花旗泽仁组泽泻醇A-24-醋酸酯药时曲线下面积明显增加,清除率CL比泽泻组显著降低,表明配伍可提高泽泻醇A-24-醋酸酯在体内的吸收程度,并减慢其清除率,延长泽泻醇A-24-醋酸酯在体内的作用时间,从而增强泽泻醇A-24-醋酸酯降血脂[8]及其对胰岛细胞损伤的保护作用[9]。配伍用药后,可能会间接影响胃肠蠕动和胃排空的速率,胃肠道蠕动的变化容易造成药物吸收入血的差异,这可能是泽泻醇A-24-醋酸酯AUC0-t明显增加的机制之一。此外,由于中药繁多的化学成分,可能是细胞色素P450(CYP/P450)的底物、抑制剂,或抑制作用占主导地位,从而对相互之间的药代动力学过程产生影响。
本实验通过探讨泽泻配伍为花旗泽仁对泽泻醇A-24-醋酸酯药代动力学行为的影响,从药代动力学角度阐明花旗泽仁成药性特征,为指导花旗泽仁临床合理用药提供参考,为获得治疗2型糖尿病胰岛素抵抗的候选新药奠定基础。
