强精煎对少、弱精子症大鼠CFTR蛋白表达的影响
2018-09-20宾彬陆海旺林思伟王德胜王杰
宾彬,陆海旺,林思伟,王德胜,王杰
(广西中医药大学第一附属医院,广西 南宁 530023)
不育症是影响人类繁衍的重大问题,世界卫生组织指出,大约15%的育龄夫妇未能在不避孕12个月内获得妊娠。流行病调查显示,中国不孕不育发生率为8.3%(1/12),尽管其确切的患病率的不十分明晰,而且不同国家、地区、种族之间尚有差别,但随着近年来环境的恶化、生活方式和习惯的改变等各种因素影响,这一现象有逐渐加重的趋势,造成了很多家庭的痛苦和困扰。由于大部分男性不育症无法找到确切的病因,称为特发性不育症,常常表现为少、弱、畸形精子症,缺乏疗效确切的方法,治疗的结局尤其是自然妊娠率也不太令人满意。虽然辅助生殖技术发展迅猛,为很多不育夫妇带来了希望,但高昂的费用与至今面临的诸多问题和新的问题出现,仍困扰着医生与患者。
囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)在各组织上皮细胞有广泛表达。CFTR基因突变除了导致先天性输精管缺如外,还可引起精子发生异常,导致无精子症、少精子症、弱子精症等精子质量异常。李楚艳[1]通过间接免疫荧光染色法和金霉素染色法研究发现,随着CFTR表达率降低, 精子获能率也随之降低, 即CFTR表达率与人精子获能和精子顶体反应均呈正相关。
强精煎系笔者治疗少、弱、畸形精子症的经验方,多年临床观察表明该方可明显改善少、弱精子症患者的精子浓度和活力,提高临床妊娠率[2]。为深入阐明该中药复方提高精子浓度和活力的作用机制,本文诱导建立少、弱精子症大鼠模型,药物干预后,测定睾丸组织和附睾精子CFTR蛋白表达情况,以期进一步揭开其治疗少、弱精子症的部分机理,为其推广应用提供科学依据,也为中医药治疗男性不育症提供新的思路。
1 材料与方法
1.1 实验动物
75只8~9周龄雄性SD大鼠,采购于广西医科大学实验动物中心,实验动物许可证号SCXK桂2014-0002,体质量250~280 g。
1.2 药物
强精煎主要组成药物有菟丝子、枸杞子、黄芪、鹿角霜、党参、川续断、坤草、当归、生牡蛎等,采用单味中药免煎颗粒(江阴市天江药业有限公司,批号1412004);黄精赞育胶囊由何首乌、酒黄精、枸杞子、菟丝子、肉苁蓉、淫羊藿、紫河车、川断、党参、当归、丹参、蒲公英、败酱草、蛇床子、露蜂房、烫水蛭、牡蛎等组成(上海新亚药业邗江有限公司,批号151202);环磷酰胺注射液(江苏恒瑞医药股份有限公司,批号15122825)。
1.3 主要试剂与设备
细胞免疫荧光CFTR蛋白抗体(SANTA,货号SC-376683);倒置荧光显微镜(leica,型号DMi8);Western blot:SDS-PAGE蛋白上样缓冲液(碧云天公司,货号P0015L);RIPA裂解液(碧云天公司,货号P0013B);Tanon-4200型全自动化学发光图像分析系统(Millipore公司)。
抗体及其相关信息:CTFR(160 kd,Santa公司,货号sc-37);Actin(43 kd,三箭公司,货号KM9001);鼠二抗(Jackson公司,货号315-035-003);兔二抗(Jackson公司,货号111-035-001)。
2 实验方法
2.1 动物分组
大鼠适应性喂养2周后,按随机数字表法平均分成模型组、正常组、黄精赞育胶囊组、强精煎低剂量组、强精煎高剂量组,每组15只。
2.2 动物模型的制作及给药方法
少、弱精子症模型的建立按照参考文献[3]进行,除正常组外,其余4组采用注射用CTX(环磷酰胺) 40 mg/(kg·d)腹腔注射连续5天造模法诱导少、弱精子症大鼠模型。造模成功后,正常组和模型组大鼠每天给予生理盐水,黄精赞育胶囊组给予黄精赞育胶囊1.11 g /(kg·d),强精煎低剂量组大鼠每天给予强精煎免煎颗粒6 g/(kg·d),强精煎高剂量组每天给予12 g/(kg·d)。连续给药28天。
2.3 标本采集与处理
末次给药24 h后,以10%水合氯醛腹腔给药,麻醉各组大鼠,仔细分离睾丸和附睾。将一侧附睾尾剪碎,间接免疫荧光检测步骤:将分离的精子细胞经PBS液洗涤、离心3次去除上清。固定:用4%甲醛固定精子沉淀,4℃过夜。涂片:将已固定好的精子混悬液标本用PBS液离心,洗涤3次后均匀涂在硅烷化的玻璃片上,在室温状态下自然干燥。破膜:采用0.1%TritonX-100/PBS破膜10 min,增加细胞膜的通透性,以PBS液洗涤3次。封闭:以封闭液在室温环境下封闭1 h。 孵育一抗:封闭液稀释一抗,4℃孵育过夜。洗片: PBS液润洗细胞5次。孵育二抗:封闭液稀释二抗,二抗室温环境下孵育1 h。再次洗片(方法同前)。以DAPI染核10 min。第三次洗片(方法同前)。去除多余水分,封片。倒置荧光显微镜下观察并摄像保存。观察精子数不少于200个并计算 CFTR 在精子上的表达百分率。
Western blot实验:取20~50 mg左右的睾丸组织块,研磨后加入RIPA裂解液(含PMSF)4 ℃裂解1 h,混合均匀,离心后取上清备用。SDS-PAGE电泳:根据目的蛋白分子量大小配制不同浓度的胶。上样:待以上胶凝固完成,去梳,洗涤上样孔,再次上样;保持恒定电压80 V,半小时后改为120 V,持续1 h电泳。免疫印迹:卸下PAGE胶,装转膜“三明治”,恒流,300毫安转1 h,完成转膜。免疫发光:封闭液室温封闭膜1 h; 孵育一抗:4 ℃孵育过夜;洗膜:以TBST洗膜3次(10 min/次);孵育二抗:室温孵育膜1 h。洗膜(方法同前)。曝光:把膜放在铺好的保鲜膜上,均匀滴加A、B混合液于膜上,反应60 s。去除底物反应液,置平板,曝光,拍照。采用Western blot的灰度分析Quantity One软件分析实验图像结果,将β-actin表达水平作为内参照,计算CFTR/β-actin值作为CFTR蛋白的表达量。
2.4 统计学处理

3 结果
3.1 CFTR蛋白在各组睾丸组织中的表达情况
数据显示,与模型组对比,CFTR蛋白在黄精赞育胶囊组、强精煎高、低剂量组表达量均明显上调,差异有统计学意义(P<0.05)。黄精赞育胶囊组与强精煎高剂量组蛋白相对表达量无统计学意义(P>0.05)。结果见图1、表1。
3.2 各组附睾精子CFTR表达对比
数据显示,与模型组对比,CFTR在黄精赞育胶囊组、强精煎高、低剂量组表达率均明显上调,差异有统计学意义(P<0.05)。黄精赞育胶囊组与强精煎高剂量组CFTR表达率无统计学意义(P>0.05)。结果见图2~6、表2。
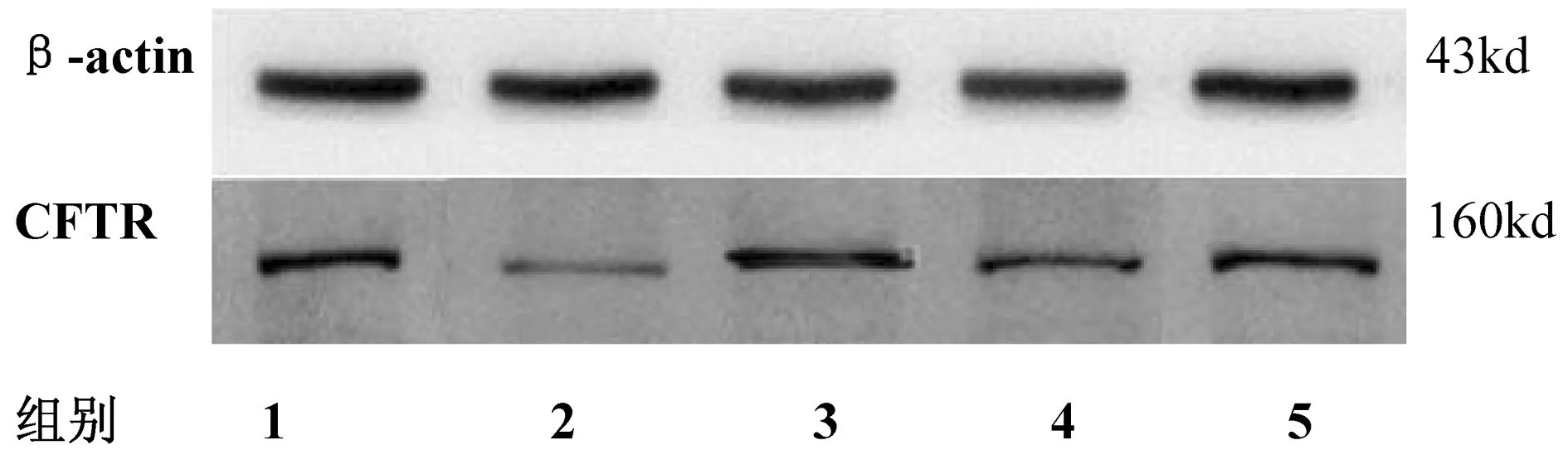
图1 CFTR蛋白在各组睾丸组织中的表达注:1:正常组 2:模型组3:强精煎高剂量组 4:强精煎低剂量组 5:黄精赞育胶囊组
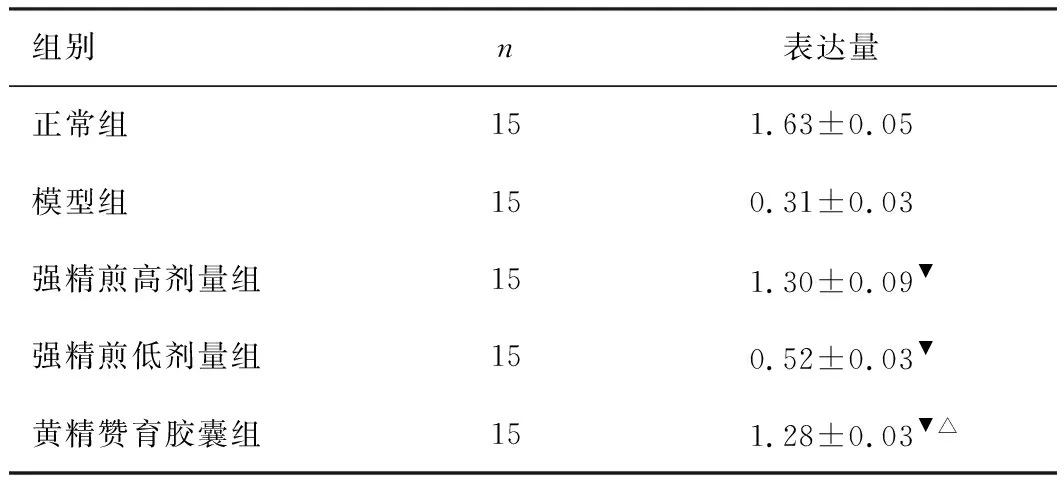
组别n表达量正常组151.63±0.05模型组150.31±0.03强精煎高剂量组151.30±0.09▼强精煎低剂量组150.52±0.03▼黄精赞育胶囊组151.28±0.03▼△
注:与强精煎高剂量组相比,△P>0.05;与模型组相比,▼P<0.05
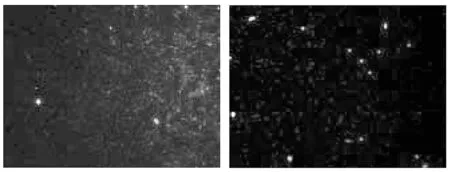
图2 CFTR在正常组附睾精子中 的表达(间接免疫荧光染色法,100×)

图3 CFTR在模型组附睾精子中 的表达(间接免疫荧光染色法,100×)
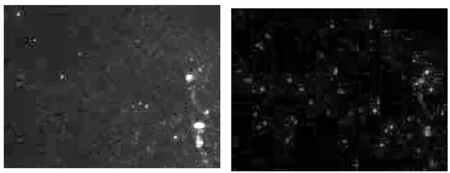
图4 CFTR在强精煎高剂量组附睾精子中 的表达(间接免疫荧光染色法,100×)

图5 CFTR在强精煎低剂量组附睾精子中 的表达(间接免疫荧光染色法,100×)

图6 CFTR在黄精赞育胶囊组附睾精子中 的表达(间接免疫荧光染色法,100×)
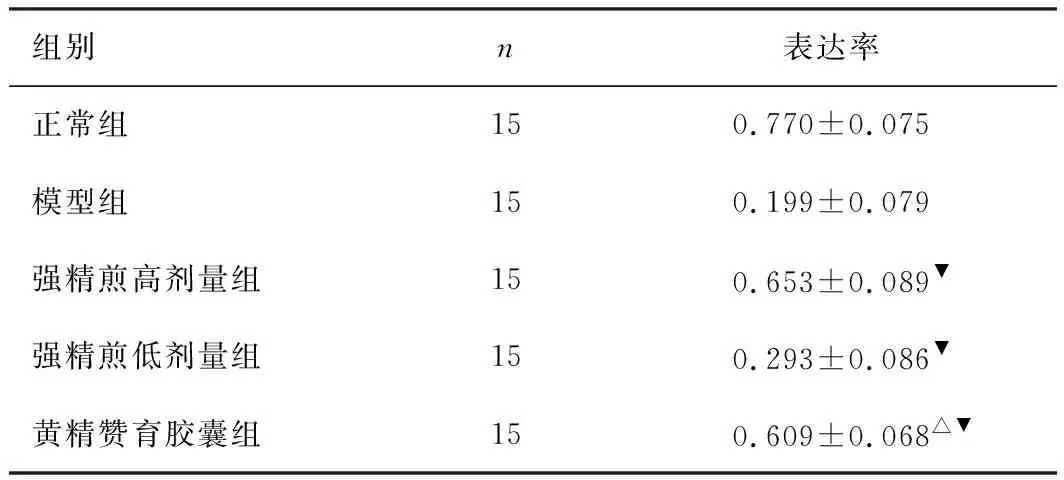
组别n表达率正常组150.770±0.075模型组150.199±0.079强精煎高剂量组150.653±0.089▼强精煎低剂量组150.293±0.086▼黄精赞育胶囊组150.609±0.068△▼
注:与强精煎高剂量组相比,△P>0.05;与模型组相比,▼P<0.05
4 讨论
囊性纤维化跨膜转导调节因子(CFTR)是一个具有特殊调节功能的Cl-通道。CFTR由跨膜结构域(2个),核苷酸结合域(2个)和特殊的调控域(1个)共5个结构域构成。两个核苷酸结合域组成头-尾相对的二聚体,两个能和ATP结合的位点(称为位点1和位点2)存在于二聚体之间的接触面。囊性纤维化跨膜转导因子大量存在于各个系统,是cAMP激活的阴离子通道,其突变引起的囊性纤维化病变常常累及呼吸、消化、内分泌、皮肤等多个系统,而CFTR对人类生育繁衍密切关联, 该基因的突变常引起先天性双侧输精管、附睾、精囊缺如等,精子输出,成熟和精液的完整性均受此影响,从而引起男性不育症;而且CFTR 蛋白在精子发育的过程中也有着不可替代的作用,任何突变都可能导致精子功能的异常, 从而使受精出现障碍而导致不育[4-7],其突变频率的增加或表达减少与男性先天性输精管(CBAVD)缺如 、精子形态异常、无精子症、少弱精子症、精子发生障碍和性腺双边缺失等相关。CFTR蛋白在精子中有大量表达,在精子获能和受精中起关键作用,因为精子获能需要HCO3-,而HCO3-浓度的提高有赖于Cl-的外流来实现,这个过程正是由CFTR 蛋白所介导的[8],假如CFTR蛋白被抑制,则可导致精子获能障碍[9]。离开生精小管的精子,在进入附睾组织后进一步发育走向成熟,进而达到获能的目的,附睾中的主细胞顶膜介导Cl-及HCO3-这两种阴离子,大量CFTR定位于顶膜,可见对附睾液产生离不开它的参与,CFTR在精子成熟中的作用也就显而易见了,此外, CFTR还参与附睾尾主细胞ATP释放的调节。还有体外实验显示,CFTR在生育组精子上的表达率远高于不育组,因此,人类精子受精能力降低与CFTR表达率下降有关[10]。
肾为先天,主生长发育,主藏精,男女生殖机能与肾精的盛衰密切相关,肾精是生殖之精的基础,生殖繁衍离不开肾精的充盈,先天不足或后天摄生不当,导致肾精匮乏则生殖之精乏源,求嗣多艰[11];“肾者主水,受五脏六腑之精而藏之”,肾中精气尤其有赖于后天脾胃所化的水谷精微充养。脾为后天之本,生血之源,精血可以互化,脾运健旺,生殖之精得以化生,若后天饮食不节,或劳倦伤脾,脾不能为胃行其津液而散精,可致气血虚弱,先天肾精也难以得到补充。基于以上理论探讨,笔者导师治疗少、弱精子症强调以“脾肾两虚”立论[12-13],临证注重“生精强精当脾肾气血并调”,兼顾湿热瘀阻,形成“补—通—利”一体的论治体系。本方以杞子补益肝肾之阴,黄芪健旺中州、益脾散精,共为君药。菟丝子、续断补肾生精壮腰膝,党参、当归,为臣药,助君药黄芪益气养血,以滋生精之源。《本经》云五味子“益男子精”,生牡蛎潜阳固涩肾精,与五味子兼防阳浮精越而妄泄,是为佐。神曲消食,助运化,防滋腻碍胃,为使药。益母草兼活血与利水之能。诸药成方,有先后(天)并补、气血同调、清热利湿活血作用,有促进生精,强精促孕之效。本次实验中,模型组睾丸组织仅有少量CFTR蛋白表达,而强精煎和黄精赞育胶囊均不同程度增加了CFTR表达,表达量远高于模型组(P<0.05),可能通过这一途径增强了精原细胞的分化,促进精子发生,改善生精障碍;强精煎高、低两个剂量组和黄精赞育胶囊组附睾精子CFTR表达率明显均高于模型组(P<0.05),强精煎通过这一途径调控调节精子获能,提高精子受精能力,可能是其治疗少、弱精子症的机制之一。本次实验的不足之处在于未进行雌雄大鼠合笼交配试验,以准确评估各组样本精子受精能力水平,后期进一步改进实验设计,期望可以得出进一步结论。
