大鳞副泥鳅群体线粒体DNA D-loop序列遗传变异分析
2018-09-20白晓慧孟一耕姜巨峰吴会民冯守明
白晓慧,杨 华,孟一耕,王 娜,姜巨峰,吴会民,冯守明
( 天津市水产研究所,天津 300221 )
大鳞副泥鳅(Paramisgurnusdabryanus)俗称黄板鳅,为小型淡水经济鱼类,属鲤形目、鳅科、花鳅亚科、副泥鳅属,分布于我国的黑龙江、辽河中下游、海河、黄河、长江、钱塘江、台湾等水系[1]。天津市位于海河流域下游,是海河五大支流的汇合处和入海口。20世纪初,天津湿地面积约 53×104hm2。进入21世纪后,由于湿地水资源匮乏,人工围垦养殖、旅游开发及水环境污染等原因,天津天然湿地面积不断减少[2-3],天然经济鱼类资源受到很大的破坏,资源量不断减少,并出现小型化和低龄化趋势,生物多样性受到严重威胁[4]。天津宝坻区是华北地区唯一的泥鳅出口地,近年来,由于国内外市场需求的不断增大,大鳞副泥鳅的养殖规模也在不断扩大。养殖的苗种多为野生捕捞或者野生亲本繁殖而来,由于栖息环境的不断恶化和捕捞强度的增大,大鳞副泥鳅的野生资源在不断减少。生物的遗传多样性是生物多样性的重要组成部分,也是种质资源保护和利用的前提和基础。线粒体D-loop区是线粒体上重要的非编码区,由于受选择压力较小,其进化速率是线粒体其他区域的5~10倍,更适用于种内不同群体和相近物种间的遗传多样性分析[5]。国内对天然水域大鳞副泥鳅线粒体遗传多样性的研究仅见于黄河流域的山西临汾、河南新乡和山东济南群体[6],安徽省的怀远、舒城、池州群体[7]及南四湖群体[8]。本研究通过对天津5个主要湿地大鳞副泥鳅群体线粒体D-loop序列进行多态性分析,探明其遗传背景,以期为大鳞副泥鳅种质资源保护和合理开发利用提供参考。
1 材料与方法
1.1 材料
5个大鳞副泥鳅群体分别采自蓟州区于桥水库、武清区大黄堡湿地、宁河区七里海湿地、静海区团泊水库和宝坻区潮白新河(图1),共72尾。样本取鳍条放入装有无水乙醇的离心管中,-80 ℃保存备用。
1.2 基因组DNA的提取、序列扩增及测序
采用醋酸铵沉淀法[9]提取基因组DNA。具体步骤为:每个样本剪取鳍条组织约0.2 g放于2 mL离心管中,用剪刀将组织剪碎,加入600 μL的细胞裂解液(Tris-HCl 100 mmol/L,pH 8.0;EDTA 50 mmol/L,pH 8.0;SDS 1%;NaCl 125 mmol/L)和8 μL 20 mg/mL的蛋白酶K,放入65 ℃水浴锅中水浴2~3 h,每隔30 min摇匀一次,直至组织充分裂解。将离心管冷却至室温,加入200 μL 7.5 mol/L的醋酸铵,充分摇匀,冰上冷却5 min或4 ℃冷却10 min,12 000 r/min,4 ℃离心10 min,取上清液至新离心管。加入与上清液等体积的异丙醇,轻轻摇匀,室温下沉淀1~2 min,12 000 r/min,4 ℃离心10 min,弃上清液。加入70%的酒精1 mL洗涤DNA,12 000 r/min,4 ℃离心10 min,弃上清液,加入无水乙醇1 mL,12 000 r/min,4 ℃离心10 min,弃无水乙醇,室温干燥约20 min,加入50 μL双蒸水溶解DNA。用NanoDrop ND-1000紫外分光光度计检测DNA含量和质量,将各DNA样品稀释至100 ng/μL,-20 ℃保存备用。

图1 5个大鳞副泥鳅群体采样位置
基于GenBank 中大鳞副泥鳅线粒体基因组全序列(NC_023803.1),用Primer premier 5.0 软件进行扩增引物设计,引物序列为:MiPd-D1-F,5′-CCAGTAGAACACCCATTT-3′;MiPd-D1-R,5′-ATAAAGTCAGGACCAAGC-3′。引物由上海生工生物工程有限公司合成。序列扩增反应体系为50 μL:5 μL 10×Buffer,5 μL dNTP(10 mmol/L),正反引物各1 μL(10 μmol/L),2.5 μL模板DNA,0.5 μL TaqDNA聚合酶(5 U/μL),ddH2O 35 μL。PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃ 45 s,72 ℃延伸1 min,33个循环;72 ℃延伸10 min,4 ℃保存。PCR扩增产物用1%琼脂糖凝胶电泳检测,送上海生工生物工程有限公司用扩增引物进行双向测序。
1.3 数据分析
将测序结果用BioEdit 7.0.5软件[10 ]进行编辑校正,用Mega 6.0软件[11]进行同源比对,确定序列长度,并统计DNA序列的碱基组成,构建分子系统树;用DnaSP 5.1软件[12 ]计算单倍型数、单倍型多样性指数、核苷酸多样性指数和基因流。用TCS 1.21软件[13]构建单倍型网络进化图,检测单倍型之间的进化关系。用ARLEQUIN 3.5.1.2软件[14]计算种群间的遗传分化指数并进行显著性检验,同时进行Tajima′sD和Fu′sFs中性检验以及核苷酸不配对分析,计算τ值。按下式计算种群扩张时间:
t=τ/2μk
式中,t为自群体扩张开始到现在的时间,τ为扩张时间参数,μ为D-loop基因的突变速率,k为序列长度。
在本研究中,D-loop基因的进化速率采用3%~10%每百万年进行计算[15]。最终的扩张时间T=t×生殖周期。天然水域条件下,大鳞副泥鳅性成熟年龄为2龄,因此生殖周期按2年计算。
2 结 果
2.1 序列变异及群体遗传多样性
测序结果经过校正和比对分析,获得5个群体72个个体的线粒体D-loop序列,长度为912~914 bp。Mega 6.0软件分析结果显示,该序列的A、T、G、C碱基平均含量分别31.5%、36.0%、18.6%、13.9%,A+T含量(67.5%)明显高于G+C含量(32.5%)。所比对序列中共检测出多态性位点30个(包括4个插入/缺失位点),其中简约信息位点5个,单突变位点21个,转换/颠换平均值为1.958。
5个群体72个个体共检测到22个单倍型,单倍型序列GenBank登录号为KY441417~KY441438。单倍型在5个群体中的分布见表1,其中6个单倍型为群体共有单倍型,16个单倍型为各群体独有的单倍型。5个群体的多样性信息见表2,总体的单倍型多样性为0.813,核苷酸多样性为0.0015。潮白新河群体的单倍型数和单倍型多样性最高,其次为团泊水库和七里海湿地群体,于桥水库群体最低。七里海湿地群体的核苷酸多样性最高,其次为团泊水库和潮白新河群体,于桥水库群体最低。
2.2 群体遗传结构及历史动态分析
Arlequin软件计算得到的5个群体间的遗传分化指数见表3,潮白新河和团泊水库群体及二者和其他群体间的遗传分化指数为-0.0205~0.0427,群体间分化较小(P>0.05)。七里海湿地、大黄堡湿地和于桥水库3个群体间的遗传分化指数为0.0496~0.0795,属中等程度的遗传分化(P<0.05)。
单倍型网络进化图显示(图2),5个群体的单倍型个体呈交错分布,无明显的地理分支,Hap 1的个体最多,位于单倍型网络进化图的中央,为5个群体共享,其他单倍型通过2~10步突变与之连接。采用邻接法和最大似然法构建的单倍型系统发育树也未表现出明显的与地理分布相对应的分化谱系,表明5个大鳞副泥鳅群体未分化成明显的地理谱系(图3)。
经中性检验,Tajima′sD检验及Fu′sFs检验结果均为负值,潮白新河群体和团泊水库群体的Fu′sFs统计检验显著(P<0.05),七里海湿地、大黄堡湿地和于桥水库3个群体的Tajima′sD统计检验显著(P<0.05)(表4)。将5个群体作为1个整体进行中性检验,Tajima′s D=-2.241(P=0.001),Fu′s Fs=-25.139(P<0.001),两个值的统计检验均显著。在核苷酸不配对分布检验中,SSD和R指数两个参数的统计检验均不显著(P>0.05),说明未显著偏离群体扩张模型。以上这些证据均表明大鳞副泥鳅可能经历过种群扩张。根据5个群体的整体扩张参数值(τ=3.31),估算出大鳞副泥鳅种群扩张事件发生在第四纪更新世晚期(12.1~3.6万年前)。

表1 大鳞副泥鳅5个群体的变异位点及各单倍型在群体中的分布

表2 大鳞副泥鳅5个群体D-loop序列的遗传多样性参数

表3 大鳞副泥鳅5个群体间的遗传分化指数(对角线下)及其相关P值(对角线上)

图2 22个mtDNA D-loop 单倍型的网络进化关系示意

图3 基于大鳞副泥鳅 22个单倍型序列构建的系统树 节点数字代表1000次Bootstrap统计分析后对该支的支持百分比(≥50%),线上为邻接法,线下为最大似然法.
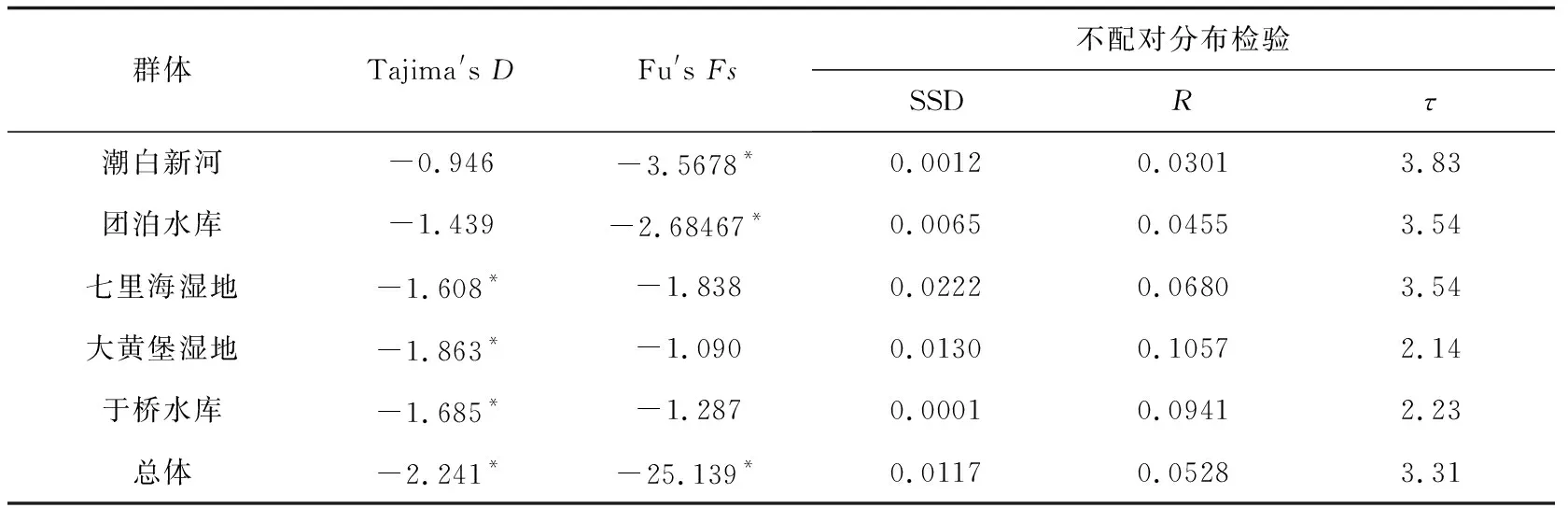
群体Tajima's DFu's Fs不配对分布检验SSDRτ潮白新河 -0.946-3.5678*0.00120.03013.83团泊水库-1.439-2.68467*0.00650.04553.54七里海湿地-1.608*-1.8380.02220.06803.54大黄堡湿地-1.863*-1.0900.01300.10572.14于桥水库-1.685*-1.2870.00010.09412.23总体-2.241*-25.139*0.01170.05283.31
3 讨 论
3.1 大鳞副泥鳅群体的遗传多样性
遗传多样性是物种生存适应和发展进化的前提,也是评价种群资源状况的重要依据,一个物种的遗传多样性水平越高,其进化的潜力及环境适应能力也越强。按照Grant等[16]的分类,单倍型多样性以0.5为临界值,核苷酸多样性以0.005为临界值,二者的值越大,群体的多样性程度越高。在本研究的5个大鳞副泥鳅群体中,除于桥水库群体外,其他4个群体均具有较高的单倍型多样性(0.7308~0.9080),但5个群体的核苷酸多样性均较低(0.0004~0.0022)。总体来看,5个群体的单倍型多样性为 0.8130,核苷酸多样性为0.0015,属高单倍型多样性,低核苷酸多样性群体,其多样性水平低于南四湖大鳞副泥鳅群体[8]和安徽4个野生泥鳅群体[17]以及翘嘴鲌[18](Culteralburnus)、松江鲈(Trachidermusfasciatus)[19]等经济鱼类。高单倍型多样性和低核苷酸多样性的模式在翘嘴鲌[18]、松江鲈[19]、黄颡鱼(Pelteobagrusfulvidraco)[20]、南四湖湖鲚(Coiliaectenestaihuensis)[21]、鳊(Parabramispekinensis)[22]等多种鱼类均见报道,这种情况可能是由于种群经过瓶颈效应稳定后发生了扩张,种群的快速增长有利于新突变的保持而使单倍型多态性增加,但还未能达到核苷酸序列的多样化[23]。
3.2 种群遗传结构及历史动态
遗传分化指数是用来评价亚群间遗传分化程度的重要指标,遗传分化指数<0.05 表明群体间分化较小;遗传分化指数为0.05~0.15,表明群体间存在中等分化;遗传分化指数为0.15~0.25,表明群体间高度分化[24]。总体来看,本研究中5个群体的遗传分化为中等水平。天津地跨海河两岸,海河是华北最大的河流,支流众多,本研究中的潮白新河、七里海湿地、团泊水库和大黄堡湿地4个群体由海河流域的几大干流及支流相连通,使得4个群体间基因交流成为可能,造成群体间遗传分化程度不高。当基因流值>5时,说明种群间基因交流频繁,各群体为一个大的随机单元[25]。本研究中,5个群体的平均基因流值为3.26,且5个群体均有各自特有的单倍型,说明各群体间尚未有大范围、频繁的基因交流。这可能与大鳞副泥鳅的生活习性有关,大鳞副泥鳅属底层鱼类,产黏性卵,其生活习性限制了鱼的迁移行为和种群间的基因交流[26]。
单倍型网络进化图未检测到与地理分布相对应的分化谱系,单倍型Hap 1为5个群体共享,位于单倍型网络进化图的中央,推测可能为祖先单倍型,说明5个大鳞副泥鳅群体可能起源于同一个祖先群体。中性检验和核苷酸不配对分布结果均提示大鳞副泥鳅可能经历过种群扩张,推算的扩张时间在晚更新世。自晚更新世以来,天津地区主要发生了3次大的海进海退事件——沧州海侵、献县海侵和黄骅海侵,七里海湿地就是全新世晚期以来海退过程在天津平原残留下来的众多潟湖之一[27]。由此推断,天津地区5个大鳞副泥鳅群体可能起源于同一个祖先群体,受晚更新世海进海退的影响形成了种群隔离,在栖息地逐渐稳定后发生了扩张。
3.3 大鳞副泥鳅的种质资源保护与管理
本研究的大鳞副泥鳅群体为海河水系的主要湿地群体,5个种群作为1个整体来看,单倍型多样性程度较高,但仍低于其他经济鱼类[17-19],且核苷酸多样性处于较低水平,其渔业资源现状不容乐观。因此,建议加强对天津主要湿地水环境的保护力度,同时,建立天津地区大鳞副泥鳅原种场,加强对大鳞副泥鳅天然种质资源的保护,并选用遗传多样性高的群体开展大鳞副泥鳅人工苗种繁育和良种选育工作,以保证市场的需要,减少对大鳞副泥鳅野生资源的破坏。
