下调细胞因子信号转导抑制因子3表达对2型糖尿病大鼠糖代谢影响的研究
2018-09-18张旭章爱莲陈俊国陆燕王琼余炜杰张世杰滕懿群吴鸣
张旭 章爱莲 陈俊国 陆燕 王琼 余炜杰 张世杰 滕懿群 吴鸣
细胞因子信号转导抑制因子3(suppressors of cytokine signaling 3,SOCS3)是 Janus 激酶/信号转导与转录活化因子3(JAK/STAT3)信号通路的主要负性调控因子,其过度表达可抑制胰岛素和瘦素信号转导,对胰岛素和瘦素抵抗的发生起重要作用[1-3]。本课题组前期研究发现2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠体内SOCS3基因表达上调[4]。因此,降低SOCS3基因的表达,可能减少对胰岛素信号抑制,改善胰岛素抵抗程度。RNA 干扰(RNA interference,RNAi)是一种在转录后水平抑制基因表达的技术,具有简单、特异及高效的特点[5]。慢病毒具有感染细胞效率高、表达持续稳定的特点,是RNAi理想的载体[6]。本研究利用慢病毒介导RNAi技术,抑制T2DM大鼠肝脏和骨骼肌SOCS3基因表达,观察血糖、胰岛素、胰岛素抵抗相关指数的变化,探讨下调SOCS3基因对T2DM胰岛素抵抗的影响。
1 材料和方法
1.1 实验动物 5周龄健康雄性SD大鼠40只,体重180~220g,由上海斯莱克实验动物有限公司提供,许可证号:SCXK(沪)2012-0002。饲养环境为无特定病原体级(SPF)条件下,室温 20~25℃、昼夜 12h交替环境中,2只/笼饲养,期间自由取食和饮水。
1.2 主要试剂 慢病毒载体质粒(pGLV1/U6/GFP)、慢病毒包装质粒(pGag/Pol、pRev、pVSV-G)(上海吉玛公司);C6大鼠神经胶质瘤细胞(杭州赫贝公司);DMEM培养液(美国Gibco公司);链脲佐菌素(美国Sigma公司);总RNA快速提取试剂盒(上海捷瑞公司);荧光定量PCR试剂盒(北京天根公司);葡萄糖测定试剂盒(上海荣盛公司);胰岛素酶联免疫试剂盒(上海抚生公司);羊抗SOCS3一抗、兔抗 β-actin一抗(美国Santa Cruz公司);辣根过氧化物酶标记的兔抗羊IgG二抗、辣根过氧化物酶标记的羊抗兔IgG二抗(美国Bioworld公司)。1.3 方法
1.3.1 SOCS3短发夹RNA(shRNA)的构建 在 NCBI GenBank中检索大鼠SOCS3基因核苷酸序列(Gene ID:89829),参考小干扰 RNA(siRNA)设计原则分别设计4条21个碱基的siRNA序列,利用BLAST检索,确认siRNA序列的特异性。同时,随机设计1条同样长度的非干扰序列siRNA-Negative作为对照。分别将设计的siRNA序列合成shRNA双链DNA,以序列TTCAAGAGA作为环状结构,可以避免形成终止信号,并在3′端加入序列TTTTTT,可以终止转录。将shRNA双链DNA克隆到慢病毒载体质粒中,产生大鼠SOCS3 shRNA表达质粒,分别命名为 shRNA-N、shRNA1、shRNA2、shRNA3、shRNA4。
1.3.2 SOCS3 shRNA干扰效率的检测 SOCS3 shRNA表达质粒经测序鉴定正确后转染C6大鼠神经胶质瘤细胞,48h后收集样品,实时荧光定量PCR法和Western blot法检测SOCS3 shRNA表达质粒对靶基因的干扰效率,最终确定shRNA4干扰效率最高,序列5′-CACCTTCTCCGAACGTGTCACGTTATTCAAGAGATAACGTGACACGTTCGGAGAATTTTTTG-3′。
1.3.3 慢病毒的包装与滴度测定 将干扰效率最高的SOCS3 shRNA表达质粒与慢病毒包装质粒混合,加入无血清DMEM中,室温放置20min后,共转染293T细胞,置于37℃、5%CO2培养箱中培养,6h后吸去转染液,加入含10%FBS的DMEM培养液继续培养,72h后收集含慢病毒颗粒的293T细胞上清液,0.45μm滤器过滤后,超速离心浓缩2h,将浓缩病毒液置于-70℃冰箱保存,同样方法包装非干扰序列慢病毒。293T细胞按3×104细胞/孔的浓度接种96孔板中培养24h。将慢病毒原液稀释至5个梯度,每孔加入100μl稀释的慢病毒液,培养24h,再加入含10%FBS的DMEM培养液100μl,继续培养72h后,通过荧光显微镜观察绿色荧光蛋白表达,计数荧光细胞,结合稀释倍数测定慢病毒滴度为1.0×109TU/ml。
1.3.4 动物模型制备与实验分组 40只大鼠普通饲料适应性喂养1周后,给予高脂高糖饲料喂养。4周后,单次按30mg/kg腹腔注射1%链脲佐菌素。5d后连续3次测随机血糖,血糖值>16.7mmol/L者确定为T2DM大鼠模型,共30只大鼠造模成功,成模率75.0%。30只T2DM大鼠采用随机数字表法分为对照组和干扰组各15只。对照组注射非干扰序列慢病毒1.5ml/次,干扰组注射SOCS3 RNAi慢病毒1.5ml/次。注射方式为尾静脉注射,时间为实验第1天和第15天,共2次。
1.3.5 标本收集 4周后大鼠禁食12h,10%水合氯醛(3.5ml/kg)腹腔内注射,麻醉成功后开胸心脏取血5ml,离心后收集血清。采集肝脏和骨骼肌组织,用预冷的0.9%氯化钠溶液洗净,于液氮冷冻后转移至-70℃冰箱保存。
1.3.6 血清学检测 采用ELISA法检测空腹胰岛素(FINS)含量,葡萄糖氧化酶法检测空腹血糖(FPG)含量。胰岛素抵抗指数(IRI)=(FPG×FINS)/22.5,表示大鼠的胰岛素抵抗程度。胰岛素敏感性指数(ISI)=ln(FPG×FINS)-1,表示大鼠对胰岛素的敏感性。
1.3.7 实时荧光定量PCR法检测SOCS3 mRNA表达水平 Trizol法提取肝脏和骨骼肌组织中总RNA,按试剂说明书,逆转录合成cDNA。在实时荧光定量PCR仪上行 PCR,PCR 反应参数为:95℃ 10s,60℃ 20s,72℃30s,共 40个循环。SOCS3上游引物:5′-GGGGCCC-CTTCCTTTTCTTTA-3′,下游引物:5′-CGACAAAGATGCTGGAGGGT-3′;内参 β-actin 上游引物:5′-CCCATCT ATGAGGG TTACGC-3′,下游引物:5′-TTTAATGTCACGCACGATTTC-3′。 采 用 2-ΔΔct法 分 析SOCS3 mRNA的表达量。
1.3.8 Western blot法检测SOCS3蛋白表达水平 提取肝脏和骨骼肌组织中总蛋白并测定浓度,按每泳道30μg蛋白上样,蛋白行聚丙烯酰胺凝胶电泳后转移至聚偏氟乙烯膜(PVDF)膜。将PVDF膜经5%脱脂奶粉封闭 1h 后,加入一抗 SOCS3(1∶500)和 β-actin(1∶500)室温孵育 2h,洗膜后加入二抗 SOCS3(1∶5 000)和 β-actin(1∶5 000)室温孵育 2h,再次洗膜后,加入化学发光试剂液,置凝胶成像仪中曝光显影以及图像分析。SOCS3蛋白表达水平以其与β-actin的比值表示。1.4 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 SOCS3 shRNA的基因沉默作用 以未受转染SOCS3 shRNA的C6大鼠神经胶质瘤细胞为对照,该组细胞SOCS 3 mRNA和蛋白的表达量值定为1,计算其他各转染组细胞SOCS3 mRNA和蛋白的相对表达量,所有样本重复3次,取平均值。实时荧光定量PCR法和Western blot法检测结果显示,4个质粒干扰效率不同,其中shRNA4的干扰效率最高,可使SOCS3表达水平下调达70%,而shRNA1为25%,shRNA2为35%,shRNA3为50% ,见图1-2。
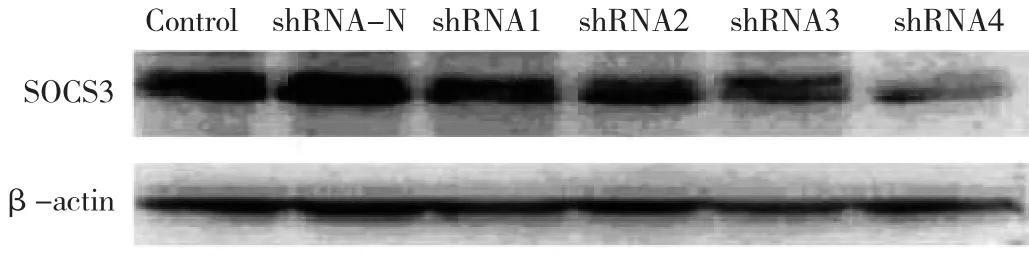
图1 C6大鼠神经胶质瘤细胞中SOCS3蛋白表达电泳图

图2 各组细胞SOCS3 mRNA表达水平
2.2 两组大鼠肝脏和骨骼肌组织中SOCS3 mRNA和蛋白表达水平比较 干扰组肝脏和骨骼肌组织中SOCS3 mRNA和蛋白表达水平较对照组均明显下降,差异均有统计学意义(均P<0.01),表明T2DM大鼠注射SOCS3 RNAi慢病毒后,RNA特异性干扰SOCS3表达成功,见表1和图3。
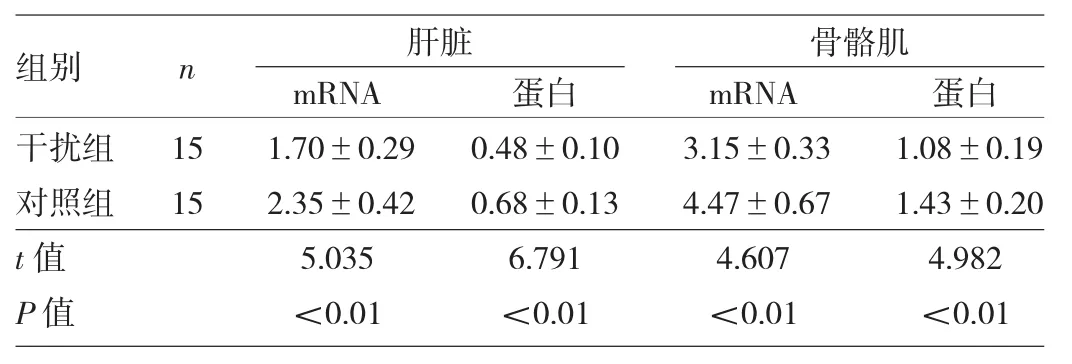
表1 两组大鼠肝脏和骨骼肌组织中SOCS3 mRNA和蛋白表达水平比较

图3 两组大鼠肝脏和骨骼肌SOCS3蛋白表达电泳图
2.3 两组大鼠FINS、FPG、IRI和ISI比较 干扰组FINS、FPG和IRI较对照组均明显下降,而ISI较对照组明显上升,差异均有统计学意义(均P<0.01),表明T2DM大鼠注射SOCS3 RNAi慢病毒后,胰岛素敏感性明显升高,胰岛素抵抗得到了改善,见表2。

表2 两组大鼠FINS、FPG、IRI和ISI比较
3 讨论
胰岛素抵抗是T2DM发病机制的核心[7],SOCS3过度表达可能干扰胰岛素的作用效果,导致胰岛素抵抗[1-2]。肝脏和骨骼肌是胰岛素抵抗的主要发生器官[8],研究显示,通过基因敲除技术使肝脏和骨骼肌SOCS3表达缺陷,可提高胰岛素敏感性,改善胰岛素抵抗[9-10]。因此,SOCS3可能成为治疗T2DM的靶点,通过下调SOCS3基因的表达,可能减少对胰岛素信号转导通路的抑制,提高胰岛素的生物学效应,阻止T2DM的发生、发展。RNAi是siRNA诱导细胞内同源mRNA特异性降解所引起的基因沉默现象,慢病毒载体感染细胞效率高,免疫反应小,可使目的基因整合到宿主染色体,实现长期稳定的表达。本研究根据siRNA原则设计4条序列作为SOCS3基因干扰候选靶序列,并分别构建4个SOCS3 shRNA表达质粒,转染C6大鼠神经胶质瘤细胞筛选出干扰效率最高的质粒,与慢病毒包装质粒共转染293T细胞,产生滴度为1.0×109TU/ml的慢病毒颗粒。然后将其经尾静脉注射方式作用于肝脏和骨骼肌组织,实现干扰SOCS3表达的目的。结果显示,干扰组大鼠肝脏、骨骼肌SOCS3 mRNA和蛋白水平降低至对照组的70%左右。这种通过RNAi下调基因表达,具有高度特异性和高效性,避免了基因敲除的不良反应。T2DM大鼠肝脏和骨骼肌SOCS3被沉默后,FINS、FPG和IRI均明显下降,而ISI明显上升,提示下调SOCS3表达可有效地改善胰岛素对葡萄糖代谢的作用,缓解胰岛素抵抗的程度。本研究中,干扰效率最高的SOCS3 shRNA表达质粒转染C6大鼠神经胶质瘤细胞后,可使SOCS3 mRNA和蛋白水平表达下调70%,但T2DM大鼠注射SOCS3 RNAi慢病毒后,SOCS3抑制率降低为30%,也稍低于通过下丘脑注射慢病毒的干扰效果[11],考虑可能与注射方式、慢病毒滴度、机体代谢及内环境有关。
综上所述,以慢病毒为载体介导的RNAi技术可有效发挥基因沉默作用,通过抑制T2DM大鼠SOCS3的表达,可提高T2DM大鼠胰岛素敏感性,缓解胰岛素抵抗程度,可能成为治疗糖尿病的新手段之一。
