高胆固醇饮食对兔脑血流量和β-淀粉样蛋白1-42水平的影响
2018-09-18金平潘永明潘智勇徐剑钦林敏佟雅涵陈民利许茂盛
金平 潘永明 潘智勇 徐剑钦 林敏 佟雅涵 陈民利 许茂盛
阿尔茨海默病(Alzheimer’s disease,AD)是一种起病隐匿的神经退行性疾病,其临床特征是进行性的记忆力减退和认知功能障碍,患者最终多因并发症死亡[1]。β-淀粉样蛋白(amyloid β-protein,Aβ)异常聚集和沉积所形成的老年斑是AD的主要病理特征,其中Aβ1-42是形成老年斑的主要成分,在AD发病机制中占有重要的作用[2]。报道显示到本世纪中期,全球老年痴呆患者的数量将过亿[3]。但是目前为止,AD的病因尚未完全阐明。相对于少见的家族性和早显性AD,临床上多见的晚发性AD发病机制更加复杂多样[4],研究显示胆固醇代谢在晚发性AD发病中发挥了重要作用[5]。同时有研究认为AD是一种由脑缺血所触发的神经变性疾病[6]。长期的低血流灌注可以造成脑组织能量供给障碍,神经细胞发生氧化应激、炎性反应而引起损伤,并最终导致进行性的认知功能障碍[7]。本研究旨在探讨高胆固醇饮食对大白兔脑血流量(cerebral blood flow,CBF)和脑组织Aβ1-42水平的影响,并分析血清TC、CBF及Aβ1-42水平的相关性。
1 材料和方法
1.1 实验动物 普通级3~4月龄雄性日本大耳白兔12只,体质量2.5~3.0kg,由浙江中医药大学动物实验研究中心普通级兔实验室[SYXK(浙)2013-0164]提供并饲养,室内温度:18~22℃,相对湿度:40%~60%,12h/12h明暗交替。采用随机数字表法分为高胆固醇组和常规饮食组各6只,高胆固醇组以2%胆固醇饮食喂养,常规饮食组以常规基础饮食喂养,12周后行血液检测和MRI分析。所有实验动物使用符合动物实验学的3R原则。
1.2 兔血清TC、TG、LDL-C和HDL-C水平检测 抽取兔耳缘静脉血,采用日立7020全自动生化分析仪和试剂盒(上海德赛诊断技术有限公司)检测血清TC、TG、LDL-C和HDL-C水平。
1.3 兔脑CBF检测 采用Discovery MR750 3.0T磁共振成像系统(美国GE公司),配备兔脑专用线圈(上海晨光公司)。主要MR扫描序列包括:轴位3DT1BRAVO、T2WI和动脉自旋标记(3D-ASL)。3D-ASL序列标记后延迟时间1 525ms,其他主要序列及扫描参数见表1。
实验兔禁食不禁水12h后,经耳缘静脉注射3%戊巴比妥钠溶液30mg/kg麻醉,待麻醉稳定后,将实验兔以卧位固定并将头颈部放入动物专用线圈位置中,确保兔保持呼吸顺畅和心跳平稳。扫描完成后,将3D-ASL
原始数据传输至Sun Workstation ADW 4.2(美国GE公司),采用工作站自带软件Functool对ASL原始数据进行图像矫正等预处理,获得CBF参数图,在双侧皮质及海马设置4个感兴趣区,测得CBF平均值,记录数据。由2位MR医师单独进行图像后处理,图像中红色代表高灌注,蓝色代表低灌注。
1.4 兔脑皮质、海马Aβ1-42水平测定 经耳缘静脉注射3%戊巴比妥钠溶液30mg/kg麻醉后处死并取脑,分离皮质和海马。使用IKA ULTRA-TURRAX匀浆机(德国希而科有限公司)将脑皮质和海马制备成10%的脑组织匀浆,4℃离心,4 500r/min离心10min,取上清液进行检测。使用ELISA试剂盒(南京建成生物工程研究所)测定Aβ1-42含量,严格按照说明书操作。采用考马斯亮蓝法测定脑组织总蛋白质量[8]。Aβ1-42水平以Aβ1-42含量/脑组织总蛋白质量表示,单位为pg/mg。
1.5 统计学处理 采用GraphPad Prism 4.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;血清TC、CBF与Aβ1-42水平的相关性分析采用Person相关。P<0.05为差异有统计学意义。
2 结果
2.1 两组兔血清TC、TG、LDL-C和HDL-C水平比较 高胆固醇组兔血清TC、TG、LDL-C和HDL-C水平均明显高于常规饮食组,两组比较差异均有统计学意义(均P<0.05),见表 2。

表1 MR扫描序列主要成像参数
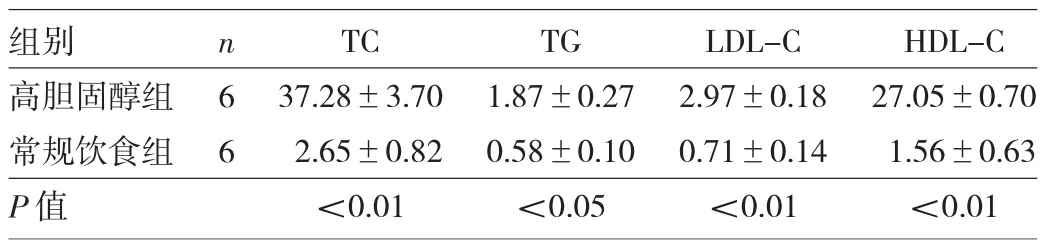
表2 两组兔血清TC、TG、LDL-C和HDL-C水平比较(mmol/L)
2.2 两组兔脑皮质、海马CBF比较 CBF参数图显示高胆固醇组兔脑皮质、海马血流灌注低于常规饮食组,见图1(插页)。高胆固醇组兔脑皮质、海马CBF分别为(16.94±4.35)和(12.53±3.90)ml/(min·100g),均明显低于常规饮食组的(25.56±6.58)和(20.26±5.72)ml/(min·100g),两组比较差异均有统计学意义(均P<0.05),见图2。
2.3 两组兔脑皮质、海马Aβ1-42水平比较 高胆固醇

图2 两组兔脑皮质、海马CBF比较(a:两组兔脑皮质CBF比较;b:两组兔脑海马CBF比较;与常规饮食组比较,*P<0.05)
2.4 兔血清TC、CBF和Aβ1-42水平的相关性分析 血清TC与皮质、海马Aβ1-42水平均呈正相关(r=0.774和0.649,均P<0.05),见图4a-b;血清TC 与皮质、海马 CBF组兔脑皮质、海马 Aβ1-42水平分别为(149.56±24.26)和(216.58±50.44)pg/mg,均明显高于常规饮食组的(132.40±13.75)和(151.30±23.76)pg/mg,两组比较差异均有统计学意义(均P<0.05),见图3。均呈负相关(r=-0.845 和-0.783,均P<0.01),见图 4c-d;皮质、海马Aβ1-42水平与CBF均呈负相关(r=-0.637和-0.602,均P<0.05),见图 4e-f。

图3 两组兔脑皮质、海马Aβ1-42水平比较(a:两组兔脑皮质Aβ1-42水平比较;b:两组兔脑海马Aβ1-42水平比较;与常规饮食组比较,*P<0.05)

图4 兔血清TC、CBF与Aβ1-42水平的相关性分析
3 讨论
Aβ的异常聚集和沉积是AD发病机制中的重要环节[5,9]。在正常的生理状态下,Aβ的产生和降解处于动态的平衡之中,当体内外的某些因素打破这个动态的平衡,β淀粉样前体蛋白(β-amyloid precursor protein,APP)的代谢便会出现异常,引起Aβ的生成增多和(或)降解减少,最终导致Aβ在脑内的大量沉积。
目前研究认为胆固醇代谢紊乱在AD的发病中扮演着重要角色[10]。胆固醇参与Aβ产生、聚集沉积及降解,高胆固醇血症可增加大脑中Aβ的沉积,并损害学习和记忆功能[11]。根据Smith[12]的假说,AD的发病始于海马,随着疾病进展,海马内神经元的减少导致其所投射的其他神经皮层内神经元代谢减缓、逐渐死亡。脑皮质尤其是海马的萎缩是AD患者在MRI上的特征性改变[13]。所以本课题组在成功获得兔高胆固醇模型后,选取兔脑皮质、海马进行Aβ1-42水平检查,结果显示两组兔血清TC与皮质、海马Aβ1-42水平均呈正相关,且高胆固醇组兔脑皮质、海马Aβ1-42水平均明显高于常规饮食组,两组比较差异均有统计学意义,提示高胆固醇血症能促进Aβ在脑内的沉积,这与目前研究结论相符[14-15]。血清TC水平的升高可能通过改变细胞膜和细胞内TC的分布影响APP在细胞膜中的定位,从而增强β-分泌酶和γ-分泌酶的活性,使Aβ的产生增多;同时TC也可以抑制α-分泌酶的活性,间接使Aβ的产生增加[16-17]。此外TC可以通过调节包括胰岛素降解酶(insulin degradation enzyme,IDE)等诸多参与 Aβ 降解的一系列酶的表达和活性促进Aβ的沉积。IDE是一种主要表达于神经元和神经胶质细胞的锌金属肽链内断酶,对胞外的Aβ降解具有重要作用,其部分亚基存在于脂筏微域中,细胞膜TC水平升高可直接影响IDE的功能,导致Aβ降解减少[18]。
血清TC水平升高可引起血管内皮损伤,从而导致内皮脱落,组织因子释放,激活体内凝血系统,使体内出现高凝状态,导致血流缓慢,脑血流灌注减少[19]。本课题组利用MRI 3D-ASL序列检测兔脑皮质、海马CBF,结果显示高胆固醇组兔脑皮质、海马CBF均明显低于常规饮食组,且两组血清TC与皮质、海马CBF均呈负相关,与孙明等[19]研究结果相仿。
基于大鼠双侧颈动脉结扎的慢性脑缺血模型研究显示脑内长期低灌注可使脑内APP及Aβ水平明显升高,可能与长期低血流灌注激活了APP基因并增强了β-分泌酶的活性有关[20-21]。异常沉积在周围供血小动脉及毛细血管基膜上的Aβ可增强内皮细胞所分泌的内皮素的收缩血管作用,引起脑血管收缩,加重脑的低血流灌注,导致Aβ进一步沉积,从而形成恶性循环[22]。本研究结果也显示兔脑皮质、海马Aβ1-42水平与CBF均呈负相关。此外当脑内出现低血流灌注时,脑内的神经胶质细胞,包括小胶质细胞、星形胶质细胞和少突胶质细胞均可出现明显的增生和活化,引起免疫炎性反应[23-24],并最终导致神经元凋亡[25]。AD的免疫炎性反应机制同样指出免疫炎性反应参与AD的整个病理进程:老年斑的形成过程中始终伴随胶质细胞的增生及炎性细胞因子过量产生[26],表明慢性脑缺血可以通过免疫炎性反应促进AD的发生。
目前胆固醇异常代谢学说及慢性脑缺血触发学说指出高胆固醇血症及慢性脑缺血在AD的发病中起着重要作用。笔者之前通过高胆固醇饮食诱导的AD兔模型脑内出现皮质、海马的萎缩和脑室扩张等AD特征样改变[27],进一步验证了AD的胆固醇异常代谢学说。根据文献[12-13],本研究选取并测量了兔脑皮质、海马CBF,结果显示兔脑CBF明显降低,兔脑皮质、海马Aβ1-42水平与CBF均呈负相关,笔者推测高胆固醇诱导AD的发生,不仅仅是基于其可以改变TC在神经元膜、细胞内的分布,或在强化APP淀粉样途经的同时抑制非淀粉样途径等作用,它还可以通过其引起的低血流灌注促进脑内Aβ的异常沉积。
综上所述,高胆固醇饮食能引起脑海马、皮质CBF的减少和Aβ1-42水平的升高,继发于高血脂的低血流灌注可能参与并促进了Aβ1-42在脑内的异常沉积。
