化学平衡视角下碳酸氢钠性质的再认识
2018-09-13张庆
◆张庆
碳酸氢钠是重要的化工原料,也是高中化学重要的物质,是酸式盐的典型代表物,涉及物质制备、离子检验、离子共存、化学平衡的等知识点,如何减少学生的机械记忆,促进学生的深度学习,是每个教师关心的问题,基于化学平衡思想,整合涉及碳酸氢钠性质的知识点,系统认识,更符合学生的认知特点。
1.侯氏制碱法中为什么会生成NaHCO3的沉淀?
人教版教材中没有专门讲侯氏制碱法,但作为重要的物质制备原理,这是必讲的知识点。在高一教学中,此处学生通常关心两个问题,一是为什么先通NH3?二是为什么会生成NaHCO3沉淀?
向饱和NaCl溶液中先通入足量的氨气,再通入足量的CO2。此处可以引导学生想象,在溶液中存在着Na+、Cl-、NH4+和 HCO3-,它们可以组成NH4Cl、NaCl、NaHCO3、NH4HCO3四种物质,为什么 NaHCO3会结晶析出?这时将以上四种物质的溶解度展示出来,学生们很快会联系到初中学过的过饱和溶液问题,利用溶解度(溶解平衡)快速突破难点。引导学生对比Na2CO3和NaHCO3的溶解度,也可以突破饱和Na2CO3溶液能与CO2反应生成沉淀的难点(Na2CO3溶液与CO2的反应,高一最好不涉及,减轻学生负担)。
2.NaHCO3溶液为什么显碱性?
0.10mol/LNaHCO3溶液的PH值约为8.3[1],其溶液显碱性。为了使学生有充分的认识,除了机械记忆、实验测定外(酚酞溶液遇NaHCO3溶液显粉红色),高二教学时,让学生通过计算比较HCO3-的电离平衡常数和水解平衡常数平衡,感知NaHCO3的碱性效果更好。在教学中,引导学生从定性角度认识到酸式盐的酸碱性是由酸式酸根离子的电离程度和水解程度的相对大小决定的。以HA-为例[2],HA-的电离平衡常数K(电离)=Ka2。HA-的水解平衡常数K(水解)=Kw/Ka1。
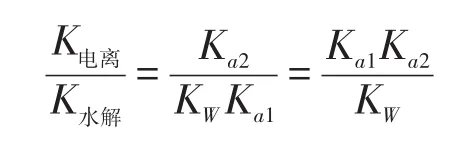
若Ka1·Ka2=Kw,则该酸式盐溶液呈中性。
若Ka1·Ka2>Kw,则该酸式盐溶液呈酸性。
若Ka1·Ka2<Kw,则,该酸式盐溶液呈碱性。
结合人教版选修4《化学反应原理》[3]第43页碳酸的电离平衡常数数据,学生们比较容易通过平衡计算,得出NaHCO3溶液显碱性的结论。进一步拓展,类似的问题还有亚硫酸氢钠、氢硫酸酸式盐的酸碱性等问题也可以提供数据,让学生计算解决。学生自己发现的结论,显然比老师直接告知的印象要深刻一些。
3.为什么用饱和NaHCO3溶液除去CO2中混有的HCl?
高中化学中,NaHCO3有一个重要作用就是充当制备CO2的除杂剂,为了减少机械记忆,教学中可以引导学生想像微观过程,将CO2通入水溶液中,发生如下反应:CO2+H2O⇌H2CO3⇌H++HCO3-,从平衡的角度看,如何减少CO2损失?饱和NaHCO3溶液中有大量的HCO3-,大量的HCO3-抑制了上述反应,大大减少CO2的损失。而酸性强于碳酸的HCl溶液中大量的H+使上述平衡逆向移动,产生了CO2。类似的还有除去Cl2中的HCl等问题。
4.为什么NaHCO3溶液中CO32-浓度不是最小的?
一直以来,很多教辅资料认为,NaHCO3溶液中由于NaHCO3的水解程度大于其电离程度,所以水解产生的OH-浓度(HCO3-+H2O⇌H2CO3+OH-)就大于电离产生的CO32-浓度(HCO3-⇌ CO32-+H+)。真实的情况是,只要溶液不是太稀,NaHCO3溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
NaHCO3溶液中同时存在以下四个平衡[4]:
(1)水的电离平衡 H2O⇌H++OH-K1=Kw=1.0x10-14
(2)碳酸氢钠的电离平衡 HCO3-⇌ CO32-+H+K2=Ka2=4.7x10-11
(3)碳酸氢钠的水解平衡 HCO3-+H2O⇌H2CO3+OH-K3=Kh=Kw/Ka1=
(4)碳酸氢钠的自耦电离平衡 HCO3-+HCO3-⇌CO32-+H2CO3K4=K自耦=Ka2/Ka1=
如果仅考虑到上面(1)~(3)的平衡,所以会得出OH-浓度大于CO32-浓度的错误结论。NaHCO3的自耦电离高中不涉及,可向学生简单作如下解释:NaHCO3水解的实质是结合H+,由于Ka2大于Kw,所以相比于水电离出的H+,HCO3-更容易结合自己电离的H+,结合(4)电离平衡可知,由于K自耦大于Kh,所以只要溶液浓度不是太低(大于10-4),CO32浓度大于OH-浓度。[5]
5.为什么不能用BaCl2(或CaCl2)溶液鉴别碳酸钠和碳酸氢钠?
很多教辅资料认为,由于Ca(HCO3)2或Ba(HCO3)2是可溶性盐,所以可用BaCl2(或CaCl2)溶液可以鉴别Na2CO3和NaHCO3溶液,这是一种想当然的结论。事实是用BaCl2(或CaCl2)溶液无法鉴别。[6]课堂上做演示实验,向NaHCO3溶液中加入CaCl2溶液会生成白色的沉淀(CaCO3),可以向学生指出教辅资料中关于用氯化钙鉴别的错误之处。学生会很好奇,为什么?(高一不讲解,将问题留到高二或高三解决)高二讲解(或高三复习)沉淀溶解平衡时,再次演示该实验,提供碳酸的电离平衡常数和碳酸钡的溶解平衡常数,引导学生通过计算解决疑问。
0.1mol/L碳酸氢钠溶液中,碳酸根的自耦电离平衡常数k自耦=Ka2/Ka1,由于H2CO3浓度近似等于CO32-浓度,所 以 可 知 c (CO32-)由Ksp(CaCO3)=2.8x10-9可知[7],在0.1mol/L碳酸氢钠溶液中,只要Ba2+浓度大于2.8x10-6mol/L即可生成BaCO3沉淀。通过演示实验和理论计算,可以强化学生对沉淀溶解平衡的理解。
我区学生化学学习中存在基础弱、重记忆、轻思维等不足。在强调学科素养的今天,化学学习能力、学科素养,绝不是靠机械记忆、总结答题模板等应试措施就能提高的。因此,在日常教学中,就要求我们老师,要熟悉最新的课程标准,研读化学学科核心素养,打通三年,螺旋上升,减少学生的机械记忆,渗透学科核心素养,以问题为导向,促进学生的深度思考,把强化理科教学落到实处。
