补肾活血汤调控Runx2及Osterix促进BMSCs成骨分化的作用研究❋
2018-09-12程英雄罗毅文胡年宏谭瑞芬吴志方
程英雄,罗毅文,王 斌,胡年宏,谭瑞芬,吴志方,罗 辉,沈 玮
(广州中医药大学附属骨伤科医院,广州 510240)
骨质疏松症是一种退化性疾病,中老年人随着年龄的增大,骨质疏松的发病率逐渐升高,由于骨骼脆性增加,老年人极易发生骨折[1]。中医所述“肾藏精,精生髓,髓养骨”。肾精与骨髓是密不可分的共同体。中医、中药常采用补肾活血汤来促进疏松性骨折的愈合。补肾活血汤出自清·赵竹泉《伤科大成》,是补肾活血法的代表方之一。前期研究表明,补肾活血汤能够有效缩短骨折愈合时间,改善腕关节功能,并可促进骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)BMSCs成骨分化。在调控BMSCs成骨分化过程的众多通路中,Runx2与Osterix是决定成骨细胞分化的2个重要转录因子[2-3]。Osterix基因在2002年被Kazuhisa在诱导C2C12细胞向成骨细胞分化过程中分离出来,骨膜内成骨和软骨内成骨细胞都表达Osterix。Osterix位于成骨细胞分化路径中Runx2的下游,并且Runx2为Osterix表达所必须[4]。Runx2和Osterix基因缺失可完全抑制成骨细胞分化[5]。本文旨在通过慢病毒转染的方法,探究补肾活血汤对Runx2和Osterix的影响,以此阐明补肾活血汤促进成骨细胞分化和骨骼愈合的机理。
1 材料与方法
1.1 材料及动物
补肾活血汤组成:熟地黄18 g,菟丝子18 g,杜仲6 g,肉苁蓉6 g,枸杞子6 g,补骨脂18 g,山萸肉6 g,独活 6 g,当归6 g,红花3 g,没药6 g,由广州中医药大学第三附属医院药房提供。上述药材共99 g,按照传统煎煮方法,置于旋转蒸发仪上浓缩至生药含量0.9 g/L。间充质干细胞实验室冻存,用时复苏。Runx2慢病毒载体及高滴度含目的基因的慢病毒由北京利科丽生物提供;RNA提取试剂盒RNAiso Plus、反转录试剂盒PrimeScriptTMRT reagent Kit、real-time PCR试剂盒SYBR® Premix Ex TaqTMⅡ(Takara,日本);PCR引物由上海生工工程有限公司提供;BCIP/NBT碱性磷酸酶试剂盒(Beyotime,上海); BCA蛋白定量检测试剂盒(赛默飞,美国); DMEM培养液(Gibco,美国);FBS(Gibco,美国);青霉素、链霉素(Sigma,美国);Runx2多克隆抗体、Osterix多克隆抗体(Abcam,英国);山羊抗兔二抗(Pierce,美国);酶标仪(Bio-Rad,美国);荧光定量PCR仪(Bio-Rad,美国); 电泳仪(Bio-Rad美国);凝胶成像仪(天能,中国);培养箱(SANYO,日本)。
SPF级SD雄性大鼠6只,体质量180~220 g,由广东省医学实验动物中心提供(动物许可证号SCXK(粤)2008-0002)。
1.2 方法
1.2.1 间充质干细胞的分离、鉴定和分化 分离方法按照先前文章所述[6]。以100 mg/L的水合氯醛麻醉SD大鼠,在体积分数75%的酒精中浸泡3 min,后用碘伏消毒2次。无菌条件下取出双侧股骨和胫骨,剥离筋膜及组织置于添加青、链霉素的DMEM低糖培养基中,10 ml注射器抽取DMEM低糖培养基反复冲洗骨髓腔直至变白,1000 r/min离心8 min弃上清。加入4 ml完全培养基(10%FBS)制成细胞悬液,置于25 cm2培养瓶中,37 ℃含5% CO2培养箱中培养。24 h后首次换液,以后每2 d更换1次,待细胞融合80%~90%时用2.5 g/L胰酶消化,标记为原代。之后按照1∶2的比例传代。P3代可用于细胞实验。P3代BMSCs接种于6孔板,密度为5×105/ml,待细胞融合80%~90%时消化。将干细胞重新接种于6孔板,每孔约3×103个细胞,加入2 ml/孔干细胞完全培养液,放入37 ℃含5% CO2培养箱中培养。24 h后移去旧的培养液,加入2 ml/孔成骨诱导液(10-8mol/L地塞米松,10-2mol/L β-磷酸甘油,50 μg/mL维生素C),每3 d换液,诱导3周左右,间充质干细胞诱导成骨分化后钙结节形成,茜素红染色,镜下观察、拍照。评价细胞形态、排列方式、钙结节等特征,判断分化是否成功。
1.2.2 含药培养基的制备 将浓缩提取物溶于二甲基亚砜(dimethyl sulphoxide,DMSO)DMSO中,过0.22 μm滤膜制成补肾活血汤浓缩液。分装至无菌管中备用,-20 ℃保存。根据每个培养基中培养液的体积,加入一定量体积的浓缩液。
1.2.3 慢病毒转染 以每孔1×104个/ml的细胞密度,将BMSCs细胞接种于12孔板,DMEM+10%FBS培养基中培养,对照细胞转入空载质粒,正常细胞不做任何处理。24 h后细胞融合度为50%~60%时,吸去旧的培养液,每孔加入500 μL PBS清洗细胞,每孔中加入500 μL新鲜无血清的DMEM培养液,稳转细胞加入高滴度慢病毒小心混匀。培养1 h后,加入含有500 μL、100 μL胎牛血清的DMEM培养液混匀,37 ℃含5% CO2培养箱中培养。24~48 h之后通过qPCR测定相对基因含量,确定转染是否成功,并进行细胞传代和冻存。
1.2.4 补肾活血汤细胞毒实验 P3代BMSCs细胞复苏后消化,按照每孔5000个细胞加入96孔板中,每孔100 μL,按照细胞浓度将细胞分为4组,加入配制好的补肾活血汤提取物及等量DMSO,补肾活血汤组终浓度分别为25、50、100、200 μg/ml。96孔板中加入含有细胞的培养液作为空白对照。37 ℃含5% CO2培养箱中共孵育20 h后取出,加入10 μL的CCK-8试剂,4 h后使用酶标仪在450 nm处检测其吸光度。通过吸光度判断补肾活血汤对细胞增殖的影响,实验重复3次。
1.2.5 实验分组与干预 将稳转细胞、对照细胞和空白细胞分别按照5×105的细胞密度接种于6孔板中,每类细胞接种3个孔,分为正常培养组、补肾活血汤50 μg/ml组和补肾活血汤100 μg/ml组。正常培养组给予体积分数10%的空白培养基,补肾活血汤组分别给予含药培养基,终浓度为50、100 μg/ml,实验重复3次。
1.2.6 碱性磷酸酶(ALP)活性半定量检测 如1.2.5所述,分组培养3 d后弃培养基,PBS漂洗。每孔中加入1% triton的裂解液,离心后取上清加入96孔板中,按照1∶1的比例加入4-硝基苯磷酸二钠(1 mg/ml)避光,37 ℃下孵育2~4 h。酶标仪405 nm处检测吸光度。BCA标准曲线按照试剂盒说明进行,计算半定量ALP活性=OD405/样本蛋白量。
1.2.7 实时荧光定量PCR 表1显示,如1.2.5所述分组,培养3 d后按照RNA提取试剂盒的说明提取总RNA,并反转录成cDNA。Runx2和Osterix引物由上海生工工程有限公司提供,按照试剂盒说明要求进行反应。记录CT值,根据ΔΔCT法计算相关基因的变化。目的基因相对表达量=2-ΔΔCT,其中ΔCT=CT目的基因-CT内参基因,ΔΔCT=ΔCT实验组-ΔCT对照组。
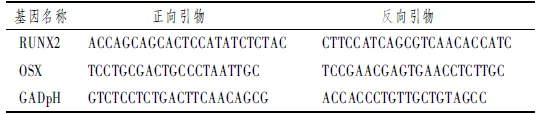
表1 RT-PCR引物序列
1.2.8 BMSCs细胞中Runx2和Osterix蛋白表达水平检测 如1.2.5所述,分组培养3 d后裂解细胞并提取总蛋白。加入5×SDS上样缓冲液,100 ℃煮沸5 min。浓缩胶每孔加入30 μL样品。浓缩胶电泳,100 v 20 min;分离胶电泳,200 v至溴酚蓝条带恰好跑出(约40 min)。取下凝胶,350 mA转膜70 min;将膜取出,封闭液封闭1 h后将膜放入β-actin、Osterix一抗(1∶1000),Runx2一抗(1∶2000)中,4 ℃反应过夜。PBST洗膜5 min×3次;将膜转入HRP标记二抗(1∶10000),室温孵育1 h,ECL显影。

2 结果
2.1 BMSCs的形态观察及诱导成骨分化鉴定
图1显示,镜下观察P3代MSCs细胞,可以看到细胞成纺锤状集落生长,细胞核明显,细胞形态正常,排列一致。P3代的细胞经过诱导后染色结果显示,有大量成骨细胞生成,细胞由梭形变为无定形态,并有多层重叠现象。茜素红染色使钙结节呈鲜红色,说明诱导成功。
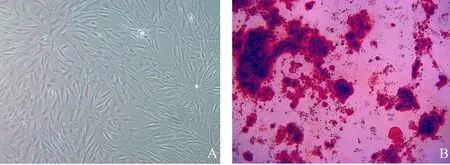
图1 间充质干细胞鉴定和诱导分化后形态
2.2 过表达慢病毒的转染和检测
图2显示,qPCR检测目的基因转录情况,发现转染Runx2后Runx2表达明显上升,说明转染成功。在转染Runx2的细胞中,Osterix的表达水平也有增加。与已知的实验结果一致,Runx2能够调控Osterix的表达。
2.3 补肾活血汤细胞毒结果
图3显示,根据抑制率计算公式,补肾活血汤在25~200 μg/ml对BMSCs无明显活性影响(P>0.05)。

图2 转染后BMSCs中Runx2和Osterix的表达情况(**P<0.01)
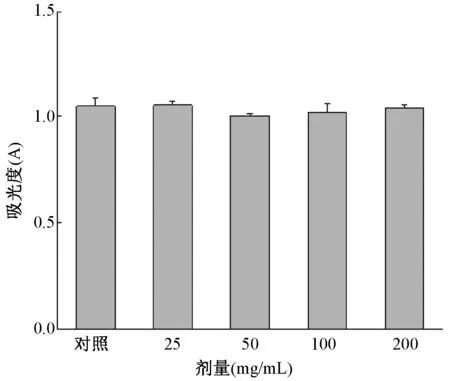
图3 补肾活血汤对BMSCs细胞活性的影响
2.4 补肾活血汤对BMSCs碱性磷酸酶活性的影响
表2显示,在稳转细胞中与正常培养组比较,补肾活血汤100 μg/ml处理的细胞磷酸酶活性明显升高(P<0.05)。补肾活血汤50 μg/ml处理的无明显差异(P> 0.05)。因此,补肾活血汤能够提高BMSCs中碱性磷酸酶的活性,促进成骨分化。
表2 ALP半定量测试活性
2.5 补肾活血汤对BMSCs成骨分化相关基因表达情况的影响
表3显示,与正常培养组细胞比较,补肾活血汤100 μg/ml处理的空白细胞、对照细胞及稳转细胞Runx2基因相对表达量明显增加(P<0.05)。补肾活血汤50 μg/ml处理的稳转细胞Runx2基因相对表达量明显增加(P<0.05)。与正常培养组比较,补肾活血汤100 μg/ml处理的空白细胞、对照细胞及稳转细胞Ostreix基因相对表达量明显增加(P<0.05)。补肾活血汤50 μg/ml处理的稳转细胞Osterix基因相对表达量明显增加(P<0.05)。补肾活血汤确实能够调节Osterix的表达,并且通过Runx2的调节,与已证实的研究结果一致。
2.6 补肾活血汤对BMSCs成骨分化相关蛋白表达情况的影响
图4显示,免疫印迹检测(western Blot WB)结果分析显示,蛋白表达水平与基因表达水平一致。在正常培养组中,稳转细胞Runx2和Osterix表达量明显增加,证实稳转细胞构建成功。与正常培养组比较,补肾活血汤100 μg/ml处理的空白细胞、对照细胞及稳转细胞Runx2和Osterix蛋白相对表达量明显增加(P<0.05)。补肾活血汤50 μg/ml处理的稳转细胞Runx2和Osterix蛋白表达含量明显增加(P<0.05)。Osterix和Runx2是成骨分化中的重要转录因子,在过表达细胞中补肾活血汤能明显影响2个转录因子的表达,说明补肾活血汤确实能够在分子水平上影响成骨细胞的分化。

表3 Runx、Osterix相对表达量比较
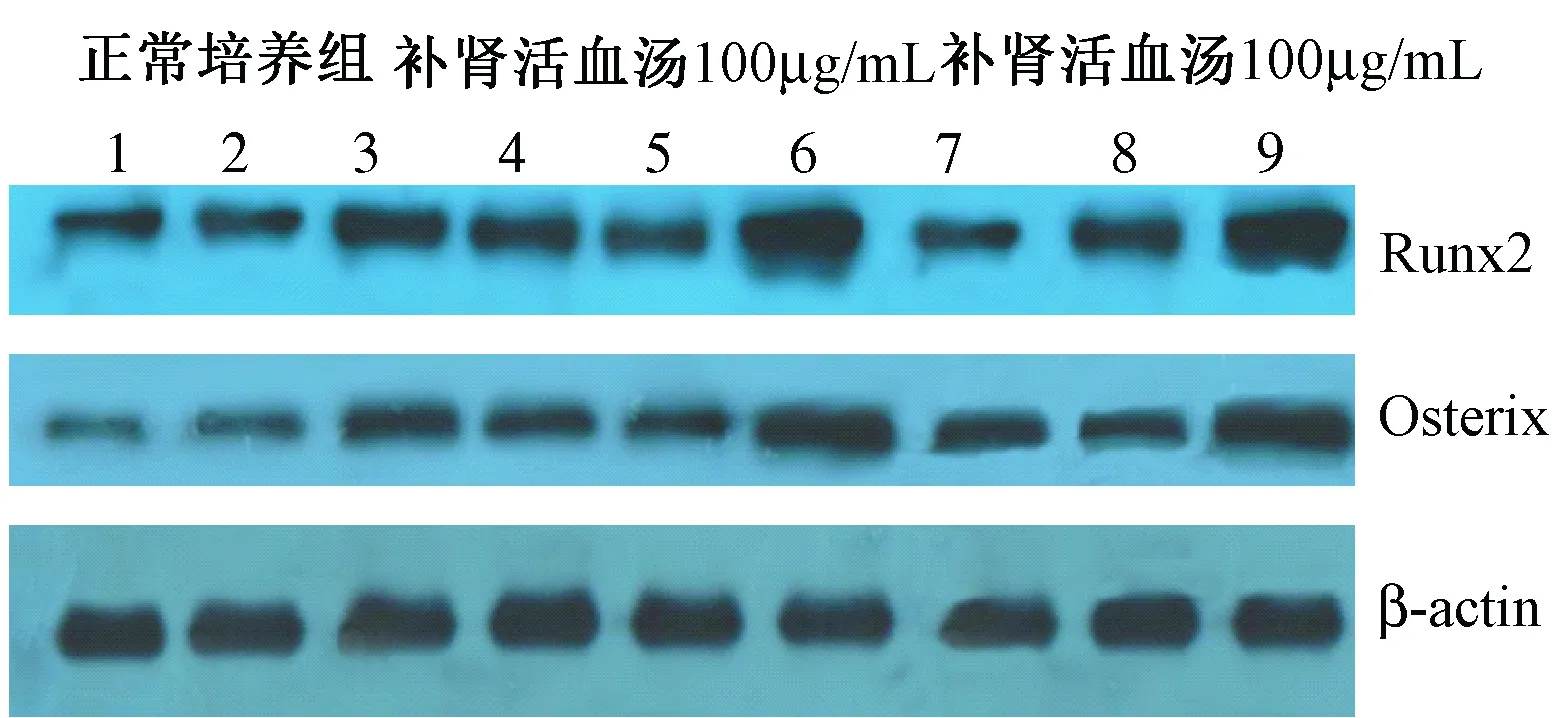
图4 WB检测BMSCs转染Runx2过表达后目的基因表达情况
3 讨论
骨质疏松性骨折的治疗包括外科治疗和骨质疏松性治疗。外科治疗能够维持骨折复位后的稳定性,抗骨质疏松治疗主要包括雌激素、降钙素、阿伦盐酸类等药物。临床上该种治疗方法顺应性差,费用高,给中老年患者带来诸多不便。中医药治疗骨质疏松性骨折具有明显优势,研究表明补肾活血法治疗骨质疏松性骨折具有良好的临床疗效。文献报道,补肾活血汤能够促进骨折愈合,缩短骨愈合时间[7-8]。实验研究发现,补肾活血汤能够改善局部血液循环,提高成骨细胞活性[9],可能与补肾活血中药促进BMSCs增殖和成骨分化有关。而Runx2和Osterix是BMSCs成骨分化过程中重要的转录因子。Runx2是决定多能的BMSCs分化为成骨细胞的关键因子,能促进成骨细胞分化,维持成骨细胞的功能并促进软骨细胞成熟[3]。RT-PCR结果显示,在慢病毒转染BMSCs中,Runx2和Osterix都明显增加,WB的结果与PCR的结果一致,相应蛋白表达量增加,说明在细胞水平上补肾活血汤能够明显调节成骨细胞分化的能力。在缺失Runx2的纯合子小鼠无法存活,骨骼均有软骨组成,无呼吸而死亡[10]。Osterix基因缺失则能够完全抑制成骨细胞分化,BMSCs不能沉淀成骨基质。
碱性磷酸酶(alkaline phosphatase ALP)ALP是常用的评价成骨分化中早期的检测指标之一,与成骨钙化密切相关。成骨细胞中的ALP能够产生磷酸,与钙生成磷酸钙沉积于骨中[11],是一种标志性的糖蛋白,在调节骨发育过程中具有双重性能,参与骨骼和牙齿的发育矿化,同时能够调节人体内钙磷等微量元素的平衡。ALP半定量活性测定显示,经过补肾活血汤作用过的成骨细胞ALP的含量明显增加,可能与Osterix的增加有关。但也有研究指出,Osterix对ALP表达活性呈现高抑制、低促进的特点[12]。WB的结果与ALP活性一致,从蛋白表达水平说明,Runx2能间接通过Osterix提高BMSCs的成骨分化能力。BMSCs表面还存在多种蛋白,多通路调节BMSCs的分化、成熟、迁移、归巢,如Sox9、MydD等,而Runx2/Osterix通路还能够影响其他细胞的分化状态,使其分化方向改变[13]。因此Runx2/Osterix在成骨细胞形成中至关重要,但Osterix基因在调控成骨细胞分化过程中是否有其他的转录因子参与还需进一步研究。本文通过慢病毒转染,进一步验证Runx2促进成骨分化的作用,并为其他通路的研究提供研究基础。
