猪圆环病毒3型的检测及其全基因进化分析
2018-09-10葛菲菲鞠厚斌杨德全周锦萍
葛菲菲,李 鑫,刘 健,鞠厚斌,杨德全,王 建,周锦萍
(上海市动物疫病预防控制中心,上海 201103)
猪圆环病毒(Porcine circovirus,PCV)是圆环病毒科、圆环病毒属的重要成员之一。该病毒包括2个基因型:1型和2型,即PCV1和PCV2[1]。PCV1是从猪肾上皮细胞(PK15)中分离出来的非致病性病毒粒子[2],而PCV2则是目前对全世界养猪业危害极大的病原体之一,给全球养殖业带来了巨大的经济损失[3]。2015年6月,美国北卡罗来纳州一个商品猪场母猪群暴发皮炎肾病综合征(porcine dermatitis and nephropathy syndrome,PDNS)。发病期间,该场母猪死亡率较历史平均水平增加了10.2%,受胎率减少了0.6%,窝均木乃伊胎相比历史平均水平增加1.19%,流产出的木伊胎大小不一。针对样本采用宏基因组测序后,发现1种基因型不同以往的圆环病毒,命名为PCV3[4]。何启盖等[5]开展我国PCV3临床调查,发现PCV3与母猪繁殖障碍疾病相关联,在我国8个省及1个直辖市均有分布。对PCV3全基因组及部分基因组序列进化分析表明,我国PCV3包括2个亚群:3a及3b,其中3a和美国参考PCV3/USA/MO2015(GenBank登录号:KX778720.1)毒株处于同一分支,具有很近的同源进化关系。本研究选取了2016年3月~2017年3月在上海市规模化养殖场采集的商品肉猪20份病料,进行猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome,PRRSV)、猪圆环病毒2型(Porcine circovirus type 2,PCV2)、猪伪狂犬病毒(Pseudorabies virus,PRV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪细小病毒(Porcine parvovirus,PPV)、猪乙脑病毒(Japanese encephalitis virus,JEV)和猪圆环病毒3型(Porcine circovirus type 3,PCV3)等病原体检测。
1 材料与方法
1.1 材料
1.1.1 样品来源 2016年3月~2017年3月年采集自上海市规模化养殖场的商品肉猪病料20份。
1.1.2 试剂 核酸提取试剂盒为MagPure Viral RNA KIT;猪繁殖与呼吸综合征病毒、猪圆环病毒2 型、猪伪狂犬病毒、猪瘟病毒荧光PCR试剂由北京生科尚仪科技有限公司提供;猪细小病毒、猪乙脑病毒荧光PCR试剂由广州维伯鑫生物科技有限公司提供。
1.2 病料核酸的提取 称取25 mg病料组织,加入1 mL无菌PBS研磨,5000×g离心1 min,弃掉上清。总核酸的分离纯化按照磁珠法病毒RNA抽提试剂盒操作手册进行。
1.3 荧光PCR检测 PRRSV、PCV2、PRV、CSFV、PPV、JEV荧光PCR检测方法均按照试剂盒说明书进行。
1.4 PCV 3的检测 引物设计参考文献[5]。
1.5 病毒分离 对PCV3检测阳性样品进行病毒分离。将样品接种于长成单层的PK15细胞,吸附1~2 h,弃去液体,加入10 mL病毒维持液(DMEM+2%FBS),于37℃、5%CO2培养箱静置培养4~5 d,每天观察细胞变化。如无病变则于培养后的4~5 d收取上清,传代至第3代仍无病变判为阴性;如出现病变则冻融3次细胞收毒,-30℃保存备用。
1.6 基因cDNA核苷酸序列分析比较 借助DNA Star4.0分析软件,通过Jotun Hein方法分析比较所得序列的同源性。
1.7 绘制系统发育树 借助MEGA3.1分析软件,确定获得毒株基因的遗传进化情况。
2 结果
2.1 PCR检测结果 20份病料中只有1份病料PCR检测出PRRSV阳性,PCV2、PRV、CSFV、PPV、JEV均为阴性;2份病料呈PCV3阳性,其中1份为PCV3和PRRSV混合感染。这2份病料均为2016年7月采集,PCR检测结果见图1,产物大小与参考文献[3]报道一致,约为649 bp。全基因PCR扩增结果详见图2,产物大小与参考文献[5]报道一致,分别为1075 bp和1257 bp。
2.2 病毒分离 对PCV3阳性样品在PK15细胞上进行了病毒分离,在PK15细胞上盲传至第3代后,经PCR鉴定未分离到PCV3。
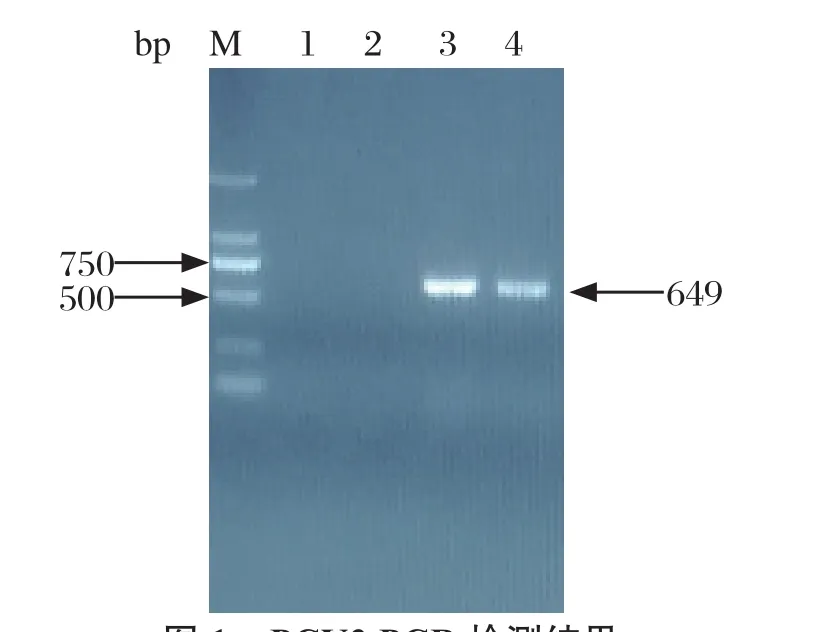
图1 PCV3 PCR检测结果Fig.1 Detection result of PCV3 by PCR
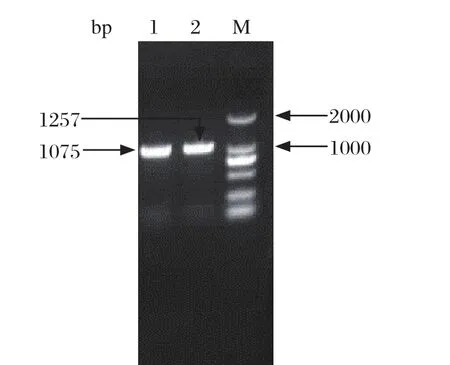
图2 PCV3全基因PCR扩增结果Fig.2 Amplification of PCV3 whole genome by PCR
1: nt1120~2195 PCR扩增产物; 2: nt1~1257 PCR扩增产物; M:DNA 分子量标准(DL2000)1: nt1120-2195 PCR products; 2: nt1-1257 PCR products; M:DNA Marker(DL2000)
2.3 基因同源性以及进化关系分析 将2份PCV3阳性样品分别命名为PCV3/CHN/Shanghai/0706/2016(GenBank登录号:KY865242)和PCV3/CHN/Shanghai/0708/2016(GenBank登录号:KY865243),他们与中国来源的PCV3分离株(全基因GenBank登录号:KY075986.1~KY075994.1、囊膜蛋白GenBank登录号:KY075995.1 ~KY076027.1)以及美国PCV3/USA/MO2015株(GenBank登录号:KX778720.1)的全基因以及囊膜蛋白的核苷酸同源性分别为98.8%~99.1%和97.5%~98.9%;本研究中的PCV3/CHN/Shanghai/0706/2016、PCV3/CHN/Shanghai/0708/2016株与中国来源的PCV3分离株全基因以及囊膜蛋白的核苷酸同源性分别为98.8%~100%和97.7%~100%。在全基因进化树中,中国来源的PCV3毒株和美国PCV3/USA/MO2015株在同一群中(图3A),在囊膜蛋白基因的进化树中,本研究中的PCV3/CHN/Shanghai/0706/2016和PCV3/CHN/Shanghai/0708/2016株属于PCV3a(图3B)。
3 讨论
本研究对2016年3月~2017年3月采集自上海市猪场20份病料进行病原体检测,在2016年7月采集的2份流产胎儿中检测到PCV3,这2份阳性样本来源于不同的规模化猪场。调查显示,这2个猪场的流产比例在3%左右,木乃伊比例从2016年2月份的1.9%上升到3.5%,其他生产情况无明显变化。说明PCV3可以发生垂直传播,即病毒可以通过胎盘感染孕期胎猪[6]。其中1份阳性样品为PCV3和PRRSV的混合感染。此外我们也尝试了使用PK15细胞进行了PCV3的分离,结果未成功分离到PCV3,这和Palinski等[7]报道一致,在第1代细胞中PCV3 PCR检测即为阴性,可能与样品前处理过程有关。研磨病料时,加含抗菌素的PBS制成体积分数为20%的组织悬液,离心取上清后,再用0.2μm滤器过滤,最后感作PK15细胞,加入维持液培养,这样的操作会导致病毒的稀释。
根据部分囊膜蛋白基因序列进行基因进化分析,本研究中的PCV3/CHN/Shanghai/0706/2016和PCV3/CHN/Shanghai/0708/2016株属于PCV3a。基因组全序列分析发现,PCV3基因组包含2 kb核苷酸,具有与PCV1和PCV2相似的基因组结构,主要编码Cap和Rep 2个蛋白。在cap和rep基因5'端包含有一个由9个碱基(TAGTATTAC)组成的茎环结构,其碱基组成与PCV1的茎环结构上的序列完全一致。PCV3 Cap有214个氨基酸残基,较PCV2 Cap少19~20个,此外,与PCV2和鸭圆环病毒相比,PCV3 cap基因相似性仅为36%~37%。PCV3 rep基因编码297个氨基酸残基,与GenBank数据库其他毒株比较发现,该Rep氨基酸与先前在美国报道的1株PCV毒株(GenBank登录号:ADU77001)具有较高的相似性(69.4%);与我国分离到的蝙蝠圆环病毒的Rep相似性为54%。目前我们对于PCV3 的认识仍极为有限。展望未来,我们需要从以下几个方面加强对PCV3的研究和探索:分离到PCV3 毒株并建立起细胞培养体系;开展动物回归试验;对PCV3 进行基础的病原学研究。目前对PCV3 Cap结构及抗原性分析发现,PCV2和PCV3表现出很大的差异[8],推测PCV2和PCV3不具有交叉免疫保护的特性。因此,针对PCV3进行新的疫苗研究和开发,对于将来控制PCV3流行是十分必要的。
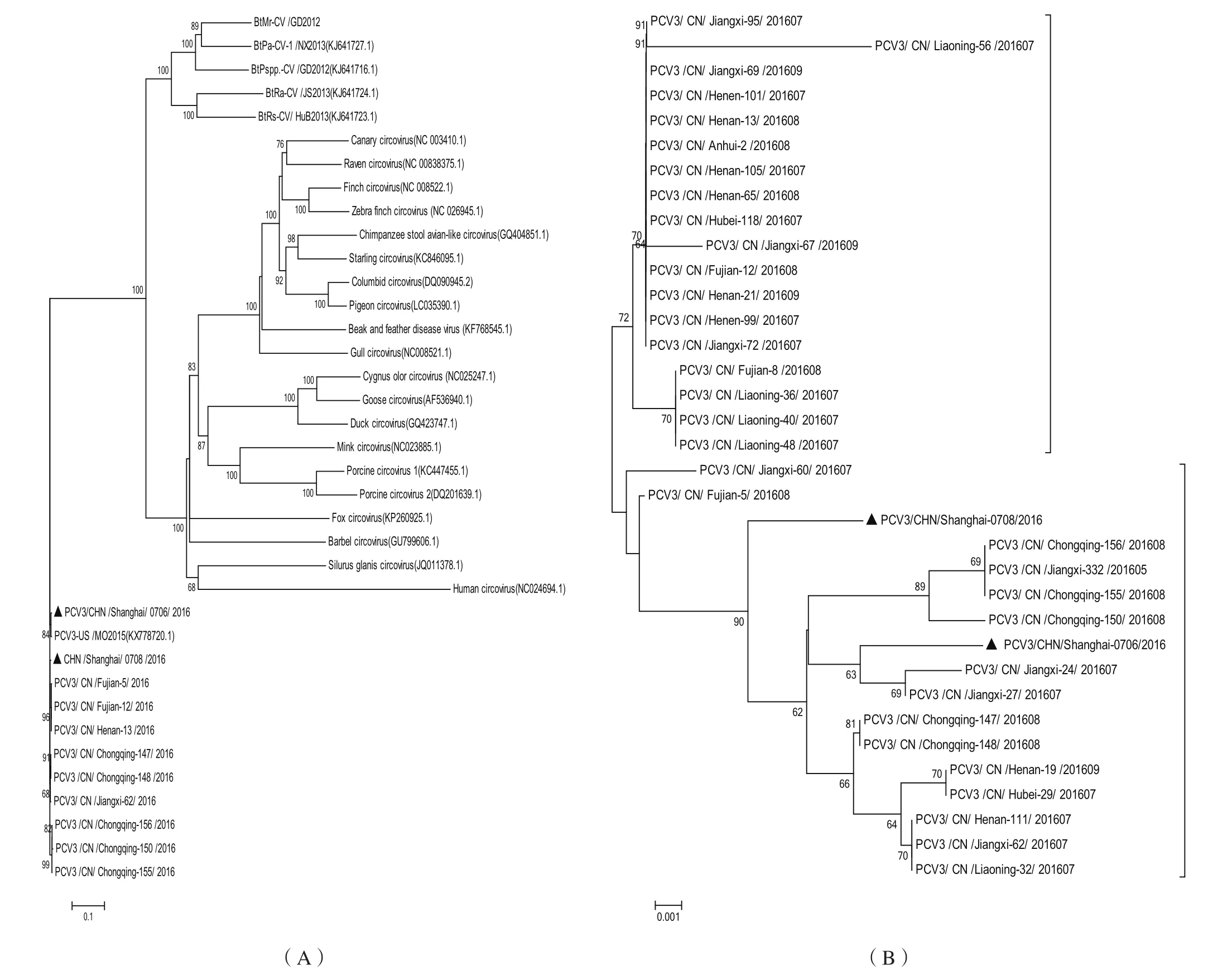
图3 不同中国PCV3分离株全基因(A)和部分囊膜蛋白基因(B)的遗传进化分析Fig.3 Phylogenetic trees of the whole genomes (A)and partial capsid genes (B) of PCV3
