非功能性胰腺神经内分泌肿瘤伴肝转移1例
2018-09-07王宇蔚
王宇蔚
作者单位:华中科技大学同济医学院附属同济医院肝脏外科,湖北武汉 430030
胰腺神经内分泌肿瘤(Pancreatic Neuroendocrine Neoplasms,PNENs)是一种较罕见的起源于胰腺神经内分泌细胞的胰腺肿瘤,是胃肠胰神经内分泌肿瘤(gastroenteropancreaticneuroendocrine neoplasms,GEP-NENs)的一种,其在起源、形态和功能上具有相似性,但由于基础研究成果有效,病因尚未明确。PNENs由于发病率低,临床认识不足,且临床表现较为复杂,实验室检查无明显特异性,PNENs的诊治有一定难度,尤其伴随其他脏器转移时,治疗方式更为有限。肝脏作为PNENs的常见转移部位,临床上外科手术切除肿瘤部位是最有效的治疗方式。本文报道1例我院收治非功能性胰岛细胞瘤病例,经历了诊断纠正的过程,并采用个体化治疗方式,取得理想的治疗效果。
1 病例介绍
1.1 基本资料
患者,男性,51岁,于2017年8月因“体检发现肝脏占位性病变2天”就诊。外院腹部CT提示:肝左外叶肿瘤性病变伴肝内多发转移灶,脾门区软组织影,考虑转移。入院体检无明显阳性体征。实验室检查示肝肾功能、乙肝标志物、肝脏肿瘤标记物等血清学指标均阴性。腹部增强CT:肝左外叶巨块状肿块及肝右叶散在异常强化灶,考虑肿瘤性病变伴肝内转移;胰腺尾部占位性病变,考虑肿瘤性病变。初步诊断为肝脏肿瘤伴多处转移,并行一次肝动脉化疗栓塞术(TACE)治疗。后经全院会诊,再次行腹部MRI,提示:胰腺尾部肿块,神经内分泌瘤可能,肝脏多发转移伴左肝管部分分支及门脉左支受压。
1.2 治疗及病理
患者随后行胰体尾切除+脾切除+肝多发转移瘤切除术(左外叶切除+尾状突部分切除+4b段、5段部分切除+7、8段肿瘤微波固化术),术后病理:胰腺神经内分泌肿瘤(NET,G1),伴肝脏多发转移。免疫组化:Syn(+),CgA(+),CD56(部分+),PCK(+),EMA(+),CK19(+),CD99(+),cdx-2(+),villin(部分+),ck7(灶+),ck20(灶+),Ki67(约2%)。术后恢复后,于肿瘤科行一线注射用醋酸奥曲肽微球(善龙)治疗,患者现每月肌注注射用醋酸奥曲肽微球(善龙)。
1.3 随访
患者随访至术后10个月,持续注射用醋酸奥曲肽微球(善龙)治疗,门诊行肝脏MRI检查,见肝脏转移瘤有复发征象,其余腹腔未见转移复发。血常规、血生化、肝脏肿瘤标志物等未见异常。
2 讨论
2.1 发病机理
胰腺神经内分泌肿瘤(Pancreatic Neuroendocrine Neoplasms,PNENs)是起源于胰腺神经内分泌细胞的肿瘤,是胃肠胰神经内分泌肿瘤的一种,后者是一组在起源、形态、功能上相似的消化系统肿瘤[1],其中在我国尤以胰腺神经内分泌肿瘤发病率最高[2]。临床上根据PNENs发病时是否伴随其他内分泌症状而将其分为功能性和非功能性,前者包括胰岛细胞瘤等,以全身内分泌症状以首发表现,后者常以脏器占位性病变为主要症状,其中肝脏是PNENs最常见的转移部位。有文献报道,CD10及CD44的异常表达可能与PNENs相关[3-4]。另有学者研究表明,Survivin基因阳性表达与PNETs预后不良相关[5],但PNENs的发病机制尚待进一步明确。
2.2 临床特点
本病在胰腺肿瘤中较罕见,多发生于30~50岁,女性发病率略高于男性。在所有PNENs中,非功能胰腺内分泌肿瘤占45%~60%[6]。本病早期症状较隐匿,进展缓慢,缺乏特异性症状和体征,多以体检时发现脏器占位或肿瘤压迫周边脏器引起相关症状而就诊,,且症状多以腹痛、体重下降、黄疸等常见[7]。实验室检查尚无特异性指标,诊断多依赖于影像学和病理诊断,见图1-4。
2.3 影像学表现
影像学诊断对于PNENs的早期检出、肿瘤进展监测以及治疗效果评估都有着重要的临床意义,尤其对于可外科切除的病例,有助于确定手术范围及切除方案。常用手段有超声、CT和MRI。对于提供肿瘤毗邻、淋巴结和血管侵犯信息,MRI优势明显。肿瘤的强化方式不一,可能与PNENs的肿瘤级别和肿瘤内部纤维化成分、血管成分的不同有关[8]。超声内镜(EUS)对于微小病灶有更高的分辨率和检出率,同时可以在内镜引导下行穿刺活检,明确肿瘤病理类型。其他常用的影像学手段还有核医学检查,如生长抑素受体扫描,以核素标记的生长抑素类似物奥曲肽为显影剂,与肿瘤表面的生长抑素受体结合从而显影,对于PNENs的诊断具有很高的敏感性和准确性[9]。
2.4 病理学表现
2010年WHO分类以Ki-67增殖指数和核分裂象将该类肿瘤进行分级:(1)NENs,低度恶性(G1级),核分裂象<2个/10 HPF,Ki-67增殖指数<3%;(2)NENs,中度恶性(G2级),核分裂象为2~20个/10 HPF或Ki-67增殖指数为3%~20%;(3)小细胞或大细胞神经内分泌癌,高度恶性(G3级),核分裂象>20个/10 HPF或Ki-67增殖指数>20%;(4)混合腺神经内分泌癌,同时含有腺管样上皮或神经内分泌细胞,两组成分均具恶性潜能,每一组成分至少要超过30%;(5)增生性和瘤前病变。免疫组化的相关指标如嗜铬蛋白A(CgA)、神经元特异性烯醇化酶(NSE)、突触素(Syn)、胰多肽(PP)等常作为PNENs的诊断指标。Ki-67可用来提示PNENs的细胞增殖状态,对于预测PNENs的治疗效果有一定的临床意义[10]。
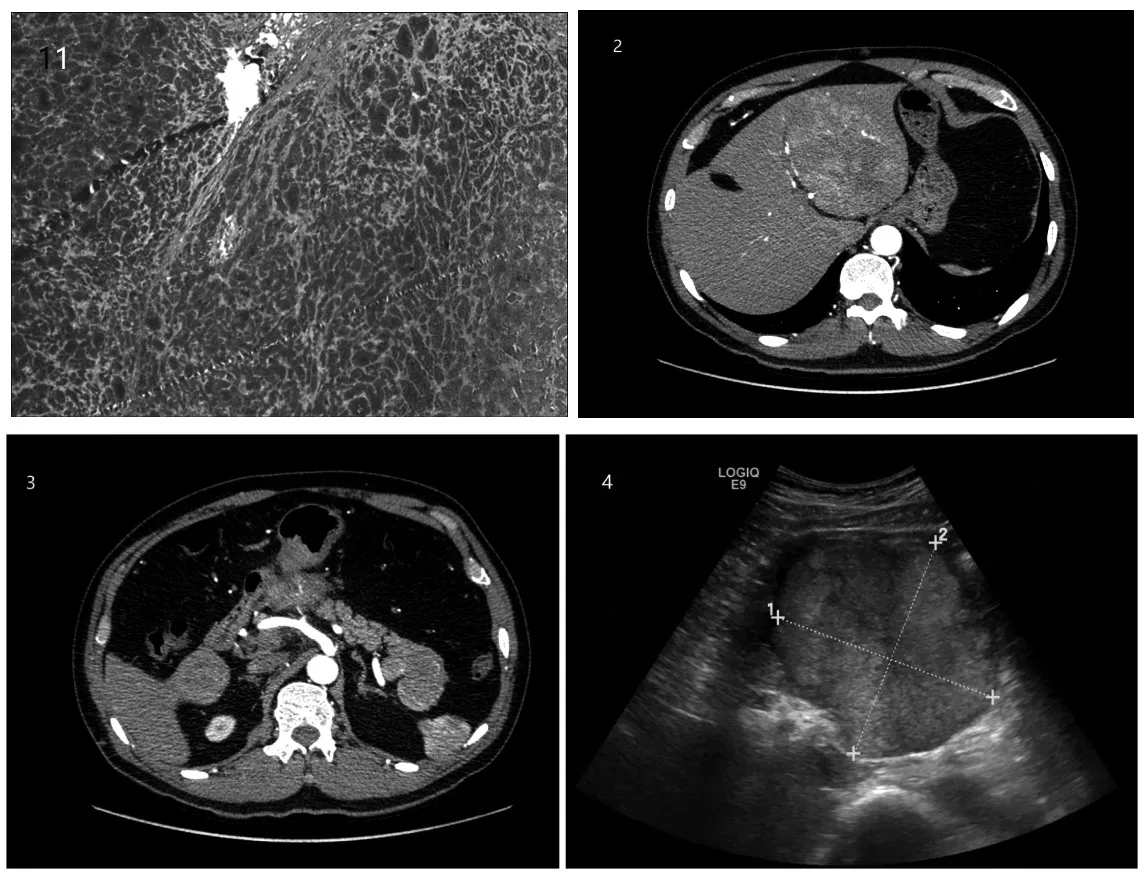
图1 术后病理胰腺神经内分泌肿瘤(NET,G1),伴肝脏多发转移 图2及图3 胰腺尾部占位、肝左外叶巨块状肿块、肝右叶散在异常强化灶,均考虑肿瘤性病变 图4 肝左外叶一10.8 cm×10.6 cm低回声区,考虑肿瘤性病变
2.5 治疗及预后
目前由于机制不明,PNENs的最佳疗方案仍为外科手术切除,切除范围标准以能达到根治为标准,需考虑患者年龄、基础疾病、肿瘤大小、位置、毗邻以及是否有内分泌症状等,可根据术前评估采取不同手术方式。2013年NCNN指南中也建议了相应的手术方式,例如局部肿瘤切除、胰腺部分切除、胰十二指肠切除术联合脾切除、淋巴结清扫以及伴有肝转移时可采取转移灶和原发灶同时切除的方式。但局部进展的患者,手术方式以减瘤为主,以提高生存质量、延长生存时间。射频消融、选择性肝动脉化疗栓塞术等常用于伴有肝转移或不可切除的PNENs患者[11]。对于伴有肝转移的患者,肝移植也可作为一种治疗方式。2001年米兰标准提出符合以下标准的PNENs患者可考虑肝移植治疗:(1)PNENs分化良好;(2)原发灶肿瘤由门脉系统引流;(3)患者年龄<55岁;(4)肝移植手术前肿瘤状况稳定超过6个月;(5)肝移植手术前原发灶已实现R0切除,并进行了广泛淋巴结清扫;(6)转移灶累及肝脏体积<50%;(7)肿瘤侵袭性低(Ki-67<5%);(8)患者没有严重的肝外疾病。此外,非手术治疗还包括:(1)系统化疗:链佐霉素联合氟尿嘧啶,文献报道有效率为35%~40%。(2)生长抑素:长效奥曲肽可抑制功能性胰腺内分泌肿瘤,如抑制胰岛细胞瘤分泌胰岛素等。(3)靶向药物:依维莫司和舒非替尼,可延长PNENs的无进展生存期。
3 结论及展望
胰腺神经内分泌肿瘤(PNENs)是一种发病率较低的恶性肿瘤,非功能性PNENs比例较高,发病具有一定隐匿性,加之病因机制不明,常常造成漏诊或误诊。影像学检查,尤其超声联合CT或MRI可有助于鉴别和早期检出PNENs,病理活检有助于早期证实诊断以及提供有效的治疗方向。PNENs具有其他恶性肿瘤共同的特征,即基因不稳定性,一旦发生基因改变,更容易发生转移和侵袭,治疗更加困难。外科治疗是本病首选治疗方案,但部分患者常常因PNENs的其他脏器转移而导致失去外科治疗机会。肝移植可作为伴有肝转移的PNENs患者的最后外科治疗手段。近年来,分子靶向药物的出现对于晚期PNENs以及伴多处转移患者提供了新的治疗希望,对于PNENs的研究也深入到了基因和染色体层面,相信在不久的将来,对于PNENs的综合性、个体化治疗将会更有成效。
