超高压处理对乳清分离蛋白凝胶特性的影响
2018-09-06卫永华刘永娟杨莉张志健刘会平
卫永华 ,刘永娟,杨莉,张志健,刘会平
1(山西师范大学 食品科学学院,山西 临汾,041000) 2(陕西理工大学 生物科学与工程学院,陕西 汉中,723000) 3(天津科技大学 食品工程与生物技术学院,天津,300457)
超高压(ultra-high pressure,UHP)处理技术是21世纪备受食品研究者关注的一种食品冷加工技术。与热处理相同,它也可以引起蛋白质变性、伸展[1-2],内部疏水基团暴露。若此时蛋白质浓度、pH值、压力大小、处理时间等因素合适,分子间或分子内的氢键、二硫键、范德华力、疏水作用力等将相互作用,形成稳定的、包裹有水分或其他成分的三维网状结构,即超高压凝胶。由于超高压处理不会破坏氨基酸、维生素、色素和风味物质等低分子化合物中的共价键,故可以较大程度地保持食品原材料的色、香、味及营养成分[3-4],加工出质地、消化性、风味等与热处理不同的蛋白质凝胶[5-7]。
近几年来,超高压技术在乳制品、鱼糜制品以及蛋白质凝胶食品中有着广泛的应用。付强认为鲢鱼鱼糜经超高压处理后,不仅凝胶品质显著提高,而且风味和营养成分损失较小[8]。王安琪等认为,处理压力的增大有利于提高鱼糜样品的剪切力、硬度、回复性、弹性和咀嚼性,且相关指标显著优于传统热杀菌(巴氏灭菌和高压蒸汽灭菌)[9];郭丽萍研究了超高压结合热处理对猪肉蛋白质相互作用力的影响,发现处理后的肌原纤维蛋白质巯基含量极显著下降(p<0.01),二硫键含量、疏水性极显著上升(p<0.01)[10]。王苑等认为肌原纤维蛋白与大豆分离蛋白经超高压处理后所得新型凝胶的硬度、弹性及保水性均比传统热凝胶要好,且结构光滑致密[11]。
乳清蛋白具有良好的凝胶特性和营养特性,其在凝胶食品的组织结构调整方面具有广泛的应用[12-14]。然而,目前国内关于超高压处理对乳清蛋白凝胶影响的研究还未见报道。本研究以乳清分离蛋白(whey protein isolated,WPI)为试验原料,对其进行不同压力、时间、WPI浓度、pH值和CaCl2条件下的超高压处理,以考察超高压处理条件对乳清分离蛋白凝胶特性的影响,为乳清蛋白在超高压凝胶食品中的应用奠定理论基础。
1 材料与方法
1.1 试验原料
乳清分离蛋白(WPI)(采用低温离子交换技术生产,蛋白质质量分数92%),购于美国Hilmar公司;其他所有试剂均为分析纯。
1.2 主要仪器与设备
HPP.M1型超高压处理设备,天津市华泰森淼生物工程技术有限公司;Anke TDL-5-A台式离心机,上海安亭科学仪器厂;JSM-6380LV扫描电子显微镜,日本电子株式会社JEOL;TA3XT Plus型质构仪,英国Stable Micro System公司。
1.3 试验方法
1.3.1 超高压WPI凝胶制备工艺[15]
使用封口机将配制好的WPI溶液密封于耐高压的聚乙烯袋中(不留气泡),然后放入压力腔内,浸没于传压介质中,设置压力和时间参数后进行超高压处理。处理后样品置冰箱4℃保藏,所有性质的测定在24h后进行,即只考虑不可逆的变化。
1.3.2 超高压处理条件对WPI凝胶特性影响的研究
以凝胶强度、保水性和得率为考察指标,分别进行处理压力(100、200、300、400和500 MPa)、处理时间(10、20、30和40 min)、蛋白质质量浓度(120、140、160、180、200、220 g/L)、pH(3.0、4.0、5.0、6.0、7.0和8.0)和CaCl2浓度(0.03、0.06、0.09、0.12、0.15和0.18 mol/L)的单因素试验。
1.3.3 WPI凝胶强度的测定[16]
将超高压处理凝胶用质构仪的TPA软件系统测定。采用直径为6 mm的圆柱型探针(P/6)以1 mm/s的恒定速度穿透凝胶,凝胶块高度为10 mm,直径24 mm。凝胶的硬度以探针的第一次压缩循环中的最大力来表示,单位用g表示。所有测定值采用附属解析软件分析后直接从电脑中输出。每个条件取3个样品测定求其平均值。
1.3.4 WPI凝胶保水性测定[17]
将5 g左右凝胶放入离心管中于5 000×g离心10 min,然后倒出离心管内游离水分,称重。每个样品平行测定3次,取其平均值。凝胶的保水性(water-holding capacity,WHC)则为:
WHC/%=(w2/w1)×100
(1)
式中:w1,离心前凝胶的质量,g;w2,离心后凝胶的质量,g。
1.3.5 WPI凝胶得率测定
用吸水纸除去凝胶表面的水分后,称取凝胶块质量。凝胶得率计算公式如下:
Y/%=(m2/m1)×100
(2)
式中:m1,超高压处理前WPI溶液质量,g;m2,超高压处理后形成凝胶块的质量,g。
1.3.6 WPI凝胶微观结构观察[17]
将凝胶样品切成2 mm×2 mm×1 mm的小片,用2.5%(体积分数)戊二醛在4 ℃条件下固定16 h,再分别用30%、50%、70%、80%、90%、95%、100%(体积分数)的酒精溶液依次脱水,然后进行冷冻干燥,最后进行离子溅射镀金处理,用扫描电子显微镜观察凝胶的微观结构。
1.3.7 WPI凝胶(或溶液)样品中巯基和二硫键含量的测定
超高压凝胶(或溶液)样品中的巯基和二硫键含量分析采用郭丽萍的Ellman试剂分析法进行[10]。每个样品平行测定3次,取其平均值。
1.3.8 数据处理
所有试验结果用平均值±标准误差表示。试验数据采用SPSS 19.0数据分析软件进行处理。
2 结果与分析
2.1 处理压力对WPI凝胶的影响
2.1.1 处理压力对WPI凝胶特性的影响
将WPI样品分别溶解于pH 7.0、浓度0.06 mol/L的CaCl2溶液中,配制成质量浓度为160 g/L的溶液,分别经100~500 MPa的压力处理30 min,研究不同压力对凝胶特性的影响。结果如表1所示。
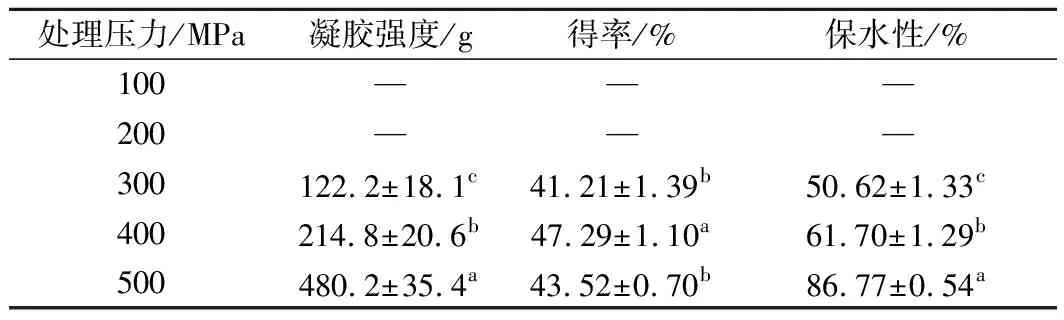
表1 处理压力对WPI凝胶特性的影响Table 1 The effects of applied pressure on the properties of WPI gel
注:表中同一指标值所标示字母不同时表示样品指标有显著差异(p<0.05),表2、3、4和5与此相同。
由表1可以看出,WPI溶液经100 MPa和200 MPa压力处理后不形成凝胶。当处理压力达到300 MPa时,形成凝胶的强度、得率和保水性均很低。随着压力的继续升高,凝胶强度和保水性均显著增加(p<0.5)。但WPI凝胶得率在400 MPa具有最大值,随后呈现降低的趋势。这意味着变性乳清蛋白在400 MPa时对水分的包裹能力最强,当压力进一步增大时,可能凝胶网络结构受到的挤压作用也随之增大,造成水分流失,得率下降[18]。
2.1.2 处理压力对WPI凝胶中巯基和二硫键含量的影响
处理压力对凝胶中巯基和二硫键含量影响的结果如图1所示。

图1 处理压力对WPI凝胶中巯基和二硫键含量的影响Fig.1 The effects of treatment pressure on SH group and disulfide bond content in WPI gel processed by UHP注:图中同一指标值所标示字母不同时表示样品指标有显著差异(p<0.05),图3、5、7和9与此相同。
天然β-乳球蛋白中包埋着许多疏基,在超高压的作用下,β-乳球蛋白分子变性,球状结构遭到破坏,内部的疏水基团暴露于溶剂当中。新暴露出来的巯基将在氧化作用或巯基/二硫键交换作用下形成二硫键,从而对WPI凝胶的网络结构起着重要的稳定作用[10]。由图1可以看出,随着压力增大,凝胶中巯基含量显著下降(p<0.01),二硫键含量显著上升(p<0.01)。这表明随着压力的增大,WPI分子中越来越多的巯基转化为二硫键,使蛋白质分子间的交联作用增强,凝胶品质得以提高。
2.1.3 处理压力对WPI凝胶微观结构的影响
处理压力对凝胶微观结构影响的结果如图2所示。
由图2可以看出,当处理压力为300 MPa时,球状蛋白分子展开程度低,变性蛋白质之间的交联作用也少,形成的网络结构中孔洞较大。随着压力的上升,二硫键广泛形成,蛋白质网络结构越致密,孔洞越细小[19-22]。这一方面提高了凝胶的强度,另一方面增加了凝胶体内毛细管作用力,有利于提高凝胶的持水能力和得率。另有报道,超高压有助于氢键的形成[23],这也是压力升高导致凝胶保水性增强的又一原因。
2.2 处理时间对WPI凝胶的影响
2.2.1 处理时间对WPI凝胶特性的影响
将WPI样品分别溶解于pH 7.0、浓度0.06 mol/L的CaCl2溶液中,配制成质量浓度为16 g/L的溶液,分别经500 MPa的压力处理10~30 min,研究不同处理时间对凝胶特性的影响。结果如表2所示。

表2 处理时间对WPI凝胶特性的影响Table 2 The effects of treatment time on the properties of WPI gel
质量浓度为160 g/L的WPI溶液在室温条件下,经500 MPa处理10 min就可形成凝胶。但由表2可知,处理时间≤20 min时,WPI凝胶强度和得率均较低,保水性也较差;处理时间高于20 min后,凝胶强度、得率和保水性均显著提高(p<0.5),但凝胶强度在处理时间超过30 min后,变化不显著(p<0.5)。有研究表明,超高压处理虽然可以促进蛋白分子变性、凝聚,但聚合到一定程度时,延长处理时间对蛋白交联效果影响不再显著,甚至会导致凝胶已有致密、有序网络结构的破坏,使其凝胶硬度降低[24]。
2.2.2 处理时间对WPI巯基和二硫键含量的影响
处理时间对凝胶中巯基和二硫键含量的影响如图3所示。
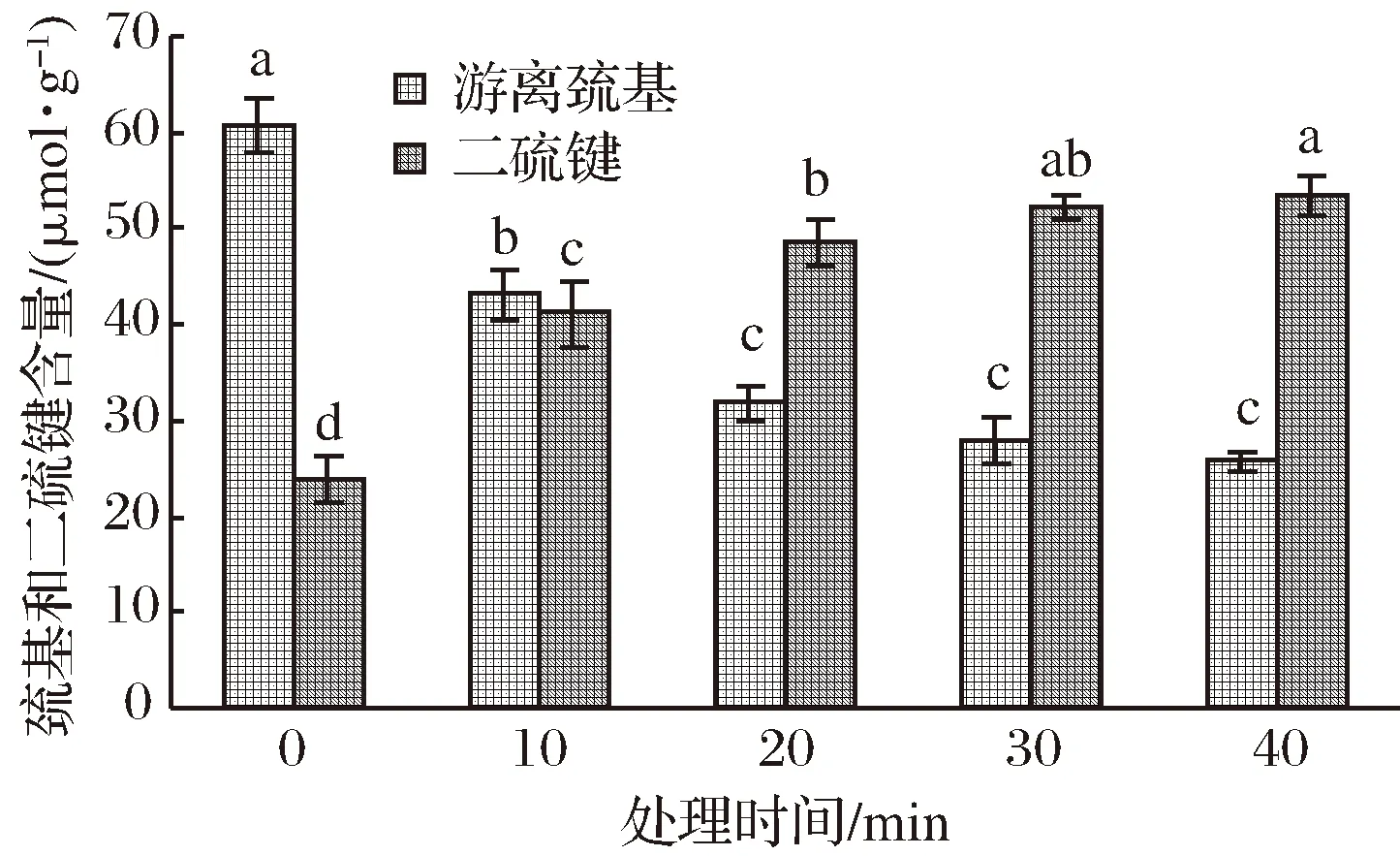
图3 处理时间对WPI凝胶(或溶液)中巯基和二硫键含量的影响Fig.3 The effects of treatment time on SH group and disulfide bond content in WPI gel or solution processed by UHP
由图3可以看出,WPI溶液经500 MPa的压力处理0~20 min时,巯基含量随处理时间的延长显著下降(p<0.01),二硫键含量显著上升(p<0.01)。而当处理时间大于20 min后,巯基含量变化不明显,二硫键的含量仍缓慢增加。但如2.2.1所述,此时二硫键含量的增加只引起凝胶得率和保水性能的提高,并未对凝胶强度产生影响。
2.2.3 处理时间对WPI凝胶微观结构的影响
处理时间对凝胶微观结构影响的结果如图4所示。
如图4所示,在500 MPa压力、处理时间为10 min时,WPI凝胶主要为颗粒状聚集物,蛋白质分子之间交联作用很弱;当处理时间延长至20 min时,蛋白质分子展开程度增大,初步形成一定的网络结构,但相互之间交联作用仍然较弱;WPI凝胶表现出较低的凝胶强度、得率和保水性。当处理时间分别为30 min和40 min时,WPI分子间的交联作用比较充分,网络结构更加致密,表现出较好的凝胶特性。由此可见,蛋白质凝胶网络的形成都需要一个过程,并非瞬间完成。

图4 不同处理时间下超高压WPI凝胶扫描电镜图Fig.4 The scanning electron microscopic pictures of gels processed by UHP with different treatment time
2.3 WPI质量浓度对凝胶的影响
2.3.1 WPI质量浓度对凝胶特性的影响
将WPI样品分别溶解于pH 7.0、浓度0.06 mol/L的CaCl2溶液中,配制成120~220 g/L的溶液,分别经500 MPa的压力处理30 min,研究不同WPI浓度对凝胶特性的影响。结果如表3所示。

表3 WPI浓度对凝胶特性的影响Table 3 The effects of protein concentration on the properties of WPI gel
前期预实验发现,质量浓度为100 g/L的WPI溶液在室温下,经500 MPa、30 min高压处理后不能形成凝胶。由表3可知,当质量浓度增至120 g/L时,即有较低强度的凝胶生成,并且凝胶强度随着蛋白质浓度的增大而增大。此结果表明,与热致凝胶相同,一定质量浓度的WPI也是超高压凝胶形成的基本条件[25]。
在质量浓度为120~220 g/L范围内,随着蛋白质质量浓度增加,凝胶得率提高幅度较大(p<0.5)。这说明高蛋白浓度凝胶包裹水分的能力要明显高于低浓度蛋白凝胶。当WPI质量浓度大于180 g/L时,凝胶保水性呈现下降趋势(p<0.5)。这可能是对蛋白质网络较大的包裹能力而言,水分相对不足造成的。
2.3.2 WPI质量浓度对凝胶中巯基和二硫键含量的影响
WPI质量浓度对凝胶中巯基和二硫键含量的影响如图5所示。
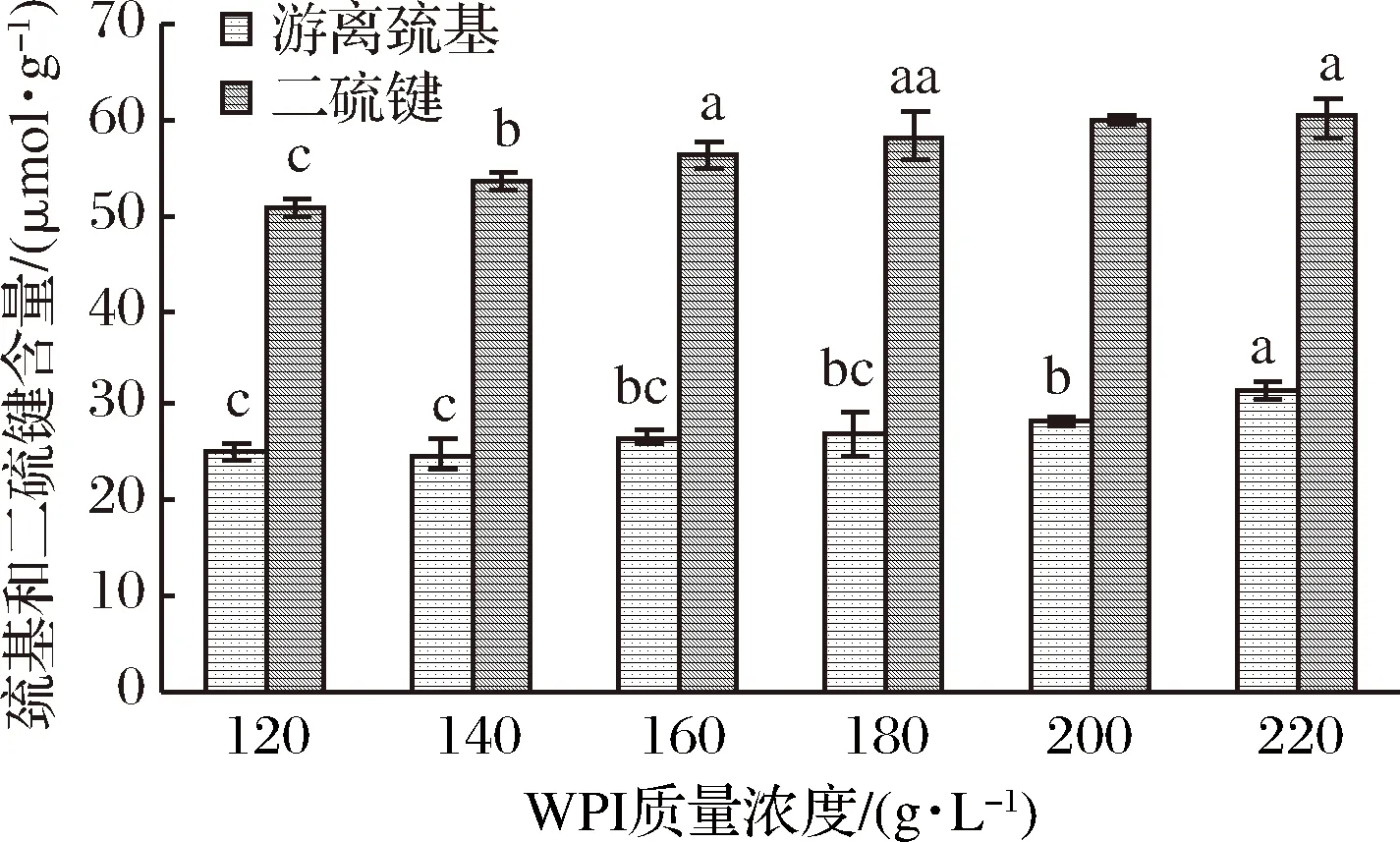
图5 蛋白浓度对WPI凝胶中巯基和二硫键含量的影响Fig.5 The effects of WPI concentration on SH group and disulfide bond content in WPI gel processed by UHP
由图5可以看出,不同WPI质量浓度溶液经500 MPa相同压力处理后,凝胶中的巯基和二硫键含量均随WPI质量浓度增加而增加(p<0.5),且较高WPI质量浓度(>160 g/L)凝胶中的二硫键含量要高于低质量浓度(<160 g/L)凝胶。这可能与高浓度凝胶中巯基更易碰撞、结合形成二硫键有关,也是高质量浓度WPI凝胶的特性整体上优于低浓度凝胶的原因。
2.3.3 WPI质量浓度对凝胶微观结构的影响
WPI对凝胶微观结构影响的结果如图6所示。
由图6可以看出,随着WPI质量浓度的增大,蛋白质分子侧链间相互交联的机会增大,蛋白质之间的交联作用逐渐增强,致使凝胶结构越牢固[26]。与此同时,凝胶网络中的孔洞逐渐减小,质地变得细腻。不同WPI质量浓度凝胶微观结构的观察结果与其二硫键含量的测定结果相符。

图6 不同WPI质量浓度的超高压凝胶扫描电镜图Fig.6 The scanning electron microscopic pictures of gels processed by UHP with different WPI concentration
2.4 pH对WPI凝胶的影响
2.4.1 pH对WPI凝胶特性的影响
将WPI样品分别溶解于pH 3.0~7.0、浓度0.06 mol/L的CaCl2溶液中,配制成160 g/L的溶液,分别经500 MPa的压力下处理30 min,研究不同pH值对凝胶特性的影响。结果如表4所示。
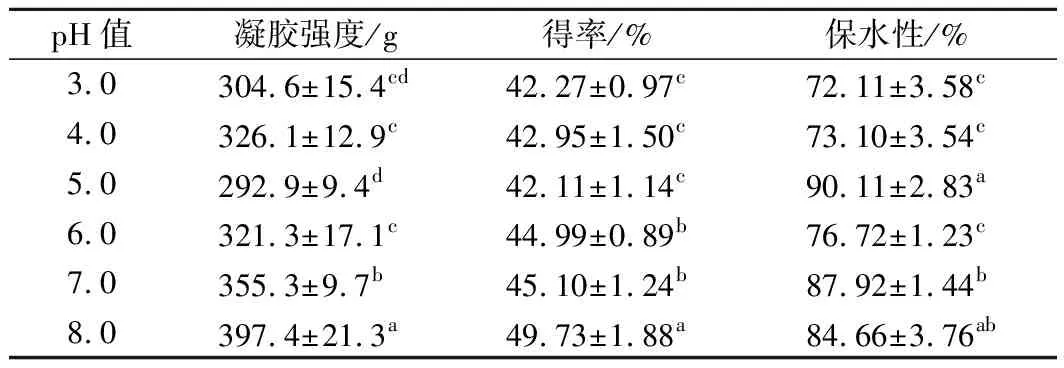
表4 pH值对WPI凝胶特性的影响Table 4 The effects of pH on the properties of WPI gel
pH值可通过改变分子的净电荷改变分子间的吸引力、排斥力以及分子和溶剂之间的相互作用,从而使不同pH值的蛋白质溶液形成凝胶的特性各不相同[27]。如表4所示,当WPI溶液pH值在乳清蛋白等电点(大约4.5~5.5)时,形成的凝胶强度、得率和保水性均较差。而WPI溶液pH值偏离等电点时,凝胶的品质则会升高,且偏中性环境的凝胶特性更高。
蛋白质在适宜pH值下才能接近到合适的距离,发生分子间的巯基-二硫键作用,完成分子交联。并且只有在二硫键与疏水作用力、静电作用力等达到平衡状态时,才能形成具有较高强度、得率和持水能力的不可逆性凝胶网络[25]。当pH值低于乳清蛋白等电点时,WPI凝胶则主要由分子间静电作用和离子键维持,分子间二硫键作用很弱,分子间作用力以斥力为主[28],所形成的凝胶的特性相对较低(p<0.5);在pH值高于乳清蛋白等电点的时候,凝胶中由分子间二硫键发挥主要作用,其各项品质指标均较高;在等电点附近,由于蛋白质分子带静电量最少,相互之间静电排斥也最小,蛋白质分子在展开之前就发生物理性凝聚[26],因而形成的凝块缺乏弹性,含水量和得率也较低。但本研究对凝胶保水性评价时,由于凝胶在离心前后水分损失量较小,反而使得凝胶在等电点时表现出较高的保水性。
2.4.2 pH值对WPI巯基和二硫键含量的影响
pH值对凝胶中巯基和二硫键含量的影响如图7所示。
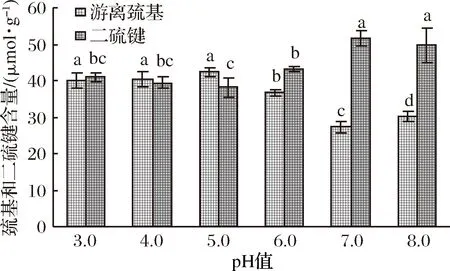
图7 pH值对WPI凝胶中巯基含量和二硫键的影响Fig.7 The effects of pH on SH group and disulfide bond content in WPI gel processed by UHP
由图7可以看出,在接近中性环境中,WPI凝胶中的巯基含量要明显低于强酸性环境,而二硫键含量变化趋势与巯基相反。这表明中性环境更有利于巯基/二硫键之间交换反应的发生。此结果与2.4.1部分中不同pH凝胶的品质表现趋势相一致。
2.4.3 pH值对WPI凝胶微观结构的影响
pH值对WPI凝胶微观结构影响的结果如图8所示。

图8 不同pH值下超高压WPI凝胶扫描电镜图Fig.8 The scanning electron microscopic pictures of gels processed by UHP with different pH
由图8可知,WPI溶液pH值在3.0~5.0时,经超高压处理生成的凝胶中并未表现出明显的网络结构,蛋白质分子仍以球状结构存在(图8-a、8-b和8-c),凝胶表现出较差的特性;当WPI溶液pH≥6.0,经高压处理生成的凝胶中,蛋白质分子展开程度明显增大,分子间相互作用增强,凝胶网络也越来越致密(图8-d、8-e、8-f)。相应地,凝胶的强度、保水性和得率均较高。此结果与不同pH凝胶中的二硫键含量测定结果相一致。
2.5 CaCl2浓度对WPI凝胶的影响
2.5.1 CaCl2浓度对WPI凝胶特性的影响
将WPI样品分别溶解于pH 7.0、浓度0.06~0.18 mol/L的CaCl2溶液中,配制成160 g/L的溶液,分别经500 MPa的压力下处理30 min,研究不同CaCl2浓度对凝胶特性的影响。结果如表5所示。

表5 CaCl2浓度对WPI凝胶特性的影响Table 5 The effects of CaCl2 on the properties of WPI gel
变性蛋白质分子由于静电排斥力而保持分离状态,加入金属盐,可以屏蔽这些静电排斥力,使尽可能多的蛋白质分子相互接近。另外Ca2+可与蛋白质通过氢键等形成“键桥”,这样可加速凝胶网络形成[28],提高凝胶颗粒硬度[29]。由表5可知,CaCl2在0~0.15 mol/L能够增加WPI凝胶强度(p<0.5);当CaCl2浓度大于0.15 mol/L时,则会引起凝胶强度下降,可能原因是上升的CaCl2浓度引起蛋白质的过度聚集,阻止了蛋白质凝胶网络形成,导致凝胶脆性的增加[30-31];WPI凝胶得率则随着金属盐浓度的上升呈下降趋势,可能是由CaCl2用量的增加造成变性蛋白质分子凝集速度过快,网状结构包裹的水分减少造成的。WPI凝胶保水性在CaCl2浓度为0.06 mol/L时具有最大值,CaCl2浓度进一步上升则会使蛋白质胶凝速度过快,颗粒大小不均匀,毛细管作用降低,最终导致凝胶保水性下降[32]。
2.5.2 CaCl2浓度对WPI巯基和二硫键含量的影响
CaCl2浓度对凝胶中巯基和二硫键含量的影响如图9所示。
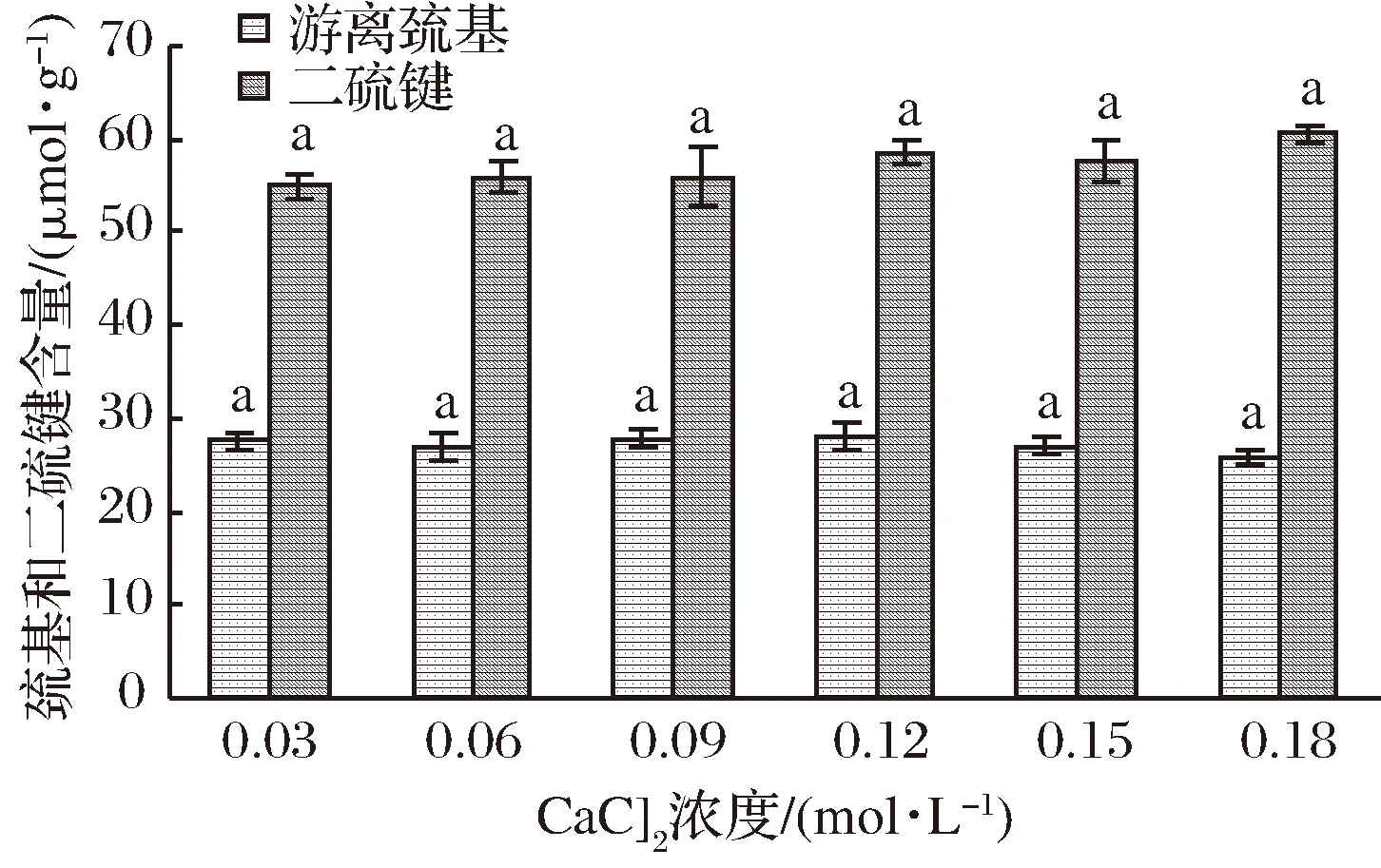
图9 CaCl2对WPI凝胶中巯基和二硫键含量的影响Fig.9 The effect of CaCl2 on SH group and disulfide bond content in WPI gel processed by UHP
由图9可以看出,CaCl2的添加对WPI凝胶中巯基和二硫键含量没有明显影响(p<0.5),这表明Ca2+对蛋白质分子中巯基的暴露与二硫键的形成没有影响。
2.5.3 CaCl2浓度对WPI凝胶微观结构的影响
CaCl2浓度对WPI凝胶微观结构影响的结果如图10所示。

图10 含不同浓度CaCl2的超高压WPI凝胶扫描电镜图Fig.10 The scanning electron microscopic pictures of gels processed by UHP with different CaCl2 concentration
如图10所示,随着CaCl2浓度的增加,蛋白质的交联作用增强,形成的凝聚体颗粒增大,有助于凝胶网络结构的形成。但当CaCl2浓度大到一定程度时,蛋白质发生过度凝聚造成网络空隙增大。这也是造成凝胶细腻程度变差、得率和保水性下降的原因。
3 结论
(1)当处理压力≥300 MPa、处理时间≥10 min、蛋白质质量浓度≥120 g/L时,WPI溶液经超高压处理后才可以形成凝胶,且随着处理压力增大、处理时间延长和蛋白质浓度的提高,凝胶中的游离巯基含量逐渐下降,二硫键含量明显增加,凝胶网络结构趋于致密,质地逐渐细腻,凝胶强度、得率和保水性呈现增大的趋势;
(2)WPI溶液pH在等电点以上且接近中性时,形成的凝胶中二硫键含量高,凝胶网络致密,凝胶强度、得率和保水性较高;在等电点附近及以下时,凝胶的特性和品质较差;
(3)添加CaCl2对形成凝胶中的二硫键含量不产生影响,但其可以通过键桥作用提高凝胶强度;凝胶得率与CaCl2浓度呈负相关;当CaCl2浓度为0.06 mol/L时,凝胶具有较大持水能力,之后保水性随Ca2+浓度的升高而下降。
