异氟醚抑制低氧/复氧诱导的肾小管上皮HK- 2细胞系内质网应激凋亡
2018-09-05李小山赵梓亦李国利
唐 静,胡 玲,刘 奉,李小山,赵梓亦,李国利
(重庆三峡医药高等专科学校 1.病原生物学与免疫学教研室; 2.基础医学部 病理学教研室;3.临床医学系, 重庆 404120; 4.成都中医药大学附属医院,四川 成都 641000)
肾缺血的灌注损伤发生机制复杂,与氧自由基增多、钙离子浓度失衡和能量代谢障碍等密切相关,也是导致急性肾衰竭的主要原因之一[1]。外科手术中肾缺血再灌注损伤是影响预后的主要原因之一。缺血再灌注可导致强烈的内质网应激(endoplasmic reticulum stress, ERS)并产生细胞凋亡[2],因此降低缺血再灌注损伤过程中的ERS非常重要。异氟醚是一种外科手术常用的修饰麻醉剂,对手术中产生的缺血再灌注损伤具有调节作用[3- 4,7]。本文研究了异氟醚对肾小管上皮细胞HK- 2低氧/复氧模型中ERS及其诱导的细胞凋亡的调控作用。
1 材料与方法
1.1 材料
1.1.1 细胞:人肾小管上皮细胞系HK- 2(中国科学院上海生命科学研究院细胞资源中心)。
1.1.2 试剂 Trizol、实时荧光定量PCR预混液和SuperScript III RT-PCR试剂盒(Life Technology公司);DMEM完全培养基、0.25%胰蛋白酶、青链霉素和10%澳洲胎牛血清(Gibco公司);DNA序列和引物(上海生工生物技术公司合成);Annexin V/PI染色试剂盒(Sigma-Aldrich公司);Anti-GRP78、Anti-CHOP和anti-caspase- 12 (Abcam公司)。
1.2 方法
1.2.1 细胞培养及分组处理:将细胞培养于10 cm培养皿中,DMEM完全培养基含有10%胎牛血清和100 U/mL青链霉素。细胞培养在5% CO2、饱和湿度、37 ℃的细胞培养箱内,每72 h更换培养基1次。当细胞汇合度达到80%~90%时传代。
将汇合度50%的细胞置于经95% N2-4.5% CO2-0.5% O2混合气培养箱中放置4 h;加入2.56%异氟醚处理的细胞为异氟醚组;加入相同体积PBS处理的细胞为Mock组;常规条件培养的细胞为对照组。
1.2.2 LDH含量的测定:将不同时间点的培养上清液50 μL加入新的96孔细胞培养板中,再加入50 μL底物,室温避光孵育30 min后,加入50 μL反应终止液,混匀后室温放置10 min,在490 nm下读取吸光度值;然后检测细胞总的LDH值。向原细胞培养孔中加入20 μL溶解酶,37 ℃孵育1 h后,每孔加入50 μL底物,室温避光孵育30 min后,加入50 μL反应终止液,混匀后室温放置10 min,在490 nm下读取吸光度值。计算方法为:上清液LDH分光光度计读取数值除去总的LDH分光光度计读取数值。
1.2.3 MTT法检测细胞增殖:向培养于96孔细胞板中的细胞加入10 μL/孔MTT(125 mg/L),放置于细胞培养箱中37 ℃反应2 h;去上清液,PBS冲洗3次并加入50 μL/孔二甲亚砜(DMSO),室温避光孵育30 min,在570 nm下读取吸光度值。
1.2.4 实时定量PCR检测GRP78和CHOP mRNA:用Trizol提取目的细胞的总RNA,根据SuperScript Ⅲ RT-PCR试剂盒说明书操作,进行反转录和荧光定量PCR。PCR程序如下:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火和延伸1 min,循环40次。涉及的引物序列如下:GRP78,F:5′-CATCACGCCGTCCTATGTC G-3′和R: 5′-CGTCAAAGACCGTGTTCTCG-3′;CHOP,F: 5′-TCTTGACCCTGCTTCTCTGG-3′ 和R: 5′-GCTGT GCCACTTTCCTTTCA-3′;caspase- 12,F:5′-CATCCAA CGGTGTTCTGGTC-3′和R: 5′-TTGCCTGCAATTTGA GCTGT-3′;β-actin,F:5′-CATGTACGTTGCTATCC AGGC-3′和R:5′-CTCCTTAATGTCA CGCACGAT-3′。
1.2.5 Western blot检测GRP78、CHOP和caspase- 12蛋白:目的细胞按1×106个细胞加入500 μL RIPA细胞裂解液的比例混合,并于液氮和37 ℃温水浴反复冻融裂解3次。4 ℃,12 000×g离心10 min沉淀细胞碎片,收集上清液。常规方法制备8%~10% SDS-PAGE胶,120 V稳定电压电泳1.5 h分离蛋白;半干转膜法(按恒流0.5 mA/cm2)进行转印。将目的抗体按1∶1 000的比例稀释,并室温孵育2 h,用辣根过氧化物酶标记的相应种属的二抗孵育,ECL显色,X线暗室曝光并显影定影。
1.2.6 流式细胞仪检测细胞凋亡:收集处理好的细胞,按照Annexin V-FITC/PI染色试剂盒说明书操作,并用流式细胞仪分析凋亡率。
1.3 统计学分析
2 结果
2.1 异氟醚处理对低氧/复氧模型HK- 2细胞损伤和细胞增殖的影响
低氧/复氧模型HK- 2细胞LDH释放量较对照组增加,细胞增殖减少(P<0.05)。与mock组细胞相比,2.56 %异氟处理4和8 h的LDH降低,MTT升高(P<0.05)(图1)。
2.2 异氟醚处理对低氧/复氧模型16HBE细胞凋亡的影响
低氧/复氧模型16HBE细胞中的凋亡率显著高于未处理组细胞(P<0.05)。2.56%异氟醚处理4和8 h时使细胞凋亡率降低(P<0.05)(图2,3)。
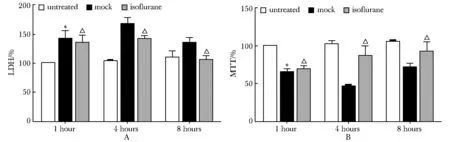
*P<0.05 compared with control group; △P<0.05 compared with Mock group图1 异氟醚诱导的HK- 2细胞低氧/复氧模型LDH释放量(A)和细胞增殖的变化(B)

图2 异氟醚诱导的HK- 2细胞低氧/复氧模型凋亡的annexin V-FITC/PI荧光染色的影响Fig 2 Effect of isoflurane on hypoxia/reoxygenation induced apoptosis by annexin V-FITC/PI

*P<0.05 compared with mock group图3 异氟醚诱导的HK- 2细胞对低氧/复氧诱导的凋亡率(%)的影响Fig 3 Effect of isoflurane on apoptosis induced by
2.3 异氟醚处理对低氧/复氧模型16HBE细胞内质网应激的影响
与mock组比较,4和8 h异氟醚组细胞的GRP78及caspase- 12的mRNA和蛋白水平显著升高(P<0.05),1 h异氟醚组变化不明显(图4)。各组中的CHOP的mRNA和蛋白水平无明显变化。并且,4和8 h异氟醚组细胞的caspase- 3的剪切体比例降低。

*P<0.05 compared with 1 hour treated group; △P<0.01 compared with 1 hour treated group图4 异氟醚诱导的HK- 2细胞低氧/复氧模型内质网应激的标志蛋白GRP78,CHOP和caspase- 12的mRNA和蛋白水平变化Fig 4 Effect of isoflurane on GRP78, CHOP, caspase- 12 mRNA and protein levels in HK- 2 cell line induced by ER hypoxia/reoxygenation
3 讨论
手术造成的缺血再灌注损伤发生机制复杂。肾小管上皮细胞具有丰富的内质网结构,在缺血再灌注过程中,细胞内堆积大量氧自由基,引起Ca2+浓度失衡、内质网功能障碍并激发ERS[5]。ERS对细胞起双向调节作用。适度的ERS可以调节钙离子浓度平衡、修复未折叠蛋白及回复内质网正常分泌功能;而过度ERS则可通过诱导细胞凋亡,加重缺血再灌注损伤[6]。因此,内质网应激的调控对缺血再灌注损伤的控制关系密切[7]。
本研究发现,异氟醚对肾小管上皮细胞HK- 2的低氧/复氧模型具有保护作用。与未处理组相比,低氧/复氧模型HK- 2细胞凋亡率明显增高,LDH增高,细胞增殖减少,说明低氧/复氧处理造成了细胞损伤及凋亡增加。异氟醚可以明显减少LDH含量,加速细胞的增殖。提示异氟醚可以缓解低氧/复氧处理对HK- 2细胞的损伤。Annexin V/PI荧光双标进一步确认了异氟醚的处理可以减缓低氧/复氧对HK- 2细胞的凋亡作用。RT-qPCR和半定量Western blot结果显示,低氧/复氧处理促进了ERS,并诱导细胞凋亡。Caspase- 12的表达量增加进一步说明,低氧/复氧处理引起的细胞凋亡是通过ERS诱发的。异氟醚对低氧/复氧模型肾小管上皮细胞系的保护作用可能是通过调控ERS引起的细胞凋亡实现的。造模后短时间异氟醚对细胞凋亡无影响,而较长时间则明显降低细胞凋亡,说明异氟醚对ERS的调控需要时间累积。而长时间异氟醚暴露并未明显降低ERS,提示异氟醚的作用可能是直接抑制ERS引起的细胞凋亡通路。
