代谢可塑性在肿瘤生长与转移中的研究进展
2018-09-05张译匀综述吴华星审校
张译匀 综述 吴华星 审校
肿瘤异质性是由癌细胞亚群中的遗传和表观遗传改变的特殊组合引起的。除遗传异质性之外,肿瘤代谢的改变与肿瘤细胞为适应环境做出代谢调整的能力,也决定了肿瘤异质性。代谢异质性是通过肿瘤内不同肿瘤细胞群之间或肿瘤与基质之间的代谢相互作用产生以及维持的[1]。
肿瘤生长过程中,癌细胞不仅对ATP的需求增高,还需要高水平的大分子(脂类和氨基酸)、还原当量(NADH,NADPH,FADH2)以及其他代谢反应所需要的因子以维持肿瘤细胞增殖[2]。癌细胞必须平衡能源生产和消耗过程以维持肿瘤的生长,同时还要适应自身快速生长所产生的营养和供氧变化。本文总结了肿瘤细胞在转移过程中代谢方式的改变,以及这些代谢的适应性改变是如何与肿瘤微环境相互影响从而调控肿瘤转移的。
1 肿瘤形成过程中的代谢策略
虽然正常的细胞可以氧化不同的底物产生能量,但葡萄糖仍是主要的能量来源。未癌变的细胞主要通过线粒体氧化磷酸化(OXPHOS)产生大量的ATP,它使得葡萄糖最有效率的生产ATP。氧分子是在氧化磷酸化生成ATP时所必需的,当氧分子受到限制时,如在缺氧条件下,分化的细胞将利用无氧糖酵解的方式使葡萄糖代谢为乳酸,这使得葡萄糖分解产生的ATP减少(每分子葡萄糖产生2分子ATP)。近年来,许多与代谢可塑性相关的基因被研究发现,其中包括一些重要的转录因子、microRNA以及LncRNA,这些研究成果为我们今后研究糖代谢可塑性提供了重要方向。
1.1 糖酵解
与未癌变的细胞相比,即使在供氧充足的条件下,肿瘤细胞也表现出较高葡萄糖摄取率,并将葡萄糖在线粒体中产生丙酮酸的过程转变为产生乳酸的过程,这种代谢策略被称为“有氧糖酵解”或温伯格效应,是最常见的癌症细胞糖代谢的改变,这一过程可以快速生成ATP并合成大量细胞分裂所需的大分子。因此,糖酵解增加与肿瘤高度增殖性有关,并且与许多癌症预后不良呈正相关[3]。一些LncRNA能够作为糖代谢的重要调控因子,进而影响肿瘤细胞的生物学行为,例如:LncRNA MACC1-AS1通过AMPK/LI28信号通路调节MACC1 mRNA的稳定性,从而促进胃癌细胞糖酵解过程,促进胃癌进展[4]。miRNA在抑制细胞糖酵解的过程中也扮演着不可或缺的角色,例如:miR-181d通过增强c-Myc的稳定性从而介导了Cyr2和FbxL3的转录抑制,并进一步在结肠癌中产生了代谢抑制作用[5]。miR-361-5p通过靶向抑制FGFR1和MMP-1的表达从而抑制乳腺癌细胞的糖酵解、增殖和侵袭[6]。HIF-1α与c-Myc作为两个重要的转录因子,对糖酵解过程也有着重要的调控作用,二者的过表达能够促进多种糖酵解相关酶的上调,如:LDHA、PKM2和PDK1等[7]。这些糖酵解分子机制的研究对于靶向作用糖酵解过程有着重要意义。
靶向作用于糖酵解代谢很可能提供了一种治疗某些癌症的有效手段。例如通过抑制2-脱氧-D-葡萄糖(2-DG)从而抑制糖酵解,促进其向氧化磷酸化的代谢转变,减少乳酸的产生,从而抑制肿瘤的转移[10]。事实上,一些作用于关键糖酵解酶和葡萄糖转运蛋白的抑制剂目前正在临床前研究及临床试验中单独或与其他抗癌药物联合使用,其中包括GLUT1(WZB117)、己糖激酶II(2-DG,氯尼达明)、磷酸果糖激酶(3PO)、3-磷酸甘油醛脱氢酶(3-BP)和乳酸脱氢酶的抑制剂(FX11,草氨酸盐)[8-10]。
1.2 氧化磷酸化
除了温伯格效应,肿瘤细胞也进行其它能支持其生长的代谢途径。氧化磷酸化的重要性在肿瘤代谢中一直被低估,有证据表明在多种肿瘤细胞系中,氧化磷酸化均能更有效率的生成ATP,例如乳腺癌细胞中80%的ATP是依赖氧化磷酸化的代谢产生的,这种依赖葡萄糖、脂肪酸或谷氨酰胺的氧化磷酸化产生ATP的肿瘤被称为“氧化肿瘤”[11]。
1.3 不同类型肿瘤的代谢异质性
癌细胞不同的代谢特征可以用来判断组织来源[7]。事实上,肺、肝、结肠癌和白血病主要依赖糖酵解[11-16];而淋巴瘤、黑色素瘤和胶质母细胞瘤被认为是氧化肿瘤。近来有证据表明,特定类型肿瘤中的不同亚型也可以采用不同的代谢策略。例如,三阴性乳腺癌(TNBC)通常进行有氧糖酵解,而雌激素受体(ER)阳性的乳腺癌则依赖于氧化磷酸化[11,17-21]。研究表明糖酵解速率与TNBCs增殖指数呈正相关[18],而激活氧化磷酸化代谢的TNBCs则可以抑制原发肿瘤生长和转移灶形成[19]。与大多数细胞不同,正常的前列腺上皮细胞高度依赖糖酵解代谢。在病变早期,前列腺癌细胞开始逐步转变为依赖氧化磷酸化的代谢。然而前列腺癌细胞在癌症进程的晚期阶段,由于对2-DG敏感而优先进行糖酵解代谢[11,22-25]。因此,前列腺癌细胞表现出一种混合代谢表型,即在疾病进展的不同阶段分别利用糖酵解和氧化磷酸化供应能量[11]。
1.4 同种肿瘤的代谢异质性
在原发肿瘤中,氧含量、pH值、葡萄糖的浓度以及其他的代谢产物能显著影响代谢的异质性,肿瘤细胞亚群针对不同的环境因素可以采用不同的代谢方式供能。缺氧是影响肿瘤细胞代谢状态的主要因素,缺氧条件下缺氧诱导因子-1α(HIF-1α)蛋白质稳定性高从而促进糖酵解。假定一种“两舱”的代谢模型,其中富氧微环境的癌细胞与相邻缺氧区的癌细胞之间存在一种共生关系。在这个模型中,肿瘤细胞的“糖酵解亚群”暴露于低氧环境时释放乳酸作为副产物,为“富氧”癌细胞亚群氧化磷酸化代谢提供能源[26]。
1.5 癌细胞和基质之间的代谢偶联
代谢共生并不仅限于肿瘤细胞不同的亚群之间,也延伸到肿瘤与基质间。基质成分主要为肿瘤相关成纤维细胞(CAF)、自适应与先天免疫细胞、间充质干细胞、脂肪细胞和细胞外基质的内皮细胞,不同肿瘤中其成分构成略有不同。癌细胞和基质细胞之间的双向作用是通过各种可溶物质和囊泡的分泌实现的,可以促进肿瘤的生长、转移及出现抗治疗反应(例如耐药和抗辐射)[27]。
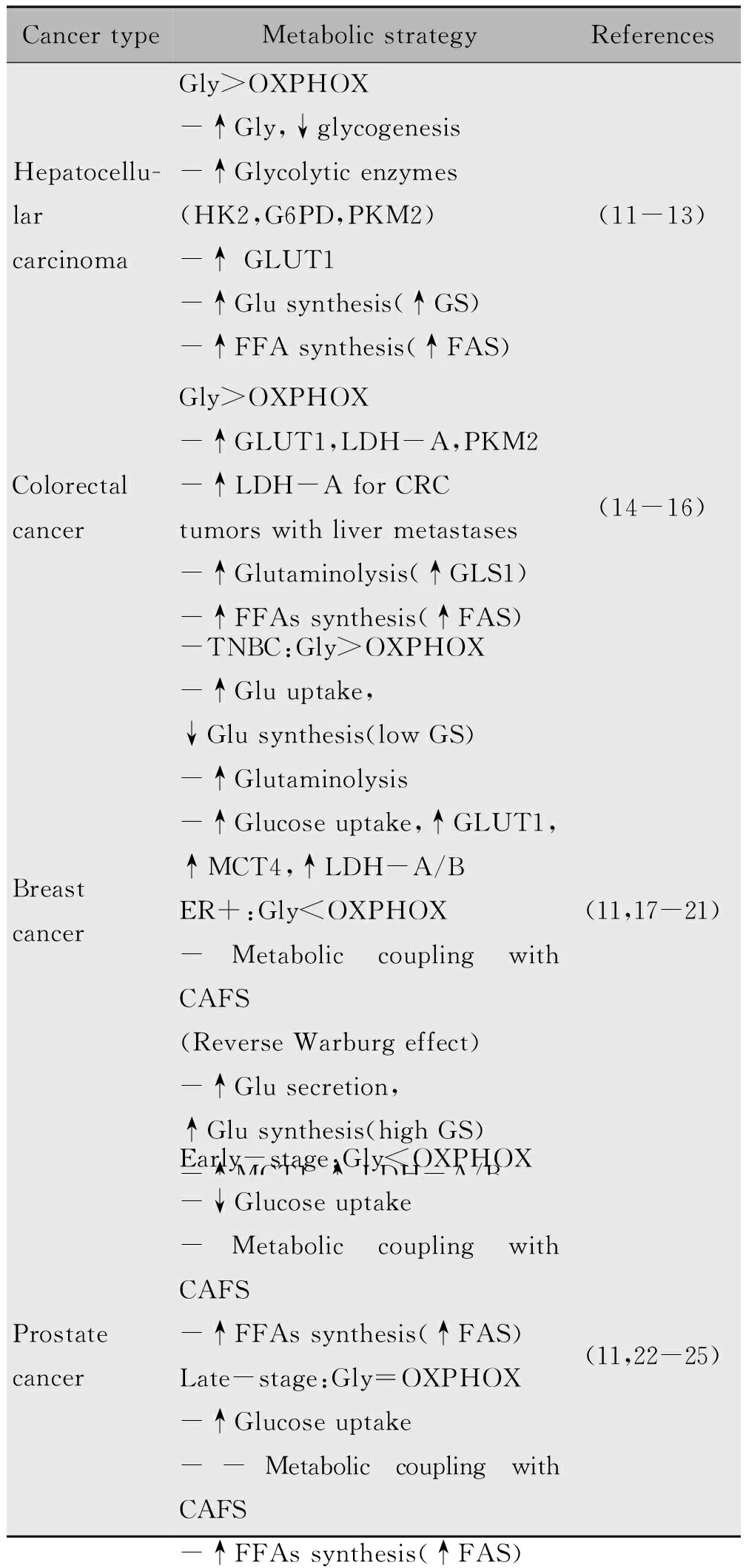
表1 不同肿瘤优先的代谢策略Table 1 Metabolic strategies that are prioritized by different cancers
2 反温伯格效应
2009年,Lisanti和他的同事们提出,肿瘤细胞能促进周边CAFS的温伯格效应,此过程被称为反温伯格效应。CAF分泌能量丰富的代谢产物,如酮体、乳酸和丙酮酸,这些产物又被癌细胞摄取并在线粒体内氧化产生能量。与肿瘤细胞不同,CAFS内糖酵解增加与自身增殖升高并不相关,但却有效的促进肿瘤的生长和转移[28]。由CAFS分泌的乳酸诱导的局部微环境酸化,可以增强细胞外基质的蛋白降解,促进肿瘤细胞获得耐药性。
除了上述的CAFS,其他基质细胞如脂肪细胞,通过分解释放游离脂肪酸,这些游离脂肪酸通过β-氧化被癌细胞摄取用以维持肿瘤的生长。肿瘤相关巨噬细胞(TAM)内的能量代谢改变可导致这些炎性细胞出现明显不同的功能。M1巨噬细胞(抗肿瘤)优先参与糖酵解,然而M2巨噬细胞(促肿瘤)主要参与氧化磷酸化[29]。癌细胞也可通过抑制细胞毒性的肿瘤浸润淋巴细胞(TIL)利用葡萄糖从而钝化抗肿瘤的T细胞反应,通过饥饿TILS创造免疫抑制的环境,从而有利于肿瘤增长[30-31]。因此,癌细胞与基质细胞间的代谢相互作用可以促进肿瘤的生长,并维持其与转移的微环境之间的共生关系。
3 转移过程中的代谢可塑性
3.1 转移过程中代谢的变化
可逆的上皮-间质细胞转化(EMT)是一种提高癌细胞侵袭和转移表型的机制。已经证实,进行EMT的乳腺肿瘤细胞表现出糖酵解的增强,并伴随着合成代谢途径的抑制。相比之下,从血液中分离的处于转移过程中的肿瘤细胞与原发肿瘤或肺转移灶的肿瘤细胞比较时,发现其优先进行依赖氧化磷酸化,强化了癌细胞在转移过程的各个不同阶段的代谢可塑性的概念[32]。
3.2 为特定癌细胞代谢的模式选择不同的转移微环境
获得了转移潜能的乳腺癌细胞亚群表现出不同的代谢特点,成瘤但无转移的乳腺癌细胞与正常乳腺上皮细胞相比,可以观察到其向有氧糖酵解的转变,获得了转移表型的细胞则进一步向同时进行糖酵解和氧化磷酸化的过程发展。增加的氧化磷酸化和线粒体代谢也被证明是转移表型所需的[32]。高转移性的乳腺癌细胞通过组合糖酵解与氧化磷酸化作为其提高转移能力的代谢策略。已经证明,转移的乳腺癌细胞能根据转移部位的不同而选择不同的代谢方式。从骨或肺转移灶中分离的乳腺癌细胞优先进行氧化磷酸化,而肝转移灶的乳腺癌细胞优先糖酵解。
4在特定的转移微环境中肿瘤和基质细胞的代谢方式
最先由Stephen Paget首先提出的“种子和土壤”假说,经过后人的不断探索及发展,可以理解为一旦转移的肿瘤细胞外渗到不同的组织,他们能否成功地定植和生长取决于他们应对及影响新微环境的能力。因此,能否形成转移灶主要取决于肿瘤细胞和其新微环境之间的相容性[33]。
4.1 扩散的癌细胞对特定的转移微环境的代谢适应
以脑转移瘤的研究为例,大脑对于葡萄糖的利用有独特的代谢特点,如星形胶质细胞和神经元之间的代谢偶联,通常被称为“乳酸穿梭”:星形胶质细胞分泌的乳酸由神经元摄取并作为氧化磷酸化的原料[1]。因此,作为乳酸穿梭的后果,葡萄糖的浓度会限制脑转移瘤的生长。然而,脑组织间隙中含有高水平的谷氨酰胺和支链氨基酸,可作为替代能量底物为定植于大脑的转移性乳腺癌细胞提供能量。脑转移瘤也可能通过在三羧酸循环(TCA)中氧化醋酸以适应有限的葡萄糖水平[34]。
最近的研究表明,转移性结直肠癌细胞能影响肝细胞衍生的代谢产物以使癌细胞成功的定植并形成肝转移灶。已证实,转移细胞释放脑型肌酸激酶,使肝脏来源的肌酸生成磷酸肌酸,并随后进入转移性结直肠癌细胞内生成ATP[35]。因此,癌细胞可利用微环境中产生的代谢产物以应对在不同的转移部位遇到的代谢应激。
4.2 癌细胞对不同转移部位的基质细胞的代谢的影响
癌细胞不仅对转移微环境有反应,也能影响基质细胞的代谢。肿瘤来源的外泌体来自内吞途径,代表着癌细胞及其微环境之间的通讯效应。乳腺癌细胞的囊泡可以抑制转移灶中的其他细胞对葡萄糖的摄取,包括肺成纤维细胞和星形胶质细胞,从而允许转移性乳腺癌细胞优先摄取葡萄糖。这些囊泡含有高水平的miR-122,可以通过下调糖酵解酶如丙酮酸激酶来抑制基质细胞摄取葡萄糖[36]。这些发现表明,在肿瘤微环境中影响基质细胞的代谢是癌细胞利于自身生长一个代谢适应过程。
5 小结与展望
大量研究表明了癌细胞采取的代谢策略的多样性,包括在肿瘤内及肿瘤与基质之间的代谢相互作用。除了有氧糖酵解,转移的肿瘤细胞还可以采取互补的代谢策略,如氧化磷酸化,以提高癌细胞的代谢灵活性,使其能够应对迅速变化的代谢需求和/或代谢条件。整个转移扩散的过程中都需要代谢适应,并且这一过程对于转移的成功至关重要,根据转移的部位不同,转移癌细胞有区别的采取不同的代谢策略以确保其存活。我们未来的挑战是去更充分地了解肿瘤细胞是如何通过影响肿瘤微环境以最大限度地利用现有资源(如CAFs、巨噬细胞、脂肪细胞)来维持自己的生存和增殖的。理解转移癌细胞代谢适应的机制,确定癌细胞和周围的基质之间的代谢依赖共生机制可能为转移性疾病的治疗提供新途径。
