PGAM1通过激活Warburg效应调控宫颈癌细胞恶性生物学行为的机制研究
2018-09-05傅柳陶王青元王文艳
傅柳陶,王青元,卫 兵,王文艳
在我国,宫颈癌是致死率较高的妇科恶性肿瘤之一[1]。由于宫颈癌起病隐匿,早期缺乏典型的临床症状,加之恶性化程度高,进展迅速,大部分患者确诊时已至中晚期,从而错过了手术的最佳时机,因此中晚期患者的复发和转移率一直居高不下[2-3]。因此实现对于宫颈癌患者的早诊断、早治疗是降低患者死亡率的关键。肿瘤细胞因线粒体功能缺陷导致糖代谢异常被公认为是肿瘤细胞的重要特征之一[4]。但是有氧糖酵解途径的发生机制和调控方式一直未有明确研究。磷酸甘油酸变位酶1(phosphoglycerate mutase1,PGAM1)作为糖酵解途径中的关键酶,可催化3-磷酸甘油生成2-磷酸甘油,并且有研究[5]证实,PGAM1是唯一受抑癌基因P53调控的糖酵解相关酶。该研究首先通过免疫组化法探讨PGAM1在宫颈癌组织中的表达情况,并通过机制研究进一步分析PGAM1在肿瘤细胞糖酵解及发生发展中的作用,从而为临床治疗和药物研发提供新的靶点。
1 材料与方法
1.1病例资料收集2016年7月~2017年10月在安徽医科大学第二附属医院行手术切除的67例宫颈癌患者的新鲜宫颈癌组织(排除肿瘤坏死区)及配对的癌旁正常组织(距离肿瘤边缘>3 cm),将一部分组织标本立即置于液氮中,然后转移至-80 ℃ 保存以备RNA和蛋白提取用;另一部分组织标本经石蜡包埋,以进行免疫组织化学染色用。患者年龄30~65(47.50±2.46)岁。纳入标准:由两名以上经验丰富的病理科医师对组织切片进行阅片并同时确诊;所有患者术前未接受过放疗、化疗或其他辅助治疗。
1.2受试细胞人宫颈癌细胞株Hela以及HEK293T细胞均购自美国Type Culture Collection公司。
1.3主要试剂胎牛血清(FBS)、RPMI1640培养基、DMEM高糖培养基、胰蛋白酶-EDTA细胞消化液(0.25%)(美国GIBCO公司);MTT(美国Sigma公司);青霉素和链霉素(山东医药股份有限公司);二甲基亚砜(DMSO)(江西省江蓝纯生物试剂有限公司);S-P免疫组化试剂盒、DAB显色试剂盒(北京中杉金桥生物技术有限公司);PGAM1抗体、辣根酶标记的二抗(美国Abcam公司);TRIzol总RNA提取试剂盒、细胞转染试剂 LipofectamineTM2000、Opti-MEM(美国Invitrogen公司);Taqman® RNA reverse transcription kit、Taqman® RNA assay kit(日本Takara公司);cDNA合成试剂盒(美国OMEGA公司);SYBR Green PCR Mix、M-MuLV逆转录酶(美国ABI公司)。PCR引物以及siRNA干扰靶序列由上海生工生物工程有限公司合成并提供。
1.4主要仪器HERcell1501型CO2细胞培养箱和超净工作台(美国Thermo Scientific公司);Eppendorf 5427 R台式高速冷冻离心机以及各种型号的移液器(德国 Eppendorf公司);实时定量PCR仪、iMake多功能酶标仪、SDS-PAGE电泳仪和电转膜仪(美国Bio-Rad公司);CX41倒置光学显微镜(日本OLYMPUS公司);Amersham电泳仪(瑞典Bioscience公司);LAS-4000min凝胶成像数码分析系统(日本FujiFilm公司)。
1.5方法
1.5.1免疫组化 取石蜡包埋组织进行切片(1~2 μm)后行免疫组织化学染色,严格按照SP试剂盒说明书进行操作。随机选择10个视野,观察PGAM1在不同组织中的染色强度以及阳性细胞的百分比。PGAM1呈细胞质棕黄色染色。结果判定标准为观察细胞染色强度:0分(阴性),1分(弱染色),2分(中度染色),3分(强染色),然后计算10个视野的平均染色分值。同时观察视野中染色细胞的百分比:0分(阳性率为0),1分(阳性率≤25%),2分(阳性率25%~50%),3分(阳性率50%~75%),4分(阳性率>75%)。染色指数(labeling index,LI)=阳性细胞率×染色强度,LI≤6分为低表达或不表达,LI>6分为高表达。
1.5.2细胞培养 将细胞培养在含有10%FBS的完全RPMI 1640培养基中,将细胞置于37 ℃、5% CO2细胞培养箱中进行培养。24~48 h更换培养液,48 h传代1次。
1.5.3构建PGAM1基因沉默稳转细胞株 ① 构建慢病毒干扰载体:从GenBank 中获得编码人PGAM1基因(NM-003483)的序列;选择pGMLV-GFP RNAi慢病毒载体,构建慢病毒重组质粒,并转染至感受态细胞DH5α中。采用质粒抽提试剂盒提取慢病毒重组质粒和包装质粒,并转染至293T细胞中,测定慢病毒滴度。② PGAM1基因沉默稳定细胞系的建立:提前1 d在相应备行转染的6孔板上接种5×105个细胞,培养24 h后,待融合率达到 50%~60%时,按照脂质体转染说明书,将PGAM1 shRNA或shRNA-NC治疗转染至细胞,置于37 ℃、5% CO2细胞培养箱中培养24~48 h。提取细胞RNA及蛋白,验证目的基因表达情况及转染效率。
1.5.4MTT法检测细胞增殖 将各组细胞(1×104个/孔)单层接种至96孔板中正常培养,每组设置8个平行孔,分别培养24、48、72、96 h后,加入20 μl MTT,置于37 ℃、5% CO2细胞培养箱中孵育4 h后,弃除上清液,每孔加入200 μl DMSO,使紫色结晶物充分溶解。将96孔板放置于酶标仪卡槽上,检测波长为570 nm,参比波长为450 nm处的吸光度值(OD值),计算平均值。
1.5.5流式细胞术检测细胞凋亡 收集细胞,采用预冷的PBS洗涤3次后,离心,弃上清液;加入500 μl Binding Buffer重悬,细胞数量约为1×104个/100 μl;加入Annexin V 5 μl,避光孵育15 min;离心,弃上清液;加入500 μl Binding Buffer重悬;加入PE 5 μl,避光孵育15 min;离心,弃上清液;加入300 μl结合缓冲液;上机检测。所有操作严格按照试剂盒说明书操作进行。采用流式细胞仪(Ex=488 nm,Em=530 nm)检测细胞凋亡情况。
1.5.6荧光定量实时PCR(quantitative realtime PCR,qRT-PCR) ① 总RNA提取:采用分光光度计检测RNA浓度。② RNA逆转录为cDNA:根据试剂盒说明书操作进行。将cDNA保存至-20 ℃保存备用。③ qRT-PCR:根据NCBI数据库资料设计引物序列,以细胞或组织cDNA为模板,以β-actin作为内参。PCR结果判断:根据使用说明调整基线,将阈值设定在荧光值对数图的线性部分,从软件中读取Ct值。
1.5.7Western blot实验 提取蛋白样品,蛋白样品凝胶电泳,转膜,封闭,加入一抗(按照一抗说明书,将100 μl NGS加入10 ml Western一抗稀释液中混匀)孵育,室温下震荡摇床摇动2 h;加入二抗[参考二抗说明书,将Western二抗稀释液(P0023D) 100 μl加入辣根过氧化物酶(HRP)标记的二抗10 ml中混匀]孵育,室温下震荡摇床摇动2 h,显影,采用FluorChem FC3凝胶成像数码分析系统进行定量分析,以积分光密度(IOD)表示灰度值。
1.5.8细胞葡萄糖消耗和乳酸生成检测 按照韩文祺 等[6]描述的实验步骤进行。每个样品重复测量3次,取平均值。

2 结果
2.1不同组织中PGAM1的表达情况免疫组化结果显示,宫颈癌组织中PGAM1高表达率为58.21%,明显高于癌旁组织(P<0.05)。见表1。
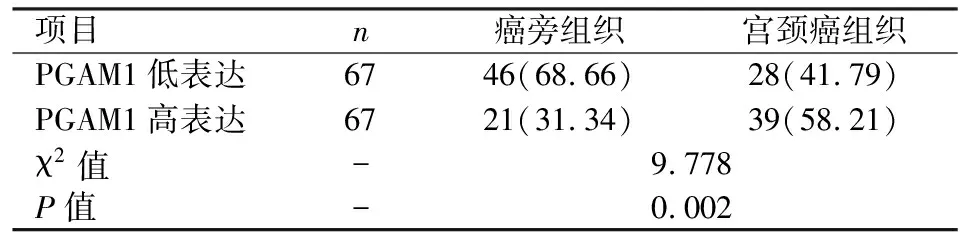
表1 不同组织中PGAM1的表达情况[n(%)]
2.2两组患者一般临床资料比较不同临床分期、分化程度、浸润深度的患者PGAM1的高表达率差异有统计学意义(P<0.05),其他临床资料基本一致,差异无统计学意义(P>0.05)。提示PGAM1高表达可能与宫颈癌发生、侵袭、分化等密切相关。见表2。

表2 宫颈癌患者临床病理资料与PGAM1表达的关系[n(%)]
2.3PGAM1对Hela细胞增殖活性的影响经MTT法检测,Hela细胞shPGAM1基因沉默后,与NC组比较,细胞增殖活性明显受到抑制,经重复测量方差分析,差异有统计学意义(F=98.766,P<0.05)。见图1。
2.4PGAM1对Hela细胞凋亡活性的影响细胞培养48 h后,经流式细胞术检测,Hela细胞shPGAM1基因沉默后,与NC组比较,细胞凋亡率明显增加,差异有统计学意义(t=9.706,P<0.05)。见图2。
2.5PGAM1对Hela细胞葡萄糖消耗和乳酸产量的影响细胞培养48 h后,取上清液,检测细胞上清液中葡萄糖含量和乳酸含量,结果显示,Hela细胞shPGAM1基因沉默后,与NC组比较,葡萄糖消耗和乳酸产量均明显降低,差异有统计学意义(t=16.060、15.926,P<0.05)。见图3。
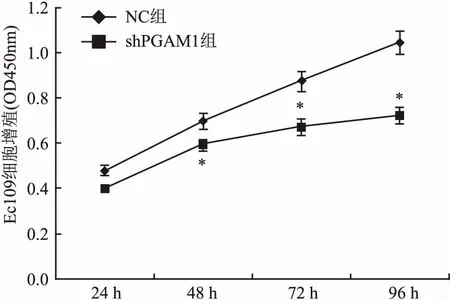
图1 MTT法检测PGAM1对Hela细胞增殖的影响与NC组比较:*P<0.05
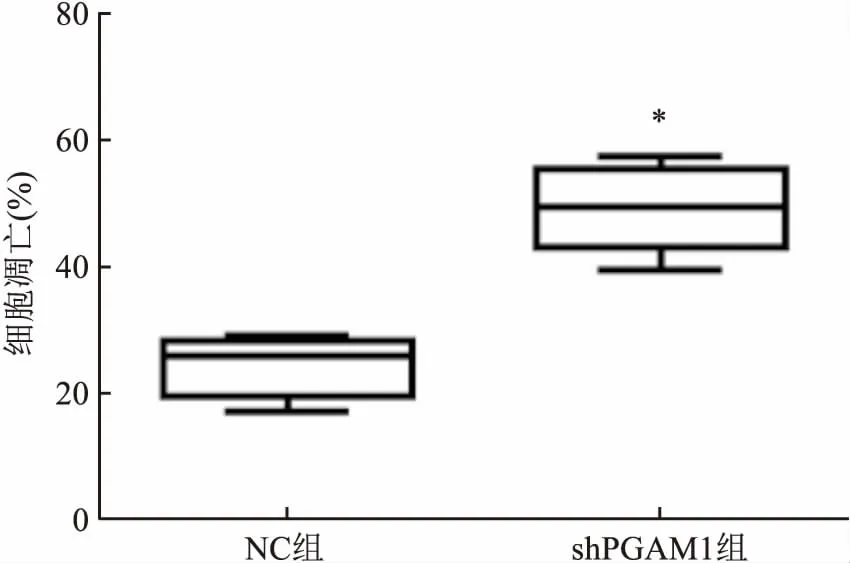
图2 流式细胞术检测PGAM1对Hela细胞凋亡的影响与NC组比较:*P<0.05
2.6PGAM1基因沉默对Hela细胞糖代谢相关基因和蛋白表达的影响磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)、磷酸化丝氨酸-苏氨酸蛋白激酶(phosphorylation auto-ja kuljetusalan,p-Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)都属于Akt/mTOR信号通路中的关键分子。通过qRT-PCR法和Western blot法证实,Hela细胞shPGAM1基因沉默后,与NC组比较,PTEN mRNA和蛋白相对表达量明显上调,而p-Akt、p-mTOR mRNA和蛋白相对表达量明显降低,差异有统计学意义(P<0.05)。见图4。
3 讨论
在前期研究中,通过高通量基因芯片技术筛选了与正常宫颈黏膜组织存在表达差异的宫颈癌组织基因谱,其中PGAM1基因的表达量明显上调,与以往关于乳腺癌、肾癌、肺癌等组织的研究[7-9]结果基本一致。说明PGAM1可能参与了肿瘤细胞的恶性生物学行为调控。

图3 PGAM1对Hela细胞葡萄糖消耗和乳酸产量的影响与NC组比较:*P<0.05
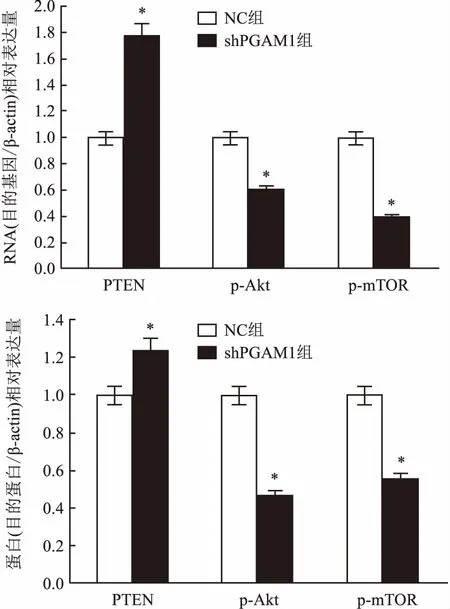
图4 qRT-PCR法和Western blot法检测PGAM1对Hela细胞PTEN、p-Akt、p-mTOR基因和蛋白表达的影响与NC组比较:*P<0.05
PGAM1是最初在脑组织中发现的PGAM家族成员之一,定位于人染色体10q25.3区域,包括PGAM1和PGAM2两个同源二聚体,既往有研究已经证实PGAM1是参与细胞有氧糖酵解途径的重要酶之一,可以将3-磷酸甘油酸3位上的磷酸基移位生成2-磷酸甘油酸,从而生成磷酸烯醇式丙酮酸[10]。糖酵解方式是肿瘤细胞在有氧条件下获取能量的主要途径,因此肿瘤细胞葡萄糖消耗量、糖酵解速率以及乳酸生成量均较正常细胞明显增加,这一现象被称为“Warburg效应”。但是在后来很长一段时间,大多数学者认为Warburg效应与肿瘤细胞的恶性生物学行为关系不明显[11]。近几年,随着对肿瘤发生机制的深入发展,Warburg效应重新进入人们的视线,逐渐成为肿瘤领域的研究热点,干扰高糖代谢可能成为抗肿瘤治疗的新策略。本研究首先通过免疫组化法探讨宫颈癌组织和癌旁组织中PGAM1表达的差异以及与患者临床病理特征的关系,结果显示,在癌组织中,PGAM1高表达率明显高于癌旁正常黏膜者,并且与患者的临床分期、分化程度、浸润深度相关,提示PGAM1可能参与肿瘤细胞的增殖、侵袭、分化、凋亡等恶性生物学过程。因此PGAM1有可能作为宫颈癌潜在的治疗靶标。
目前研究证实,肿瘤细胞的糖代谢需求显著高于正常细胞。这一特点使得肿瘤细胞葡萄糖消耗量和乳酸生成量大大增加,以满足细胞的增殖需求[12]。因此本文探讨PGAM1与宫颈癌发生发展的关系,首先从影响肿瘤细胞的增殖和凋亡着手,进一步分析PGAM1基因的生物学功能。结果显示,PGAM1基因敲除后,Hela细胞凋亡率均明显增加,增殖活性受到明显抑制,从而证实PGAM1参与调控肿瘤细胞的增殖和凋亡过程。另外,前期研究通过高通量基因芯片技术分析表明Akt/mTOR信号通路可能是PGAM1下游靶通路。而Akt/mTOR信号通路已经被公认为是控制肿瘤细胞恶性生物学行为、能量代谢等过程的重要途径,与Warburg效应密切相关。本研究通过qRT-PCR法和Western blot法初步证实了PGAM1对Akt/mTOR信号通路的调控影响,结果显示,Hela细胞shPGAM1基因沉默后,PTEN表达量明显上调,而p-Akt、p-mTOR mRNA和蛋白相对表达量明显降低。Akt是一种高度保守的丝氨酸/苏氨酸蛋白激酶,通过磷酸化被激活后移位至胞质或胞核中,参与调控下游靶蛋白mTOR的表达。而PTEN是Akt/mTOR信号通路的负性调控蛋白,具有抑癌基因活性,可抑制肿瘤细胞增殖,并促使其凋亡。
