过表达IDO骨髓间充质干细胞分泌外泌体改善移植心脏存活
2018-09-05贺继刚韩金秀撒亚莲李贝贝
贺继刚,韩金秀,撒亚莲,严 丹,李贝贝
随着医学科技进步,抗免疫排异药物不断更新,免疫基础、临床研究的进展,器官移植已成为终末器官衰竭治疗的手段之一。目前抑制免疫排异反应主要有两种方法:① 药物抑制,包括吗替麦考等;② 生物抑制法。目前认为骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)可以抑制器官排异反应[1]。但因为BMSCs的安全性一直以来未得到有效证实,其临床应用受到限制。吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase,IDO) 可在胎盘和淋巴组织中广泛表达,是除肝脏外唯一能催化色氨酸循犬尿酸分解途径代谢的催化限速酶,在哺乳动物组织与细胞,尤其是胎盘和淋巴组织中广泛表达。它能够催化降解色氨酸有效促进移植物存活[2]。课题组前期已经证实过表达IDO-BMSCs可以有效抑制免疫排异反应[3]。外泌体(exosome)是直径介于50~100 nm的囊泡,其是以出芽方式从细胞上产生的鳞片状囊泡,它拥有多项生物功能,能使细胞在不必直接作用下实现细胞与细胞远距离生物信息传导,目前其已成为研究热点[4]。该研究通过提取过表达IDO-BMSCs分泌的exosome试图证明外泌体在抑制免疫排异反应中的作用。
1 材料与方法
1.1实验动物健康4周龄SPF级Wistar及SD成年雄性大鼠各70只,购自成都达硕科技实验动物。
1.2主要试剂和仪器大鼠液相芯片试剂盒TGFBMAG-64K-03及RECYTMAG-65K-07(美国密理博公司);流式细胞仪BD Accuri C6 (美国BD公司);小动物活体成像仪(美国冷泉港公司);心脏彩超EPIQ 7C(荷兰飞利浦公司);抗OX62大鼠色疫磁珠(德国美天旎公司)。其它试剂见文献[3]。
1.3方法
1.3.1大鼠BMSCs培养及鉴定 全骨髓培养,胰酶消化传代至第7代。取生长至P7代BMSCs,并检测细胞黏附分子29(CD29)、细胞归巢因子-44(CD44)、CD90、CD73、CD45、CD11b、造血干祖细胞表面抗原(CD34)。
1.3.2过表达IDO-BMSCs构建 利用慢病毒GV308构建IDO载体并使用强力霉素作为基因开启剂实现大鼠BMSCs过表达IDO,分两组:阴性对照组(NC组),过表达IDO组(OE组),每组包含3组细胞。而后根据文献[4]采用定量PCR方法检测转染2 d后IDO基因表达量。
1.3.3建立腹腔异位心脏移植模型 根据文献[5]建立腹腔异位心脏移植模型。并采用心脏彩超EPIQ 7C评估建模3 d后移植心脏射血分数(ejection fraction,EF)、短轴缩短率(fractional shortening,FS)改变。
1.3.4Exosome提取及检测 按照SBI公司ExoQuick-TC说明书提取exosome并利用电镜检测分泌出的exosome形态[6]。
1.3.5心脏彩超评估移植心脏心功能和小动物活体成像评估心脏荧光强度 提取各组细胞分泌的exosome。经Dir预染后。经尾静脉注射到腹腔异位移植心脏术后3 d的大鼠模型中。共分为过表达IDO-BMSCs-exosome组、空载体-BMSCs-exosome组、BMSCs-exosome组,每组3只大鼠,每只大鼠经由尾静脉注射400 μl(800 mg/ml)的exosome,将吗替麦考组(给予吗替麦考喂养2 d)及未处理组做为对照组,每组3只大鼠。并采用二维心脏超声评估移植心脏心功能和采用小动物活体成像评估移植心脏荧光强度。
1.3.6受体大鼠脾脏细胞表面抗原分子表达检测 取受体大鼠完整脾脏组织,制备脾脏单细胞悬液。按Miltenyi公司的Anti-DC(OX62) Microbeads rat试剂盒说明书操作阳选OX62+细胞,并检测细胞表面抗原CD40、CD86、CD80、MHCII、CD274、CD45RA、CD45RA+CD45RB、OX62的表达。同时对阴选OX62-细胞检测CD3、CD4、CD8表达及Treg细胞数量。
1.3.7移植心脏石蜡包埋切片与苏木精-伊红(HE)染色 取移植心脏组织进行脱水,浸蜡,包埋,连续切片,伊红染色,光学显微镜下观察心脏显色结果。

2 结果
2.1大鼠BMSCs鉴定结果超过90%大鼠BMSCs可以表达CD29、CD44、CD90、CD73。但不表达CD45、CD11b、CD34。
2.2RT-PCR检测IDO基因的表达结果定量PCR结果显示,大鼠BMSCs中,OE组IDO基因表达丰度为NC组的62 906.27倍(P<0.05),见图1。
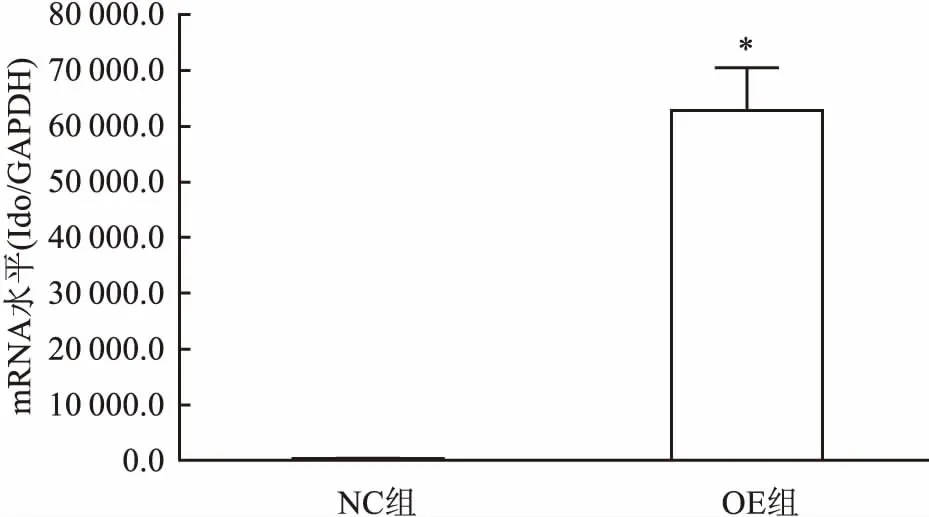
图1 慢病毒转染大鼠BMSCs中并加入基因开启剂DOX 2 d后IDO基因的表达与NC组比较:*P<0.05
2.3心脏彩超评价移植心脏可见腹腔异位心脏移植模型建立3 d,移植心脏仍然跳动,局部形成血栓,见图2。

图2 腹腔异位移植心脏3 d后复查心脏彩超结果黄色箭头指向的是形成的血栓;红色箭头指向的是移植心脏
2.4扫描电镜检测exosome结果可见BMSCs分泌出的exosome表现为白色,大小为介于50~100 nm的颗粒。见图3。

图3 ExoQuick-TC法提取exosome电镜图片 ×4 500
2.5心脏彩超评估注射exosome后移植心脏心功能异位腹腔移植心脏模型建立3 d后,通过受体大鼠尾静脉注射各种BMSCs分泌的exosome,采用心脏彩超评估移植心脏心功能改变,可见给予过表达IDO-BMSCs分泌的exosome处理后2 d,移植心脏的EF、FS均有显著提高,与其余各组差异有统计学意义(P<0.05)。见表1。
2.6采用小动物活体成像评估注射exosome后移植心脏荧光强度大鼠心脏移植模型建立3 d后给予受体大鼠注射过表达IDO-BMSCs-exosome、空载体-BMSCs-exosome、BMSCs-exosome后2 d完成小动物活体成像,将吗替麦考组及未处理组做为对照组。可见过表达IDO-BMSCs-exosome组移植心脏局部荧光强度与其他各组比较差异有统计学意义(P<0.05),其荧光强度最强。见图4。
2.7流式细胞技术评估注射exosome后受体大鼠脾脏细胞表面抗原分子过表达IDO-BMSCs-exosome组CD40、CD86、CD80、MHCII、CD45RA、CD45RA+CD45RB表达量最低,与其他各组比较差异有统计学意义(P<0.05)。过表达IDO-BMSCs-exosome组CD274表达量最高,与其他组比较,差异有统计学意义(P<0.05)。过表达IDO-BMSCs-exosome组Treg细胞量最高,与其他组比较,差异有统计学意义(P<0.05)。见图5。
将上述CD40、CD86、CD80、MHCII、CD274、CD45RA、CD45RA+CD45RB、Treg表达行单因素方差分析:CD40、CD86、CD80、MHCII、CD274、CD45RA、CD45RA+CD45RB的表达及Treg细胞数量差异有统计学意义(P<0.05),见表2。

图4 给予干预措施2 d后评价移植心脏局部荧光强度评价1.过表达IDO-BMSCs-exosome组;2.空载体-BMSCs-exosome组;3.BMSCs-exosome组;4.吗替麦考组;5.未处理组;与空载体-BMSCs-exosome组比较:***P<0.001;与BMSCs-exosome组比较:###P<0.001;与吗替麦考组比较:▽▽▽P<0.001;与未处理组比较:△△△P<0.001

表1 给予exosome处理2 d后移植心脏功能评价
与空载体组比较:*P<0.05;与BMSCs组比较:#P<0.05;与吗替麦考组比较:▽P<0.05;与建模未处理组比较:△P<0.05
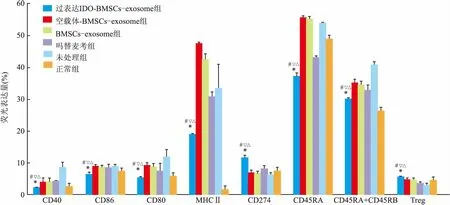
图5 给予干预措施2 d后流式检测脾脏细胞抗原分子表达与空载体-BMSCs-exosome组比较:*P<0.05;与BMSCs-exosome组比较:#P<0.05;与吗替麦考组比较:▽P<0.05;与未处理组比较:△P<0.05;与正常组比较:▼P<0.05

图6 HE染色评估移植心脏炎性细胞侵袭结果 ×400A:过表达IDO-BMSCs-exosome组;B:空载体-BMSCs-exosome组;C:BMSCs-exosome组;D:吗替麦考组;E:未处理组;F:正常组
2.8移植心脏苏木素-伊红染色结果未处理组中炎性细胞浸润心肌数量高于其余各组,而过表达IDO-BMSCs-exosome处理组炎性细胞数量少于其它各组。见图6。
3 讨论
间充质干细胞(MSCs)可以调节免疫排异反应,目前研究发现其通过以下途径完成:① MSCs不表达主要组织相容性抗原-Ⅱ及细胞表面免疫协同分子,但可持续不断表达低水平MHC-Ⅰ分子。② MSCs可抑制B、T淋巴细胞的增生和激活。也能通过细胞因子(如:IL-6、M-CSF)影响树突状细胞的功能及成熟。③ MSCs也能分泌抗炎因子和改变损伤组织处免疫细胞表面抗原分子表达,从而保护炎症处组织免除排异反应损伤[7]。
IDO可通过三条主要途径实现免疫调节:① IDO能分解色氨酸并产生毒性代谢产物犬尿氨酸,而淋巴细胞通过摄取犬尿氨酸使细胞进入G1期促进细胞凋亡;② IDO通过消耗色氨酸激活免疫细胞中抑制免疫敏感转录信号途径[8];③ IDO也可通过在DCs上直接表达出IDO做为细胞与细胞间信号分子[9]。IDO的功能可不依赖IDO酶活性。通过IDO与Src原癌基因抗体同族第二域(SHP-1/SHP-2)与磷酸酯酶(phosphatase)互相接触,激活IDO中免疫调节区域而发挥抗免疫排异作用。IDO-SHP复合体是转录生长因子-β(TGF-β)发挥对血浆树突状细胞调节免疫排异的关键因素[10]。
前期研究[4]证实过表达IDO-BMSCs可以有效抑制免疫排异反应。但经过基因改造的BMSCs应用于临床仍然遥遥无期。因而我们将目光聚焦于外泌体。exosome是一种大小介于50~100 nm囊泡,其内含有多种蛋白质及RNA。早期认为其是一种细胞代谢产物,细胞可以以外泌体的形式扔掉自身不需要的蛋白和RNA,exosome可以通过在细胞与细胞不直接接触下远距离进行细胞间生物信号传导包括免疫信号传导[11]。研究[12]显示当细胞暴露于一种应激条件下能够改变与免疫有关的miRNA,同时也证实,exosome中有HSP72和miRNA的表达。Wang et al[13]报道外泌体中富含的miRNA能够与mRNA 5’端连接,从而抑制目标基因表达。因此,一条miRNA可以与多条mRNA相互作用从而抑制免疫蛋白表达。本研究也证实免疫细胞表面抗原分子表达发生改变。
研究采用二维心脏超声检测,可见过表达IDO-BMSCs-exosome组移植心脏EF、FS较其他各组有显著提高;小动物活体成像技术检测移植心脏局部荧光强度,可见过表达IDO-BMSCs-exosome组中移植心脏具有更强荧光强度;流式细胞检测免疫细胞表面抗原分子改变,可见过表达IDO-BMSCs-exosome组受体大鼠脾脏淋巴细胞中CD40、CD86、CD80、主要组织相容性抗原II、CD45RA、CD45RA+CD45RB表达降低,而CD274(PDL-1)表达增高。Treg细胞的数量增多。HE染色检测移植心脏局部淋巴细胞浸润减少。
