补气升提法对糖尿病复杂性肛瘘患者术后创面局部微环境影响的研究
2018-09-03杨英楠王振宜
杨英楠,干 丹,王振宜
(上海中医药大学附属岳阳中西医结合医院,上海 200437)
肛瘘是肛肠科的常见病、多发病,其发病率高达8.6/100 000~10/100 000[1]。根据内口和外口的数量,可将其分为单纯性肛瘘和复杂性肛瘘。复杂性肛瘘是指肛管直肠瘘,主要为肛管和直肠受到炎症侵犯,导致周围组织破溃形成瘘,内口或外口数量2个以上(含2个),手术是其主要治疗手段。糖尿病是临床常见的代谢紊乱性疾病,具有发病率高、难愈、终生性等特点[2]。而肛瘘并发糖尿病则增加了创面感染的风险,并有可能延缓创面愈合。2015年8月—2016年4月,笔者通过高通量测序技术评估了补气升提法对糖尿病复杂性肛瘘患者术后创面局部微环境的影响,现将结果报道如下。
1 临床资料
1.1一般资料 选择上述时期在本院治疗的复杂性肛瘘患者24例,均符合《中医病证诊断疗效标准》[3]中复杂性肛瘘诊断标准,均为男性,年龄18~65岁,血常规、凝血功能、肝肾功能检查均正常,自愿参与葡萄糖(空腹)检测,自愿加入本试验并签署知情同意书。排除妊娠期妇女,对观察药物过敏者,合并血液、心脑血管、肝脏、肾脏等严重原发性疾病和炎性肠病、结核性肛瘘、恶性肿瘤、精神异常者,最近3个月内参与过其他临床实验者。血糖检测并参照文献[4]标准证实存在糖尿病者16例,将此16例患者随机分为2组:治疗组8例,年龄(46.87±13.87)岁;阳性对照组8例,年龄(49.63±16.32)岁。不伴糖尿病的8例作为阴性对照组,年龄(37.85±11.27)岁。3组患者年龄比较差异无统计学意义(P>0.05)。
1.2治疗方法 3组患者均由肛肠科手术经验丰富的高年资医师行复杂性肛瘘切除术,伴糖尿病者在术前邀请内科医生会诊, 并予以口服降糖药物或者胰岛素注射控制血糖水平,控制空腹血糖(FPG)4.4~6.1 mmol/L ,餐后2 h血糖(2hPG)4.4~8.0 mmol/L,糖化血红蛋白(HbAlc)<6.5%。3组患者术后均给予左氧氟沙星注射液0.4 g加入生理盐水250 mL中静脉滴注,每日1次,连续2 d。每日8:00和15:00各换药1次:常规清洁创面,外用马应龙麝香痔疮膏,用消毒纱布及无菌棉块包扎固定。换药后予局部红外线照射2~3 min。治疗组在上述治疗基础上给予芪参固托汤口服,组方:太子参30 g、黄芪30 g、党参30 g、山药30 g、白芍30 g、白术30 g、升麻30 g、柴胡20 g、当归20 g、陈皮15 g、炙甘草15 g,由本院制剂室制备,具体方法:将上述中药进行冲洗过滤后,放入全自动中药煎药机(型号JYJ-25),280 g 中药加水820 mL(煎药机加水量=吸收常量1.5 mL/g×饮片质量+预计取得药液量+耗损量200 mL),温度105 ℃,压力0.15 MPa,煎煮30 min,共煎煮2次,过滤浓缩后每10 mL加入70%乙醇静置24 h,重复上述步骤,回收乙醇,适量蒸馏水稀释,最后每剂中药留取约200 mL药液,真空包装,统一由中药房配送至病房护理部。护理部经隔水密封加热至35~40 ℃,护理部统一于每日早、晚饭后30 min发放至患者处并观察其服用完毕。
1.3观察项目及检测方法 在术后第1天及第14天8:00未行创面清洁、消毒、换药、红外线照射等基础治疗前,用标准规格无菌长棉签蘸取术后创面局部分泌物,采用高通量测序方法分析创面分泌物菌群的组成情况。
1.3.1DNA提取 将所取术后创面局部分泌物立即放入-80 ℃冰箱速冻,送至实验室提取DNA,余备管样本存于-80 ℃冰箱保存。粪便DNA按照QIAamp Fast DNA Stool Mini Kit 标准流程进行抽提。
1.3.216S rRNA-V1-V3区的PCR扩增及测序采用二次PCR建库测序流程:①DNA质检及Qubit定量;②第一轮PCR;③PCR产物纯化;④Qubit定量及混库;⑤第二轮PCR;⑥Beads二次纯化;⑦Qubit定量及Q-PCR质检;⑧Miseq测序;⑨数据分析。
1.3.3生物信息学分析 ①数据转化;②Illumina Miseq测序得到的原始图像数据经过Base Calling转化为序列数据,结果以FASTQ文件格式来存储;③原始数据质量分析;④通过生物信息统计学的方法,对所有测序reads的每个circle进行碱基分布和质量波动的统计,直观反映出测序样本的测序质量和文库构建质量;⑤原始数据质量控制;⑥使用cutadapt v1.3检测接头和修剪末端,使用QIIME v1.8.0筛选序列和嵌合体,嵌合体去除使用QIIME v1.8.0的Usearch算法,参数默认;⑦使用QIIME分析流程进行分析;⑧OTU聚类:使用pick_open_reference方式进行OTU聚类,聚类算法使用Uclust,数据库使用Greengenes 2013-08 release (http://greengenes.lbl.gov/Download/)版本,相似度阈值为97%,对所有序列进行OTU划分并进行生物信息统计分析,其余参数为QIIME默认参数;⑨alpha_diversity分析:使用软件QIIME v1.8.0 alpha_diversity分析模块评价各个样本或者分组的5个alpha多样性指数(shannon,chao1,observed_species,goods_coverage,simpson);⑩稀释性曲线:使用QIIME v1.8.0 alpha_rarefaction.py做5个alpha多样性指数的稀释性曲线;Beta多样性分析:分别计算 Unweighted/Weighted Unifrac来表征Beta diversity;upgma_tree 目录:使用UPGMA bootstrap tree 分析。
1.4统计学方法 统计软件采用SPSS 22.0.0.0(64位版本)。对样本数量及数据分布进行初步判断后,采用非参数检验中的秩和检验。生物学信息统计采用 QIIME v1.8.0软件,选用rdp_classifier v2.2算法。
2 结 果
2.1实验完成情况 治疗组退出1例,阳性对照组脱落1例,阴性对照组剔除1例,共21例患者完成实验。
2.2样本测序纯化处理前后的序列 术后第1天及第14天共获得未加工序列590287,经纯化处理后得到纯净序列478587,质控后优化序列为81.08%,样本质量良好,可顺利进行后续测序,结果可信。见表1。
2.3各样本物种丰度及多样性分析 术后第14天,治疗组和阴性对照组各指数均有一定程度上升,但与术后第1天比较变化较小;阳性对照组各指数变化明显,除goods_coverage外,其他指数均显著上升,见表2和表3。组间分析显示,阳性对照组物种数目最少,治疗组其次,阴性对照组较高,术后第14天阳性对照组最高,阳性对照组治疗前后差异最大,增长达到10倍,见图1及图2;治疗组和阴性对照组菌群较为稳定,阳性对照组菌群波动巨大,这种菌群波动的差异可能与糖尿病具有相关性,同时对疾病的恢复有一定的影响。
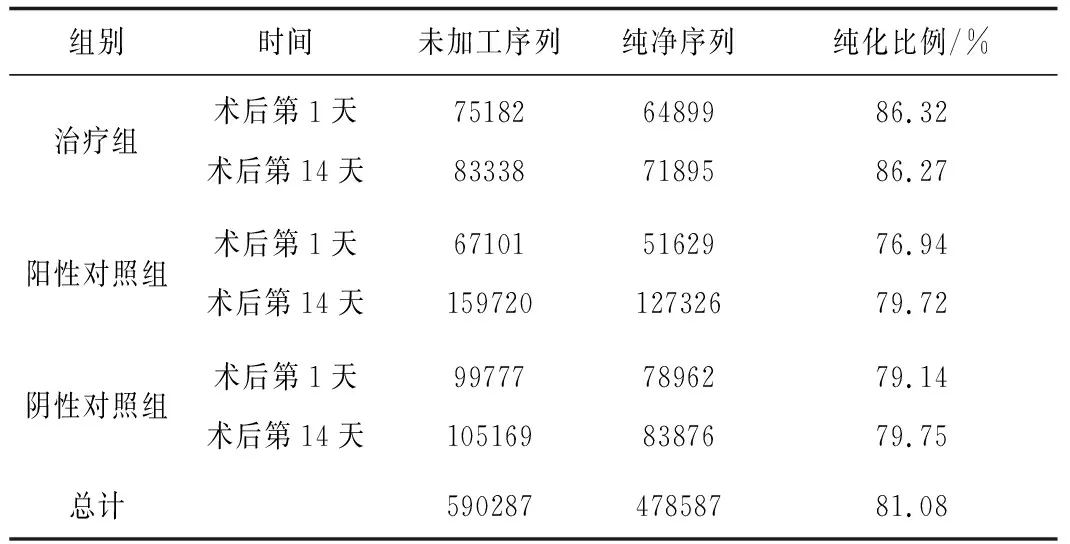
表1 各组样本测序纯化处理前后的序列
图1 样本observed_species
图2 组间observed_species
2.4门水平菌群结构 在门水平上,完成研究的21例患者98%的菌群属于以下5个门:70%以上属于厚壁菌门(Firmicutes)、12%属于变形菌门(Proteobacteria)、5%属于放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)、约3%属于蓝藻门(Cyanobacteria),其余则属于无法确定的分类(如0D1、TM7等),见图3。3组术后第1天及第14天组内的菌群分布基本符合上述规律,厚壁菌门最丰富,变形菌门次之,放线菌门与拟杆菌门相当,蓝藻门所占比重最少,但是阳性对照组术后第1天组内菌群分布明显不同,除了厚壁菌门最丰富之外,蓝藻门所占比重其次,其余3个菌门所占比重相当;术后第14天,治疗组和阴性对照组厚壁菌门、拟杆菌门比重显著增加,变形菌门比重显著下降,放线菌门、蓝藻门变化相对较小,阳性对照组则厚壁菌门增加更为明显,变形菌门比重与其他2组相反呈增加趋势,其他3个菌门不同程度下降,见表4。
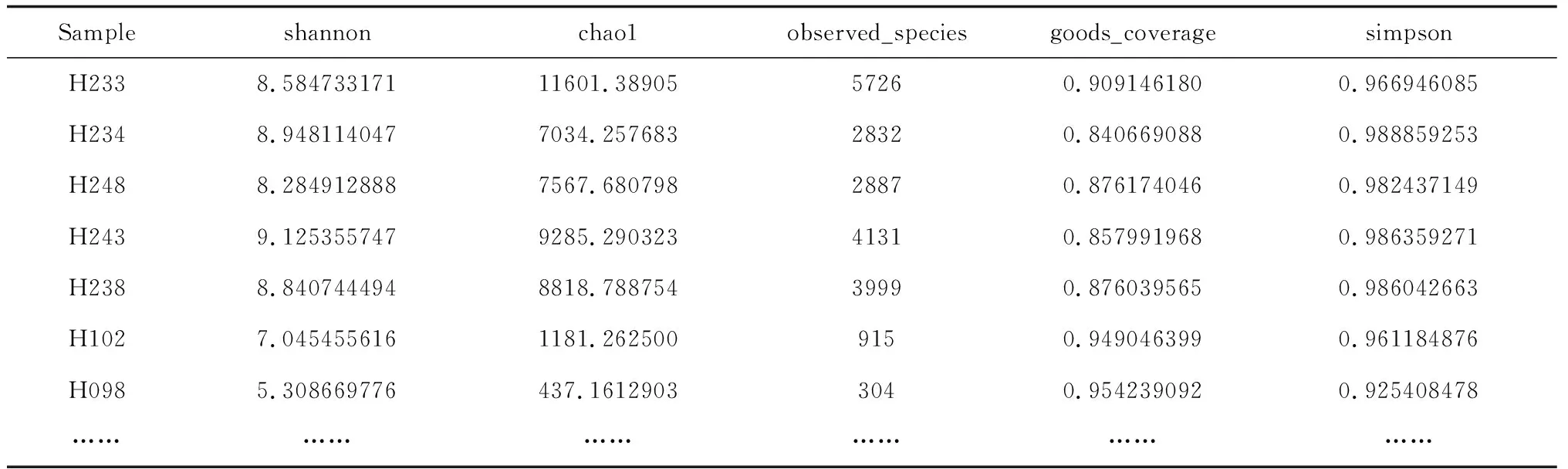
表2 各样本5个alpha多样性指数
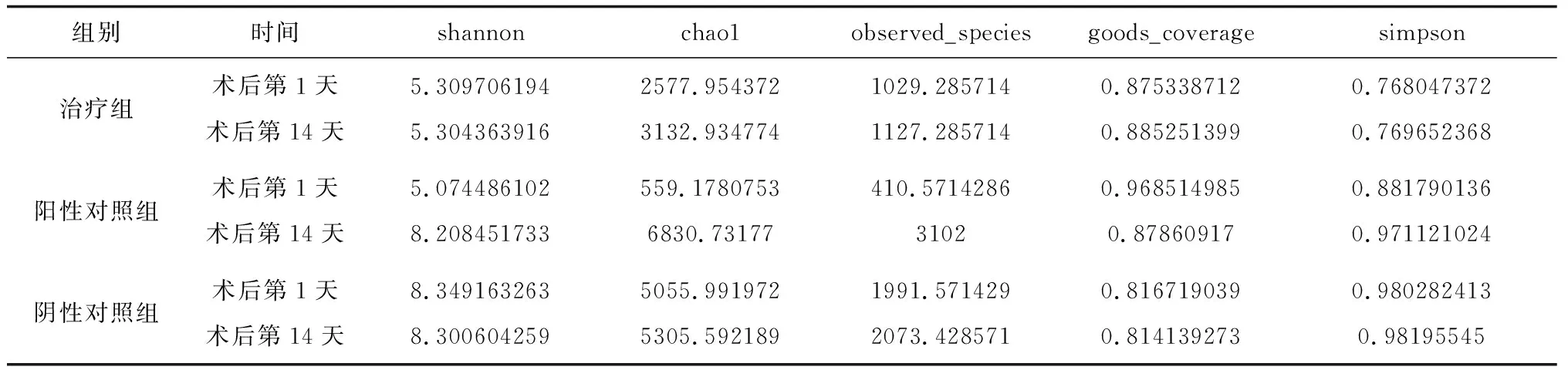
表3 各组5个alpha多样性指数
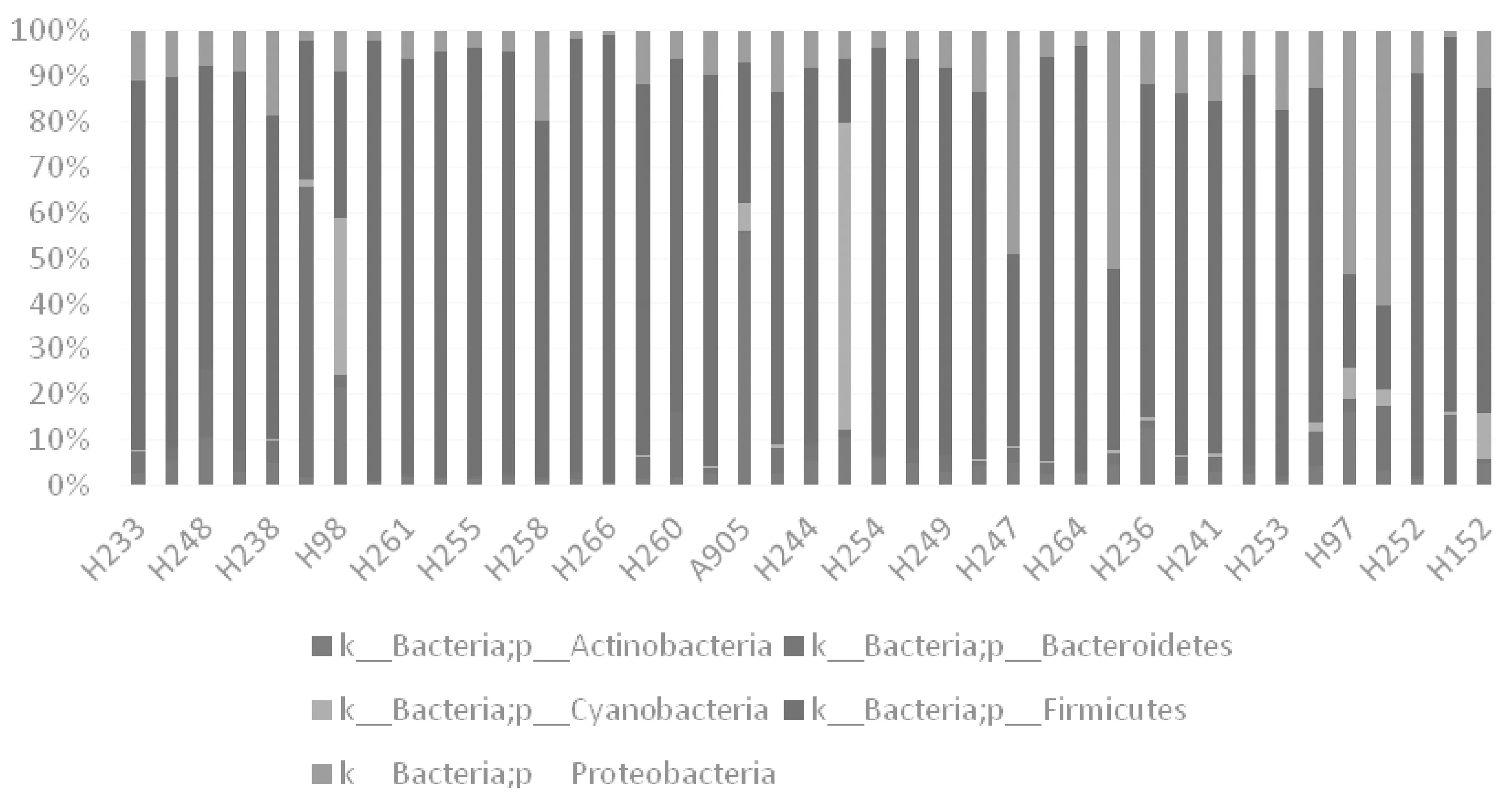
图3 门水平各样品间菌群分布情况
2.5纲水平菌群结构 除不明确的菌群外,主要是以下10个菌纲占优势:厚壁菌门的Bacilli、Clostridia、Erysipelotrichi,变形菌门的Gammaproteobacteria、Betaproteobacteria、Alphaproteobacteria,放线菌门的Actinobacteria、Coriobacteriia,拟杆菌门的Bacteroidia以及蓝藻门的Chloroplast。其中最为优势的是Bacilli及Clostridia菌纲,但在各样品间的具体分布差异也相对较大,以Bacilli菌纲为例其在对应样品中所占比例为0.41%~90.94%,差异巨大,见图4。3组中,治疗组最优势菌纲为Bacilli,其次为Clostridia;阳性对照组治疗前后差异较大,术后第1天Bacilli比例最高、其次是Chloroplast,术后第14天Clostridia比例最高、其次是Bacilli;阴性对照组最优势的是Clostridia,其次是Bacilli;术后第14天,3组Bacilli、Clostridia均有不同程度提高,但阳性对照组Clostridia成倍提高,明显与其他2组不同;治疗组和阴性对照组Bacteroidia均有提高,而阳性对照组呈下降趋势;治疗组和阴性对照组Gammaproteobacteria均有下降,而阳性对照组则显著上升;3组Chloroplast均下降,但阳性对照组下降幅度尤为显著,见表5。
2.6目水平菌群结构 除不明确的菌群外,主要是以下12个目的菌群占总菌群98%以上:Lactobacillales、Clostridiales、Bacteroidales、Enterobacteriales、Streptophyta、Actinomycetales、Bifidobacteriales、Burkholderiales、Coriobacteriales、Erysipelotrichales、Rhizobiales、Bacillales。其中最为优势的是Lactobacillales、Clostridiales菌目。但在各样品间的具体分布差异也相对较大,以Lactobacillales为例其在对应样品中所占比例为0.37%~90.7%,差异巨大。3组中,治疗组最优势菌目为Bacilli中的Lactobacillales,其次为Clostridia中的Clostridiales;阳性对照组治疗前后差异较大,术后第1天Bacilli中的Lactobacillales比例最高、其次是Chloroplast中的Streptophyta,术后第14天Clostridia中的Clostridiales比例最高、其次是Bacilli中的Lactobacillales;阴性对照组最优势的是Clostridia中的Clostridiales,其次是Bacilli中的Lactobacillales。术后第14天,3组Bacilli中的Lactobacillales、Clostridia中的Clostridiales均有不同程度提高,但阳性对照组Clostridia中的Streptophyta及Gammaproteobacteria中的Enterobacteriales成倍提高,明显与其他2组不同;治疗组和阴性对照组Bacteroidia中的Lactobacillales均有提高,而阳性对照组呈下降趋势;治疗组和阴性对照组Gammaproteobacteria中的Enterobacteriales均有下降,而阳性对照组则显著上升;3组Chloroplast中的Streptophyta均下降,但阳性对照组下降幅度尤为显著;治疗组和阴性对照组Actinobacteria中的Bifidobacteriales变化不大,而阳性对照组则显著下降,见表6。

图4 纲水平各样品间菌纲分布情况
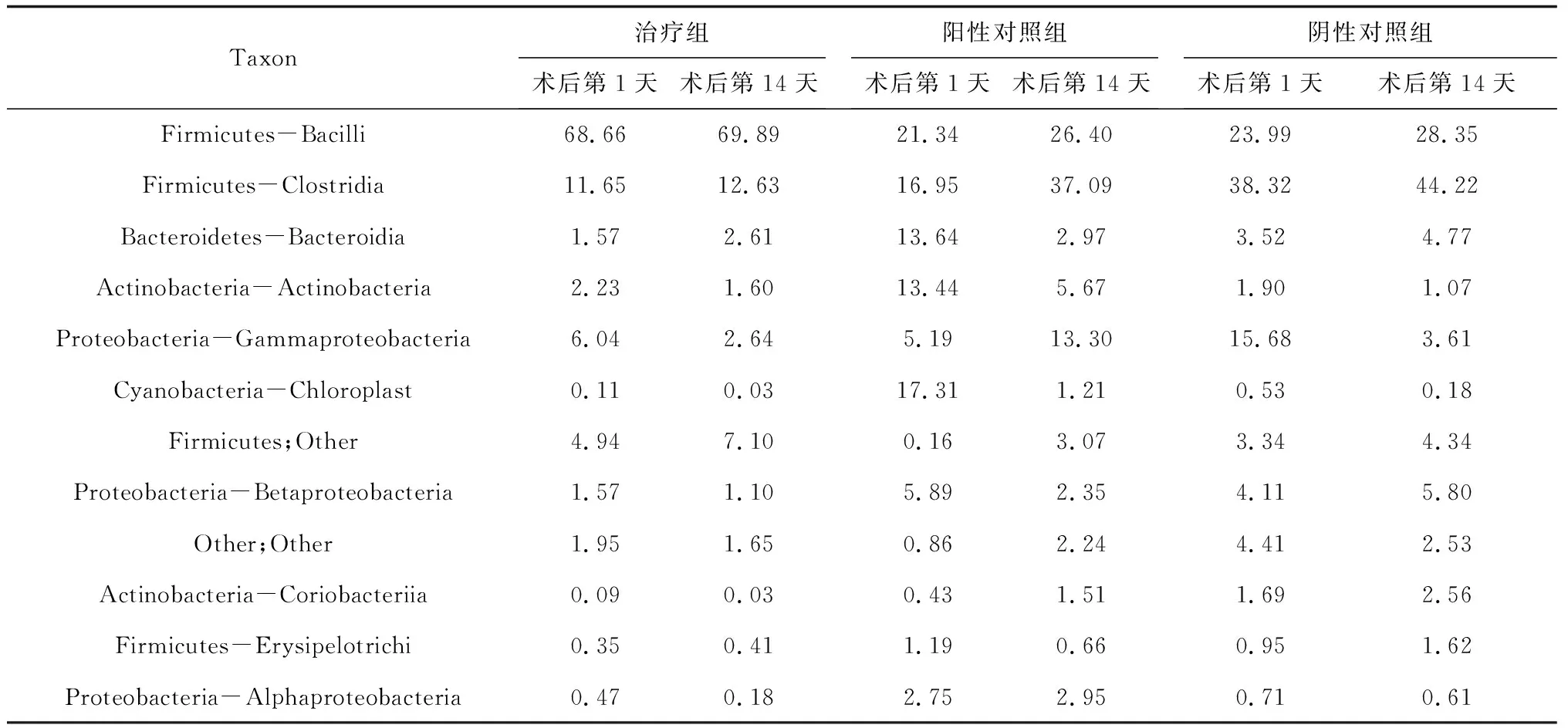
Taxon治疗组术后第1天术后第14天阳性对照组术后第1天术后第14天阴性对照组术后第1天术后第14天Firmicutes-Bacilli68.6669.8921.3426.4023.9928.35Firmicutes-Clostridia11.6512.6316.9537.0938.3244.22Bacteroidetes-Bacteroidia1.572.6113.642.973.524.77Actinobacteria-Actinobacteria2.231.6013.445.671.901.07Proteobacteria-Gammaproteobacteria6.042.645.1913.3015.683.61Cyanobacteria-Chloroplast0.110.0317.311.210.530.18Firmicutes;Other4.947.100.163.073.344.34Proteobacteria-Betaproteobacteria1.571.105.892.354.115.80Other;Other1.951.650.862.244.412.53Actinobacteria-Coriobacteriia0.090.030.431.511.692.56Firmicutes-Erysipelotrichi0.350.411.190.660.951.62Proteobacteria-Alphaproteobacteria0.470.182.752.950.710.61
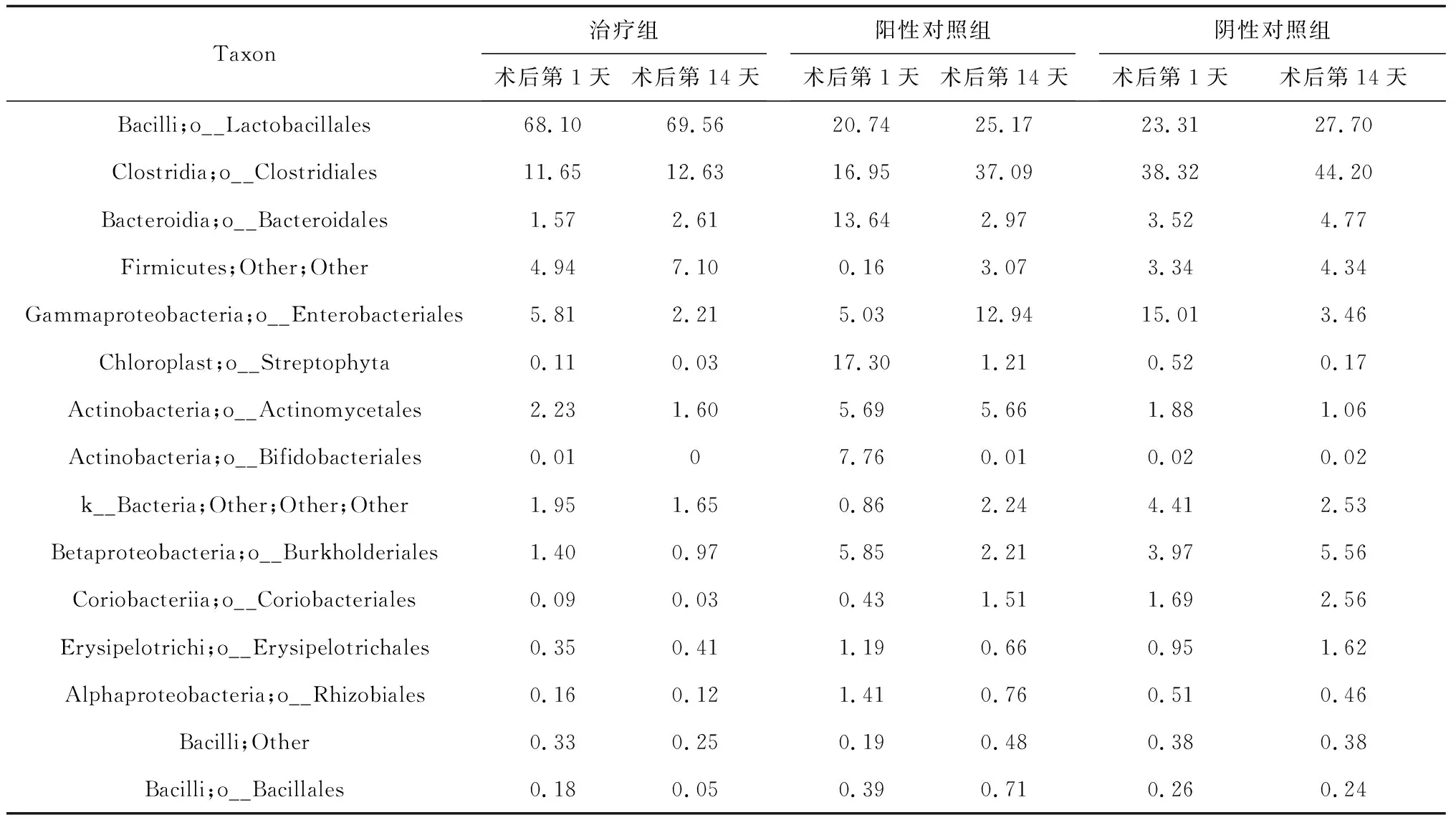
表6 目水平3组术后不同时间菌目分布情况 %
2.7各分类水平汇总分析 将门、纲、目、科、属、种6个分类水平数据进行汇总后,进行分析得出饼图5,可以直观反映出各菌群之间的相对优势情况及菌群间的从属关系。
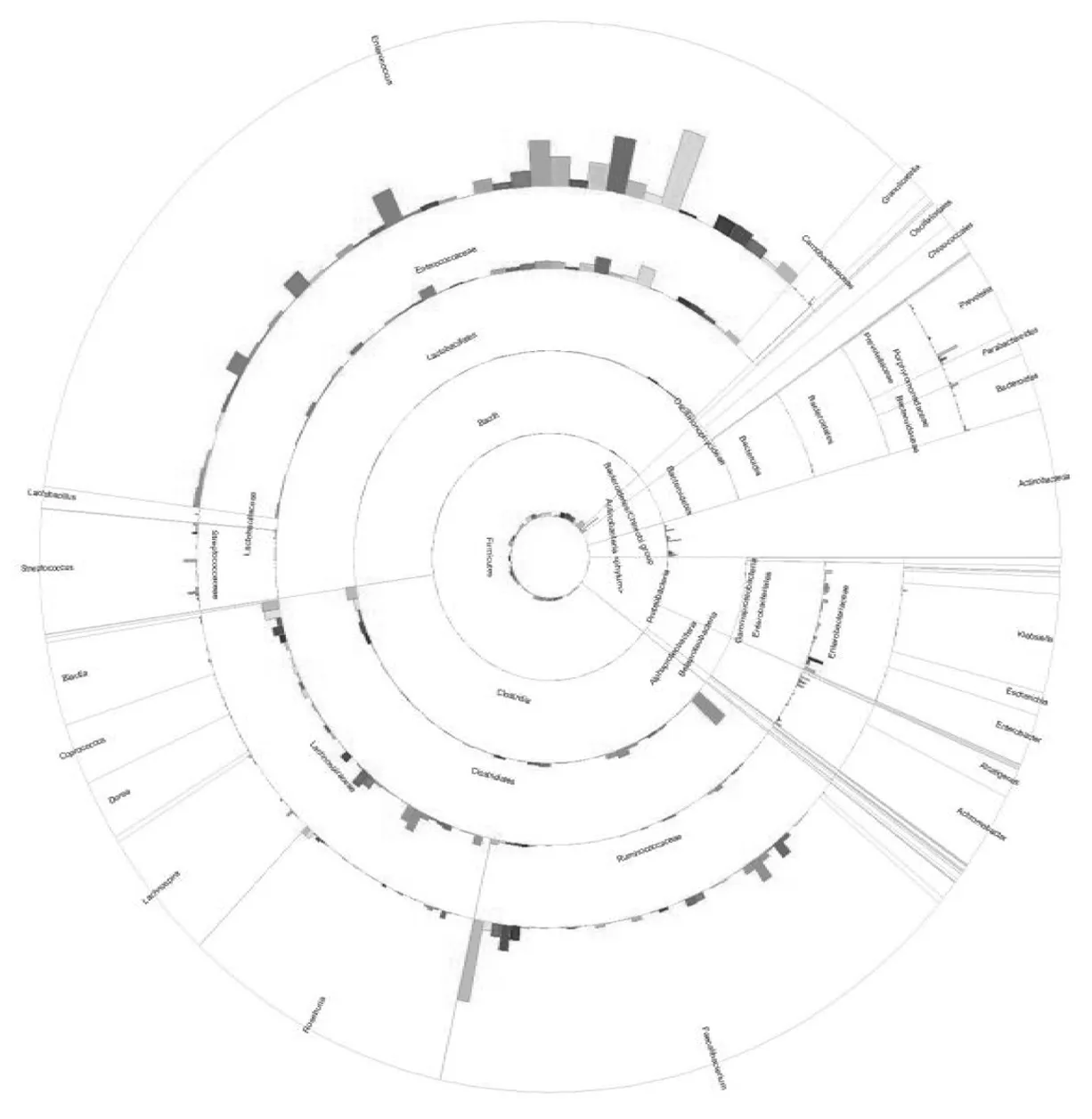
图5 6个分类水平汇总饼图
3 讨 论
肠道微生态与人类寿命、健康密切相关,构成肠道微生态的已知细菌达500余种,正常情况下这些微生物相互依存,又相互制约,保持数量和比例的稳定,共同维持肠道的微生态平衡,对人体的营养吸收、免疫调节等生理功能有重要作用,对一些代谢性疾病和消化道肿瘤有一定拮抗作用[5-6]。
肛瘘术后创面直接与外界空气、肠液等接触,具有开放式、污染式等特征,其有菌创面愈合的快慢可能与肠道菌群、饮食物过敏、炎性肠病、糖尿病等相关。糖尿病患者肛瘘术后创面难愈是临床常见的一个难题,因此,本研究选取合并有糖尿病的肛瘘患者作为研究对象,探讨创面局部微环境中菌群与肛瘘术后创面愈合情况的相关性。
近年来,越来越多的研究认为肠道菌群是控制体质量和能量代谢的一个重要因素,并且与肥胖、2型糖尿病等代谢性疾病密切相关[7]。糖尿病患者由于长期处于高糖状态,导致血浆渗透压升高,吞噬细胞对病菌的杀伤及吞噬能力受到影响,自身免疫功能降低,肠道功能紊乱,导致肠道菌群失衡[8]。许小津等[9]认为2型糖尿病患者肠道双歧杆菌总菌数量减少,即双歧杆菌整体数量减少。研究表明,粪拟杆菌、变异梭状芽孢杆菌、大肠埃希菌、脱硫弧菌属、加氏乳杆菌、变形链球菌和副流感嗜血杆菌等有促糖尿病发生的作用,而梭状芽孢杆菌、直肠真杆菌、罗斯氏菌、疣微菌科、Akkermansiamuciniphila和普氏粪杆菌等有抗糖尿病的作用[10-11]。邵加庆[12]认为,肠道菌群与能量贮存与代谢、肠道旁分泌与内分泌均息息相关,肠道菌群通过其基因、中间产物和代谢活力等影响着人体的代谢、活动、体质量、免疫等多方面,从而对健康和疾病产生双向影响。而中医研究表明,气机的升降理论能调节肠道菌群,有维持肠道菌群的稳态作用[13]。本研究选用的是我科闻茂康教授的经验方芪参固托方,有补气升提、健脾养血之功效。方中的黄芪、党参、太子参、山药等均有控制血糖的作用,全方可以在一定程度上调节患者血糖水平,从而影响患者基础代谢环境,调节肠道菌群。
本研究发现,在门水平3组术后第1天和术后第14天的菌群分布以厚壁菌门最丰富,变形菌门次之,放线菌门与拟杆菌门相当,蓝藻门所占比重最少。术后第14天,阴性对照组厚壁菌门、拟杆菌门比重显著增加,变形菌门比重显著下降,放线菌门、蓝藻门变化相对较小;阳性对照组则厚壁菌门增加尤为明显,增幅高达70%;变形菌门比重与其他2组相反,呈增加趋势;其他3个菌门不同程度下降。已有肠道菌群方面的研究认为肠道优势菌门有5~9个[14],本研究中得出的优势菌门为厚壁菌门等5个菌门,与已有研究成果相符,而其中又以厚壁菌门最为突出,这可能与创面所在位置具有一定的相关性,由于其余肠道相通的特点,因此其菌群受到肠道菌群的影响。而阳性对照组的菌群结构变化情况印证了已有的糖尿病肠道菌群方面的相关研究结果[15],厚壁菌门相较于阴性对照组偏低,拟杆菌门所占比重下降,放线菌门高于阴性对照组;但同样是糖尿病患者,治疗组的变化趋势则不同于阳性对照组,可能与中药具有一定的相关性。
本实验通过高通量测序技术证实糖尿病复杂性肛瘘患者术后创面局部微环境中的菌群与不伴糖尿病患者的菌群多样性和种群结构明显不同,特别是在门水平上;而补气升提法可使糖尿病复杂性肛瘘患者术后创面局部微环境中的菌群物种、丰度分布发生变化,由门水平至目水平上将其调节到与不伴糖尿病患者菌群相似。由于本研究受样本数量及时间限制,尚未对补气升提法改善糖尿病复杂性肛瘘患者术后创面局部微环境中菌群的具体机制进行研究,未来可加大样本数量,进一步研究探讨。
