Vav3在小细胞肺癌组织中的表达及对细胞迁移和侵袭能力的影响
2018-09-01李大刚李辉宗康乐
李大刚,李辉宗,康乐
(1.山东省临沂市人民医院东医疗区 呼吸内科,山东 临沂 276000;2.山东省蒙阴县中医院 内三科,山东 蒙阴 276200)
小细胞肺癌(small cell lung cancer,SCLC)作为肺癌常见类型之一,约占原发性肺癌的20%左右[1],由于该肿瘤侵袭力强、生长迅速且易早期转移,多数患者临床确诊时已处于中晚期,尽管该肿瘤细胞对放化疗敏感,但治愈率较低,多数患者治疗后仍会复发或转移,预后较差,5年生存率低于10%[2]。因此,积极探讨影响SCLC高侵袭、转移的相关机制对改善患者预后具有重要意义。Vav3作为原癌基因Vav家族重要成员,在多种恶性肿瘤组织中呈高表达[3],与肿瘤发生、转移过程密切相关,在肿瘤细胞黏附、凋亡、迁移、侵袭中发挥关键性作用[4]。本研究通过检测SCLC组织中Vav3表达,探讨其与患者临床病理特征之间的关系及对预后的影响,并利用小分子RNA干扰(small RNA interference,siRNA)技术抑制人小细胞肺癌H446细胞株,观察其对细胞迁移和侵袭能力的影响。
1 资料与方法
1.1 一般研究
1.1.1 临床资料 选取2012年2月-2016年3月在临沂市人民医院东医疗区治疗且临床资料完整的SCLC患者87例,均经支气管镜、穿刺或手术获取病理标本并明确诊断为单纯性SCLC,术前均未接受放化疗。其中,男性46例,女性41例;年龄33~79岁,平均(59.2±12.4)岁;临床分期:局限期43例,广泛期44例;61例具有吸烟史,40例发生远处转移。所有患者出院后均进行随访,方式包括门诊和电话,随访截止2017年3月31日,未出现失访病例,存活36例,死亡51例。另留取同期因肺外伤行手术治疗的正常肺组织50例作为对照组,均排除恶性肿瘤患者。其中,男性29例,女性21例;年龄31~78岁,平均(60.1±12.9)岁。本研究通过医院伦理委员会批准。
1.1.2 主要试剂和设备 免疫组织化学(简称免疫组化)试剂盒购自福州迈新生物技术开发有限公司,兔抗人Vav3多克隆抗体购自美国Santa Cruz公司,人小细胞肺癌H446细胞株购自美国ATCC公司,DMEM培养基、胎牛血清购自美国Gibco公司,Vav3、内参引物由生工生物工程(上海)股份有限公司设计合成,siRNA-Vav3、siRNA-对照序列由上海吉玛制药技术有限公司设计合成,LipofectamineTM2000转染试剂、Trizol总RNA提取试剂盒购自美国Invitrogen公司,逆转录、PCR试剂盒购自宝生物工程(大连)有限公司,Transwell小室购自美国Costar公司,实时荧光定量PCR仪(quantitative real-time PCR,qRT-PCR)购自美国ABI公司,恒温培养箱购自常州迈科诺仪器有限公司。
1.2 方法
1.2.1 组织中Vav3蛋白表达的检测 取SCLC和对照组组织,甲醛固定、石蜡包埋、切片,厚度约4 μm,用二甲苯脱蜡,经梯度酒精脱水,用3% 过氧化氢H2O2浸泡10 min以消除内源过氧化物酶影响,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次,置于枸橼酸(pH 6.0)液中煮沸15 min,用1%血清工作液封闭,室温孵育25 min。加入一抗兔抗人Vav3多克隆抗体(稀释比例1∶500),4℃过夜孵育,PBS冲洗3次,加入二抗,室温下静置120 min,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,脱水透明后封片,以PBS代替一抗作为阴性对照。结果判定:以细胞质中出现淡黄色或黄褐色颗粒状或斑块状染色作为阳性,采用半定量法积分法进行结果判定[5]:①染色强度:0分:无染色;1分:淡黄色;2分:棕黄色;3分:棕褐色;②阳性细胞比例:0分:无着色细胞;1分:阳性细胞比例≤10%;2分:10%<阳性细胞比例<25%;3分:阳性细胞比例25%~50%;4分:阳性细胞比例≥50%;③将染色强度评分和阳性细胞比例评分之和作为最终结果,阴性:≤2分,阳性:>2分。所有结果判定均采用盲法由2位病理科主治医师单独完成,出现结果不一致时由病理科主任医师作出最终判定。
1.2.2 细胞培养及分组处理 取人小细胞肺癌H446细胞株,置于含10%胎牛血清的DMEM培养基中,在含5%二氧化碳CO2的37℃恒温培养箱中培养[6]。消化后,传代培养,取对数生长期细胞完成实验。对细胞进行转染并分组。①siRNA-Vav3组,转染Vav3干扰序列:正向5'-GGAAGGGTTCAGAACCTTA-3',反向5'-GAAGATCTCTATGACTGTG-3';②siRNA-对照序列组,转染对照序列:正向5'-UUCUCCGAACGUGUCA CGUTT-3',反向5'-ACGUGACACGUUCGGAGAATT-3';③空白组,不作任何处理。转染后培养48h完成后续实验。
1.2.3 qRT-PCR检测各组细胞中Vav3基因表达 取各组转染后培养48h细胞,加入细胞裂解液,用Trizol总RNA提取试剂盒获得总RNA,用紫外分光光度计检测总RNA纯度,以A260/A280在1.80~2.30为合格。逆转录试剂盒将总RNA逆转录为cDNA[7],以cDNA作为模板进行PCR。引物序列:VAV3正向5'-TGAAGGCAGAGGAAGCACAT-3',反向5'-GCATAG GAACCACAAGCAAGT-3';β-Actin 正向 5'-GTCATTC CAAATATGAGATGCGT-3',反向 5'-GCATTACATAAT TTACACGAAAGCA-3'[7]。PCR反应条件:95℃预变性1min,94℃变性30s,58℃退火30s,74℃延伸30s,连续循环38次。每个样品均设3个平行反应复孔。用2-△△Ct法计算各组细胞中Vav3基因相对表达量。
1.2.4 划痕实验检测各组细胞迁移能力 取各组转染后培养48h细胞,按2×105个/ml接种于6孔板,待细胞融合度达90%以上时,用200μl枪头于垂直于孔板划直线,且宽度相同,将散落细胞用PBS液去除,分别于0和24h时观察细胞迁移情况并拍照,用Image J图像分析软件分析划痕愈合率=(1~24h时划痕面积/0h时划痕面积)×100%。
1.2.5 Transwell法检测各组细胞迁移和侵袭能力 ①迁移能力检测:取各组转染后培养48h细胞,胰酶消化后,接种于6孔板,调整细胞密度为2×106个/ml,取200μl加入到Transwell小室上室,将600μl含20%胎牛血清的培养液加入小室下室,培养12h,多聚甲醛固定15min,结晶紫染色15min,将散落细胞用棉签轻轻去除,PBS冲洗后,显微镜观察,随机取5个视野计数穿膜细胞数。②侵袭能力检测:将50μg Matrigel胶平铺于Transwell小室上室,风干后以备检。其余步骤同迁移能力检测[7]。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,计数资料以率表示,组间比较采用χ2检验,生存分析采用Kaplan-Meier法和Log-rank χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 SCLC和对照组组织中Vav3蛋白表达比较
SCLC组织中Vav3蛋白阳性表达率为81.6%(71/87),对照组为14.0%(8/50),两组比较,差异有统计学意义(χ2=17.739,P=0.000),SCLC组织中Vav3蛋白阳性表达率高于对照组。见图1。
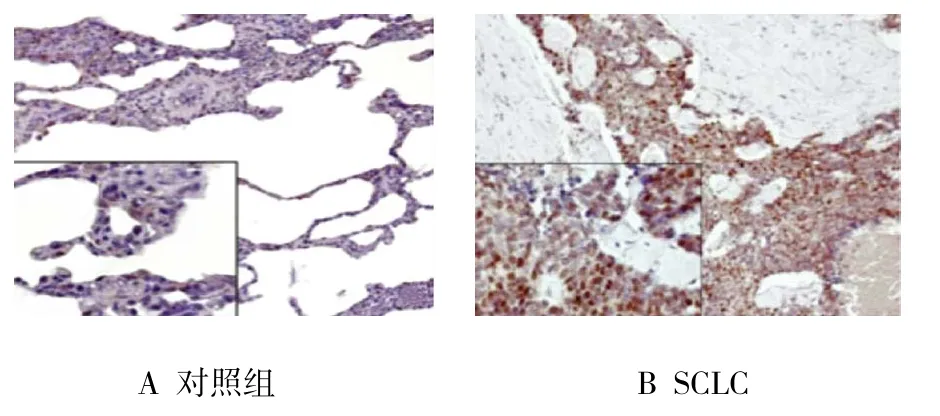
图1 两组组织中Vav3蛋白表达(免疫组化×200或400)
2.2 SCLC组织中Vav3蛋白表达与临床病理特征之间的关系
SCLC组织中Vav3蛋白表达与性别、年龄、肿瘤位置及吸烟无关(P>0.05),而与临床分期、远处转移和生存状态有关(P=0.024、0.016和0.014)。见表1。
2.3 SCLC组织中Vav3蛋白表达对预后的影响
Vav3蛋白阳性表达组患者平均生存时间23.14个月,总生存率为35.21%;而Vav3蛋白阴性表达组则为44.89个月,总生存率为68.75%。Vav3蛋白阳性表达组与阴性表达组比较,经Log-rank χ2检验,差异有统计学意义(χ2=6.280,P=0.012),Vav3蛋白阳性表达组患者平均生存时间低于Vav3蛋白阴性表达组。见图2。
2.4 各组细胞中Vav3基因表达比较
siRNA-Vav3组、siRNA-对照序列组和空白组细胞中Vav3 mRNA相对表达量分别为(1.17±0.23)、(2.19±0.14)和(2.25±0.16),经方差分析,差异有统计学意义(F=68.751,P=0.000),siRNA-Vav3组细胞中Vav3 mRNA相对表达量低于siRNA-对照序列组和空白组,见图3。
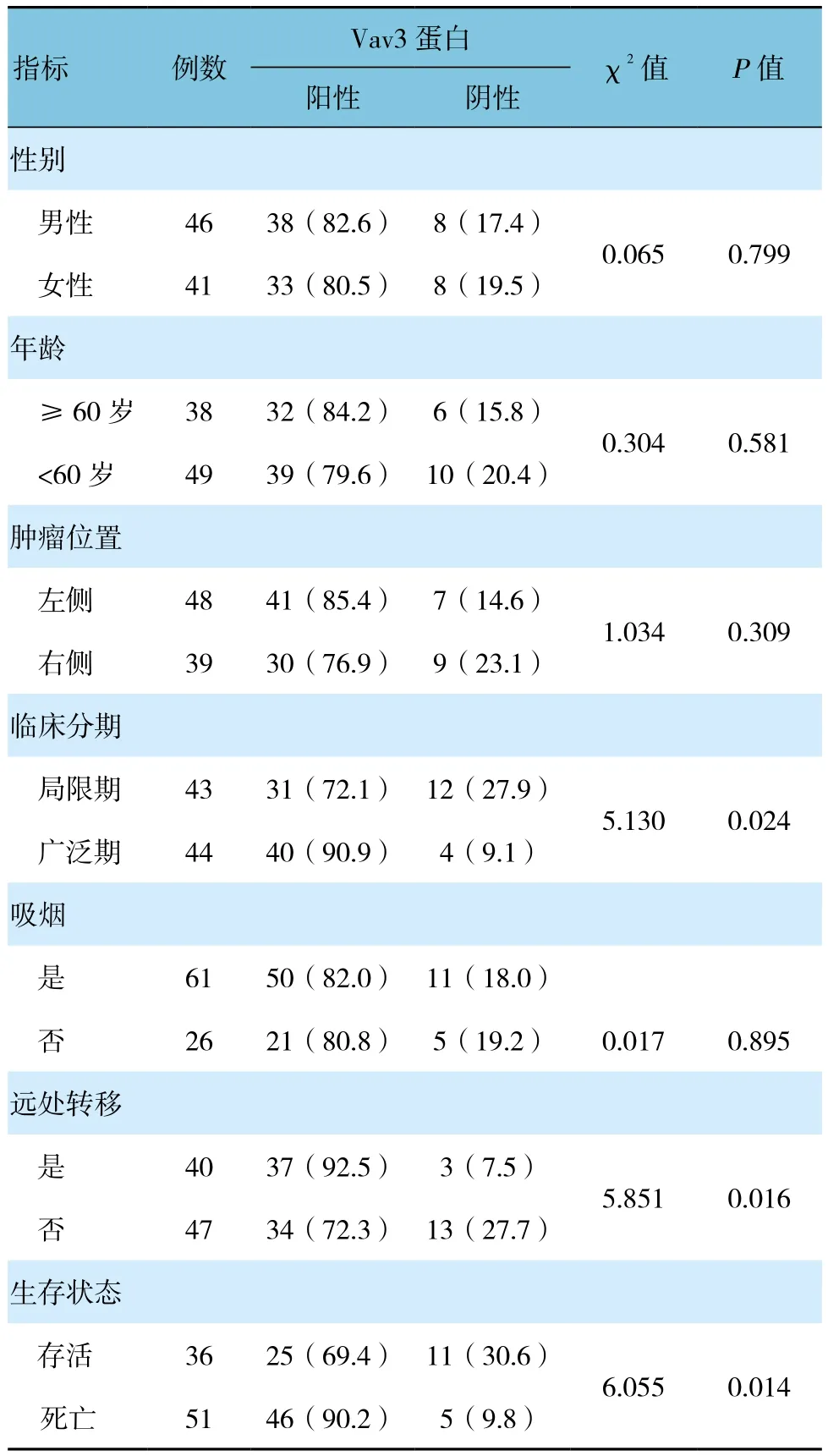
表1 SCLC组织中Vav3蛋白表达与临床病理特征之间的关系 例(%)
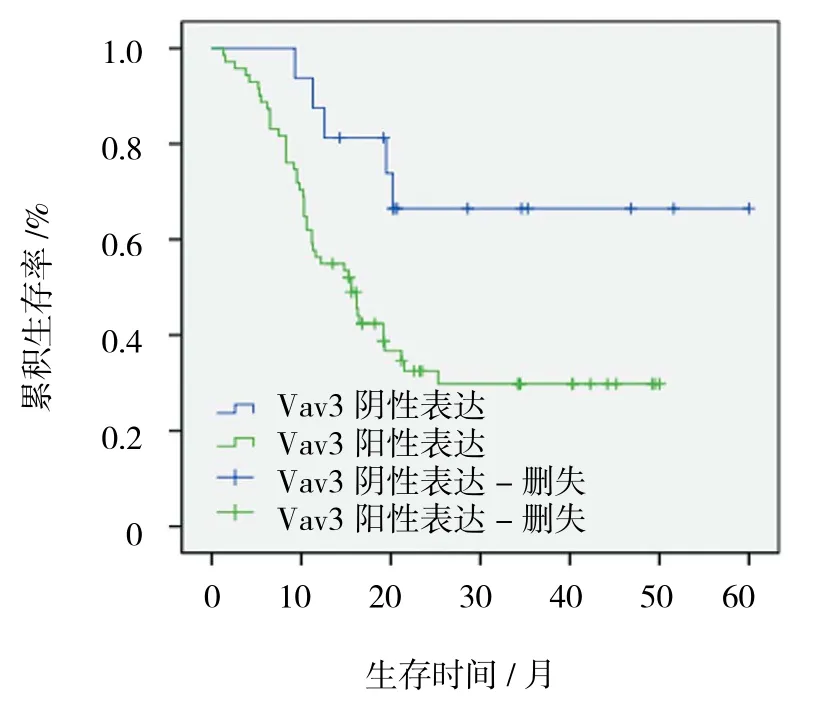
图2 SCLC组织中Vav3蛋白表达对患者预后的影响
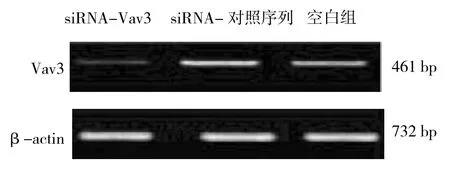
图3 各组细胞中Vav3基因表达
2.5 各组细胞迁移能力比较
划痕实验结果显示,siRNA-Vav3组、siRNA-对照序列组和空白组细胞24 h后划痕愈合率分别为(12.80±1.54)%、(29.19±3.23)% 和(27.74±1.50)%,经方差分析,差异有统计学意义(F=98.539,P=0.000),siRNA-Vav3组细胞24 h后划痕愈合率低于siRNA-对照序列组和空白组,见图4。Transwell实验结果显示,siRNA-Vav3组、siRNA-对照序列组和空白组迁移细胞数分别为(87.01±7.68)、(108.54±6.47)和(111.13±11.71)个,经方差分析,差异有统计学意义(F=13.261,P=0.000),siRNA-Vav3组迁移细胞数低于siRNA-对照序列组和空白组,见图5。

图4 划痕实验检测各组细胞愈合能力
2.6 各组细胞侵袭能力比较
Transwell实验结果显示,siRNA-Vav3组、siRNA-对照序列组和空白组侵袭细胞数分别为(97.18±9.11)、(125.52±9.66)和(130.00±9.98)个,经方差分析,差异有统计学意义(F=20.664,P=0.000),siRNA-Vav3组侵袭细胞数低于siRNA-对照序列组和空白组,见图6。
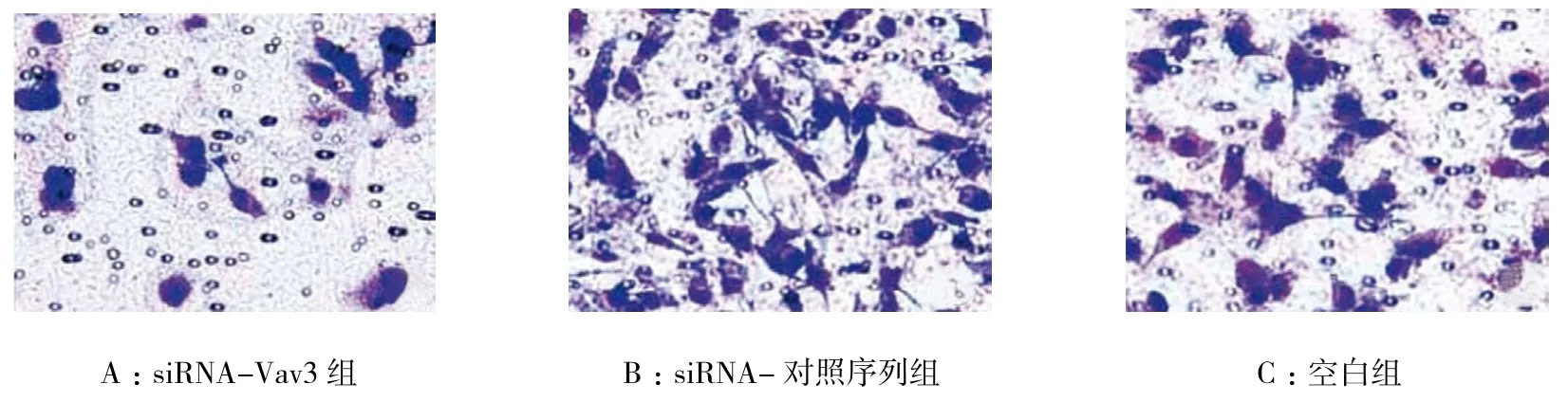
图5 各组细胞迁移能力比较 (结晶紫×200)
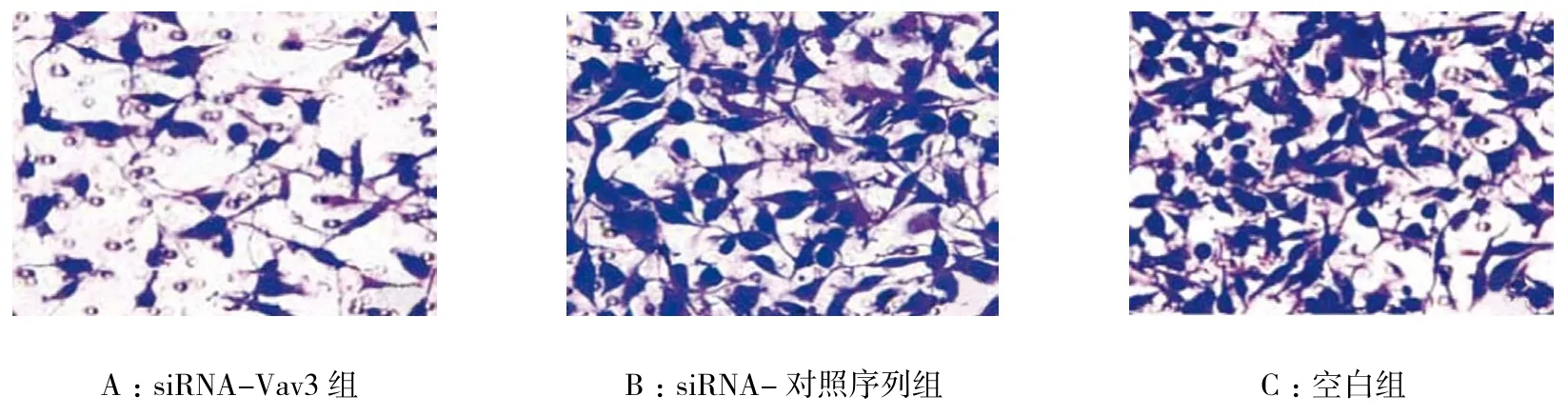
图6 各组细胞侵袭能力比较 (结晶紫×200)
3 讨论
SCLC作为肺癌常见类型,近年来发病率不断升高,临床上主要以全身化疗联合放疗、手术作为主要治疗方式,但治疗效果有限[8]。虽然SCLC细胞对化疗敏感,但极易产生多药耐药,出现复发[9]。有研究指出[10],SCLC细胞高侵袭、转移能力是影响患者治疗效果及预后的主要因素。因此,积极探讨影响SCLC高侵袭、高转移能力的相关机制,对改善患者预后具有重要意义。Vav3是癌基因家族重要成员,可通过促进三磷酸鸟苷(GTP)酶活化而参与信号转导,在基因转录及细胞转化中发挥作用[11],同时亦可通过影响Rho家族分子间相互作用而对细胞极性、黏附能力等产生影响[12]。现已证明,Vav3在多种恶性肿瘤组织中呈高表达[13],在调控肿瘤发生、转移、侵袭等过程中发挥重要关键性作用[14]。本研究结果显示,Vav3蛋白在SCLC组织中阳性表达率高于对照组,说明Vav3蛋白在SCLC组织中呈高表达,提示Vav3蛋白可能参与SCLC发生过程。进一步分析与临床病理特征之间的关系,结果显示,SCLC组织中Vav3蛋白表达与临床分期、远处转移和生存状态有关(P<0.05),广泛期、发生远处转移和死亡患者组织中Vav3蛋白表达量增加,提示Vav3蛋白可能参与SCLC侵袭转移过程,且与患者预后有关。Kaplan-Meier生存分析显示,SCLC组织中Vav3蛋白阳性表达组患者总生存率低于Vav3蛋白阴性表达组,进一步表明SCLC组织中Vav3蛋白表达与患者预后密切相关。
为进一步探讨Vav3在SCLC侵袭转移中的作用,本研究利用siRNA技术特异性沉默H446细胞中Vav3基因,结果显示,siRNA-Vav3组细胞中Vav3 mRNA相对表达量低于siRNA-对照序列组和空白组,说明H446细胞中Vav3基因被成功抑制。研究表明[15],Vav3及其反向信号分子可通过参与调控机体内多条信号转导,而在肿瘤细胞黏附、侵袭、转移中发挥重要作用。本研究划痕实验和Transwell实验结果均显示,siRNA-Vav3组划痕愈合率和迁移细胞数均低于siRNA-对照序列组和空白组,说明特异性沉默H446细胞中Vav3基因可有效抑制细胞迁移能力,同时,本研究结果显示,siRNA-Vav3组侵袭细胞数低于siRNA-对照序列组和空白组,说明特异性沉默H446细胞中Vav3基因可有效抑制细胞侵袭能力,本结果表明,Vav3基因在小细胞肺癌H446细胞迁移、侵袭过程中发挥重要作用。
综上所述,Vav3蛋白在SCLC组织中呈高表达,且与患者预后密切相关,特异性沉默SCLC细胞中Vav3基因可抑制细胞迁移和侵袭能力,有望为SCLC综合防治提供新的靶点。
