IgA肾病大鼠尿维生素D结合蛋白与肾脏纤维化关系的研究*
2018-09-01何国华容丽萍姜梦婕蒋小云
何国华,容丽萍,姜梦婕,蒋小云
(1.广东省佛山市妇幼保健院 儿科,广东 佛山 528000;2.中山大学附属第一医院 儿科,广东 广州 510089)
IgA肾病是全球最常见的原发性肾小球疾病之一[1]。在成人患者,每10年约有20%的患者进展至终末期肾病(end stage renal disease,ESRD)[2]。IgA肾病进展至ESRD的危险因素包括蛋白尿、高血压、肾功能不全、新月体形成、肾小球系膜细胞重度增生、肾小球硬化、肾小管纤维化等[1]。对IgA肾病小管间质纤维化,目前缺乏早期的、有效的、无创的指标。转化生长因子β1(transforming growth factor-β1,TGF-β1)/Smads信号通路是包括肾脏在内的多种组织纤维化的最主要通路之一,在IgA肾病患者肾组织中,TGF-β1表达与肾小管损伤及间质纤维化程度呈正相关[3]。
维生素D结合蛋白(vitamin D binding protein,VDBP)分子量为5.8 kD,是血浆中维生素D及其代谢产物的主要转运蛋白[4]。VDBP在肝脏合成,在肾小球被滤过,在近曲小管由受体介导重吸收[5]。当肾小管受损伤时,VDBP重吸收功能降低,在庆大霉素造成的肾炎大鼠模型中的研究发现,尿VDBP能够作为肾小管间质损伤的一个生物学标记,并且独立于蛋白尿的存在[6],该发现提示尿VDBP可以作为一个无创性的尿液标志,用于监测小管间质纤维化。
本研究运用改良的牛血清白蛋白(bovine serum albumin,BSA)+脂多糖(lipopolysaccharide,LPS)+四氯化碳(carbon tetrachloride,CCl4)方法复制实验性IgA肾病大鼠模型[3],研究尿VDBP在IgA肾病肾小管间质纤维化中的作用。
1 材料与方法
1.1 动物模型的复制及分组
健康清洁级5周龄雄性Sprague-Dawley(SD)大鼠采购自广东省医学实验动物中心,共20只,体重120~140 g,随机分为对照组,模型组,每组10只。其中模型组运用改良的BSA+LPS+CCl4方法复制实验性IgA肾病大鼠模型[3]。具体方案:将免疫原BSA以蒸馏水配成10%浓度,隔天灌胃400 mg/kg,持续8周;皮下注射蓖麻油0.3 ml+CCl40.1 ml,每周1次,持续9周;LPS以生理盐水配成0.025%浓度,于实验第6周尾静脉注射0.05 mg。同时对照组大鼠给予蒸馏水灌胃,生理盐水皮下注射及尾静脉注射。所有大鼠在实验期间均予标准饮食。在实验第10周末收集尿标本后处死大鼠收集血标本、肾组织标本进行下述测量。
1.2 尿蛋白、尿红细胞及尿VDBP的测量
在实验第10周末使用代谢笼留取大鼠24 h尿,进行尿红细胞镜检,并分别记录尿量,测定24 h尿蛋白。通过酶联免疫吸附法(维生素D结合蛋ELISA试剂盒,美国Alpco公司)测定尿VDBP含量。
1.3 血生化检测
在实验第10周末,处死大鼠,予10%水合氯醛0.3 ml/100 g腹腔注射麻醉,心脏取血,用全自动生化分析仪测定血中生化指标,包括:尿素氮(BUN)、肌酐(Scr)、总蛋白(TP)、白蛋白(Alb)。
1.4 肾脏病理检查
大鼠处死后取约0.2 cm厚度矢状面切片,置于10%甲醛固定,48 h内行石蜡包埋,用于光镜检查及免疫荧光IgA检查。IgA免疫荧光强度判定,根据目前国内外通用标准,参照5级半定量法分为-~++++5个等级。①-:低倍镜下不能显示、高倍镜下似乎可见;②+:低倍镜下似乎可见,高倍镜下可见;③++:低倍镜下可见,高倍镜下清晰可见;④+++:低倍镜下清晰可见,高倍镜下耀眼;⑤++++:高倍镜下刺眼。使用Masson三色染色评估肾脏组织纤维化程度[7],胶原纤维呈蓝色,采用Image-Pro Plus 6.0软件进行半定量分析,以胶原纤维在肾组织含量的百分比表示肾脏组织的纤维化程度。
1.5 TGF-β1蛋白表达的检测
采用Western blot法检测。将样品组织研成粉末,加入裂解液提取总蛋白,BCA法测定计算蛋白质浓度。取相同质量的蛋白质变性,上样,SDS-PAGE电泳、转膜。封闭液封闭120 min,后置于一抗孵育,反应时间90 min,洗膜,二抗孵育60 min,洗膜,用化学发光置于暗夹内曝光、依次显影、定影。将胶片进行扫描,应用Quantity One图像分析软件对凝胶图像条带进行分析,计算目标条带的净光密度值。
1.6 统计学方法
数据分析采用SPSS 24.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,相关性分析用Pearson法,P<0.05为差异有统计学意义。
2 结果
2.1 肾脏病理结果
对照组大鼠肾小球无明显IgA沉积,荧光强度-~±(见图1A、B),模型组肾小球系膜区均可见团块状或颗粒状绿色IgA荧光,荧光强度++~+++(见图1C、D),提示IgA肾病大鼠模型复制成功。
2.2 血生化检测结果
两组BUN、Scr、TP、ALB水平比较,差异无统计学意义(P>0.05)。见表 1。
2.3 各组24 h尿蛋白、尿红细胞、尿VDBP的变化
模型组24 h尿蛋白、尿红细胞、24 h尿VDBP高于对照组,差异有统计学意义(均P<0.05)。见表2。
2.4 各组肾纤维化及TGF-β1蛋白表达水平的变化
在Masson染色病理改变上,对照组肾小球、肾小管及间质组织病理形态无异常,系膜区基质及细胞未见增加,肾小管、肾间质、血管无明显病变,肾组织鲜有蓝色胶原纤维着色区域(见图2A)。模型组Masson染色见系膜区中到重度不同程度细胞及基质增生,部分肾小球基底膜、系膜区见蓝色线条状区域,在肾间质小管处可见斑块条状蓝色区域散在分布,血管胶原纤维也呈蓝色着色(见图2B)。
模型组胶原纤维含量[(13.80±6.18)%]高于对照组 [(1.23±1.07)%]差异有统计学意义(P<0.05)。见表2。
模型组肾组织TGF-β1蛋白表达水平(1.03±0.14),高于对照组(0.61±0.14),差异有统计学意义(P<0.05)。
2.5 相关性分析
所有大鼠24 h尿VDBP与尿蛋白呈正相关(r=0.859,P=0.000),与肾纤维化呈正相关(r=0.908,P=0.000),与TGF-β1蛋白表达呈正相关(r=0.859,P= 0.009)。见表3和图3。

图1 两组大鼠肾脏病理学改变 (免疫荧光)
表1 两组血生化检测结果 (n =10,±s)
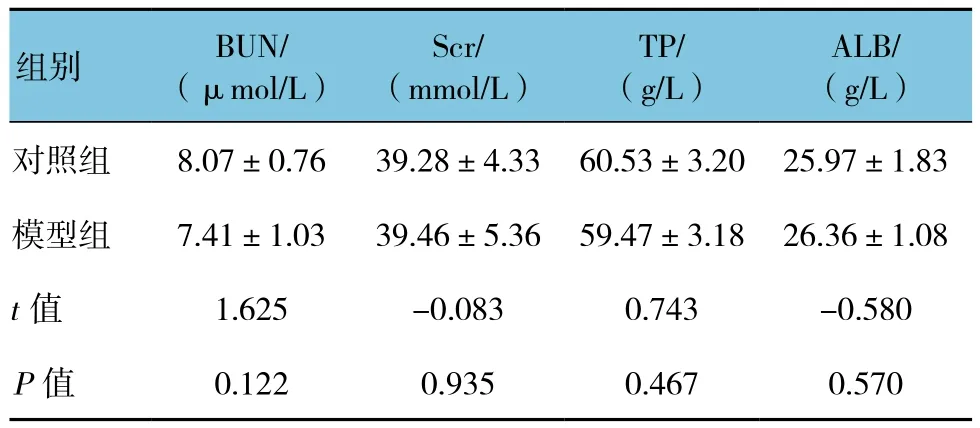
表1 两组血生化检测结果 (n =10,±s)
ALB/(g/L)对照组 8.07±0.76 39.28±4.33 60.53±3.20 25.97±1.83模型组 7.41±1.03 39.46±5.36 59.47±3.18 26.36±1.08 t值 1.625 -0.083 0.743 -0.580 P值 0.122 0.935 0.467 0.570组别 BUN/(μmol/L)Scr/(mmol/L)TP/(g/L)

图2 两组大鼠肾脏染色结果 (Masson×100)
表2 两组尿蛋白、尿红细胞、尿VDBP、胶原纤维、肾组织TGF-β1蛋白表达水平的比较 (n =10,±s)
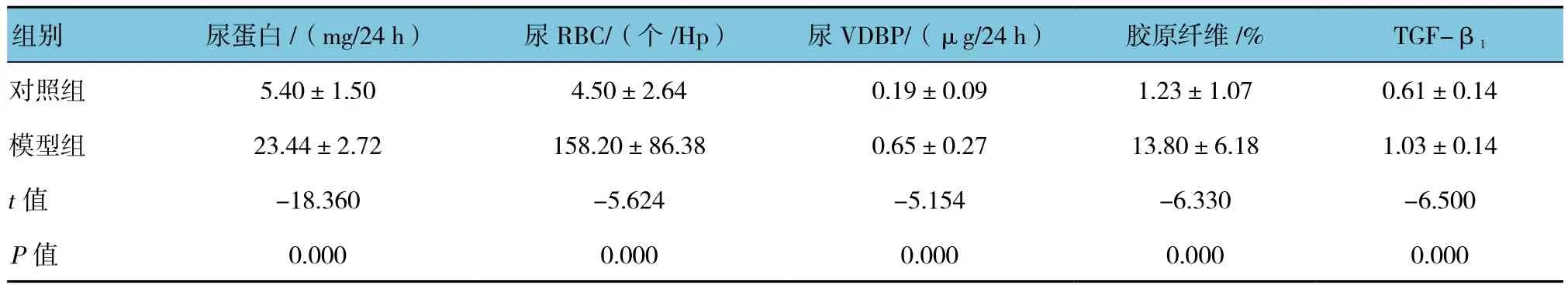
表2 两组尿蛋白、尿红细胞、尿VDBP、胶原纤维、肾组织TGF-β1蛋白表达水平的比较 (n =10,±s)
组别 尿蛋白/(mg/24 h) 尿RBC/(个/Hp) 尿VDBP/(μg/24 h) 胶原纤维/% TGF-β1对照组 5.40±1.50 4.50±2.64 0.19±0.09 1.23±1.07 0.61±0.14模型组 23.44±2.72 158.20±86.38 0.65±0.27 13.80±6.18 1.03±0.14 t值 -18.360 -5.624 -5.154 -6.330 -6.500 P值 0.000 0.000 0.000 0.000 0.000

图3 尿蛋白、尿VDBP与肾脏纤维化的相关性
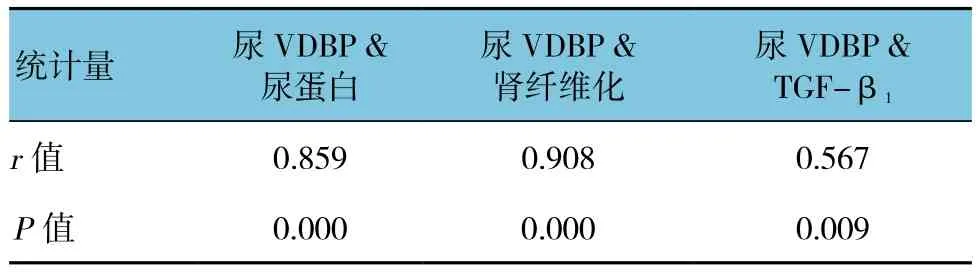
表3 尿VDBP分别与尿蛋白、肾纤维化、TGF-β1蛋白表达的相关分析
3 讨论
IgA肾病的临床表现多样,轻重程度不一,从无症状的尿检异常到急性肾衰竭均可出现。IgA肾病病理改变多种多样,但时常有不同程度的肾间质病变,研究发现,小管间质受累程度影响到肾小球病变的转归[8-9]。在IgA肾病患者中,部分肾小球病变严重,但间质病变轻微的患者长期预后较好,而间质损害严重,小球病变轻微的病例长期随访预后不佳,提示肾脏间质纤维化是预测IgA肾病病情预后的重要指标[10]。
VDBP为簇特异性蛋白(group-specific component,Gc)分子量为5.8 kD,在体内有多重作用,包括转运维生素D,调控体内炎症反应以及免疫调节等作用[11]。VDBP在肝脏合成,经过肾小球滤过,在近曲小管重吸收[5],因此,尿中的VDBP水平很大程度取决于肾小管的重吸收功能。当肾小管间质出现纤维化改变时,可以导致尿VDBP重吸收减少,从而使尿中VDBP升高[6,12],上述研究为检测尿VDBP水平反应小管间质损伤提供理论依据。
本研究结果显示,IgA肾病模型组尿VDBP高于对照组。既往其他动物模型及肾病患者研究中,亦发现肾损伤时尿VDBP水平升高:在阿霉素大鼠模型中,尿VDBP在肾损伤早期即出现升高,与小管间质纤维化的指标密切相关[6],并且独立于白蛋白尿[6]。在大鼠尿毒症模型中,发现从尿中丢失VDBP增多[13]。而在糖尿病肾病患者的研究中发现,尿VDBP排出量增加[14]。本研究也发现,模型组尿VDBP定量高于对照组,说明在IgA肾病在肾损伤时会出现尿VDBP定量升高。
TGF-β1/Smad3信号通路在肾小球硬化、肾小管损伤和肾间质纤维化过程起其重要的作用。TGF-β1与具有丝氨酸-苏氨酸活性的细胞的表面受体过特异性结合,并激活该受体,启动免疫应答,作用于相应的靶基因,如纤连蛋白(fibronectin,FN),调节其转录、表达。FN表达水平上调意味着细胞外基质(extra cellular matrix,ECM)积聚,最终会出现肾小球硬化和肾间质纤维化[15]。在IgA肾病患者肾组织中,TGF-β1表达与FN表达呈正相关,并且与肾小管损伤及间质纤维化呈正相关[15]。本研究进一步发现,24 h尿VDBP水平与肾脏纤维化程度以及TGF-β1蛋白的表达呈正相关,提示尿VDBP可以反映肾脏纤维化程度,并随着肾损伤的严重程度而增加。尿VDBP水平与肾小管细胞巨噬细胞浸润程度以及胶原纤维表达呈正相关,并与多种小管损伤因子呈正相关[6]。CKD患者中研究发现,尿VDBP随疾病的严重程度而增加[16-17]。提示尿VDBP可能涉及肾脏纤维化过程中多种系统免疫调控,但尚有待进一步研究证实。
本研究发现,在IgA肾病模型中,24 h尿VDBP与24 h尿蛋白呈正相关。在阿霉素大鼠模型研究中,尿VDBP在肾损伤早期升高,并且独立于白蛋白尿,提示尿VDBP在尿蛋白出现改变之前即可发生改变,反应肾损伤的程度[6]。本实验研究结果显示,模型组大鼠的尿蛋白及尿VDBP水平高于对照组,尿VDBP组间的差异与肾脏纤维化程度及在肾组织纤维化的程度改变一致,提示与尿蛋白相似,尿VDBP能反应肾组织纤维化的程度。在CKD患者的一项研究中发现,尿VDBP在CKD患者中升高,并且与蛋白尿水平呈正相关[18],其研究结果与本实验研究发现一致。推测其原因,无论是阿霉素肾病大鼠、IgA肾病大鼠、CKD患者,其蛋白尿成分主要为白蛋白,白蛋白分子量为6.85 kD,分子量比VDBP大。白蛋白主要经过肾小球滤过,在肾小球滤过屏障损伤时,尿中白蛋白升高,是尿蛋白的主来源。尿蛋白水平是公认的反应肾小球滤过屏障损伤的指标,而前述研究中提到,尿VDBP是在肾小管被重吸收,尿中VDBP水平反应肾小管损伤及间质纤维化程度的指标。故从反映肾纤维化角度出发,尿VDBP可能是比尿蛋白更敏感、准确的指标。提示尿VDBP可以作为一个无创性的尿液标志,用于早期监测小管间质炎症和纤维化。在不同的肾脏疾病中,尿VDBP水平与尿蛋白水平是否存在相关性该问题,值得进一步探讨。
本研究发现,IgA肾病大鼠尿VDBP升高,尿VDBP与肾纤维化、尿蛋白呈正相关,尿VDBP可作为监测IgA肾病大鼠肾纤维化的一个无创的生物学指标。
