TMSN-AA纳米复合物促进人胚胎干细胞向心肌细胞分化的潜在机制研究*
2018-09-01任明明韩振陈立波李敬来冯钢许志锋黄磊欧阳春
任明明,韩振,陈立波,李敬来,冯钢,许志锋,黄磊,欧阳春
(北京大学深圳医院,广东 深圳 518036)
心血管疾病是当今威胁人类健康最严重的疾病之一,高居致死病因的首位[1]。由于成年心肌细胞不具有再生性,因此,在心肌坏死的治疗过程中,心脏移植成为重要的治疗手段[2]。人胚胎干细胞(human embryonic stem cells,hESCs)是心脏再生医学领域最有希望的细胞源,其具有无限分化的能力和增殖能力,从hESCs衍化生成的心肌细胞可以通过细胞移植取代病损心肌而恢复心脏功能。优化心肌细胞分化的方法,从而获得足够数量和纯度的心肌细胞是进行细胞移植治疗的关键[3-5]。
心脏发育是精密且细致的过程[6]。然而如何实现人类胚胎干细胞高效转化为均一的心肌细胞仍然充满挑战。近年来,随着纳米技术在生物医学领域越来越广泛的应用,逐渐成为生物医学研究的新型热点,其中介孔纳米二氧化硅(mesoporous silica nanoparticles,MSN)作为一种纳米药物输送载体,在体外研究中得到了更广泛的应用[7-8]。本研究采用优化的介孔二氧化硅纳米输送体系作为诱导剂,探讨体外诱导hESCs定向心肌分化可行性及其可能的调控机制。
1 材料与方法
1.1 细胞系
hESCs(X-01系)购自上海斯丹赛生物技术有限公司。
1.2 主要试剂与仪器
硅酸四乙酯(tetraethyl orthosilicate,TEOS)、氨丙基三乙氧基硅烷(3-aminopropyl trimethoxysilane,APTES)、十六烷基三甲基溴化铵(cetrimonium bromide,CTAB)、乙醇、氢氧化钠(sodium hydroxide,NaOH)、 四 甲 基 罗 丹 明(tetramethyl rhodamine,TRITC) 盐 酸(hydrochloric acid,HCl)、 抗 坏 血 酸(ascorbic acid,AA)cTnl(ab47003)、FLK-1(ab2349),SOX2(ab97959) 及 OCT(ab19857) 抗 体( 购 自Abcam 公 司 ),ERK1/2、p-ERK1/2、Akt、p-Akt及PD98059(购自Cell Signaling Technology),GAPDH抗体(购自碧云天生物公司),IME-Ⅱ倒置相差显微镜(购自日本Olympus公司),Nikon数码相机和MCV-16BSU超净工作台(购自日本Sanyo公司),高速离心机3~18 k(购自美国Sigma公司),PCR仪(购自德国 Biometra公司)(PCR Stepone plus)。
1.3 MSN纳米粒子的合成
MSN和荧光包被MSN的制备参考文献[9-10],基于两步法微调后制备而成,首先将12 μl APTES加入到5.5 mg TRITC和3 ml无水乙醇的溶液中,随后在惰性气体中搅拌2 h。然后将TRITC-APTES溶液加入2.5 ml TEOS,避光搅拌12 h。取另1个容器,将0.5 g CTAB溶于240 ml超纯水与1.75 ml NaOH(2 mol/L)的溶液中,并在50℃剧烈搅拌。待CTAB溶液的温度稳定后,加入含有TEOS和TRITC-APTES的乙醇溶液,50℃避光搅拌24 h。过滤样品并用甲醇洗涤。为了去除颗粒的孔中表面活性剂,将850 mg颗粒分散在90 ml甲醇和5 ml氢氯酸(12.1 mol/L)的溶液中并回流24 h。然后将颗粒过滤,用甲醇充分洗涤,并在室温下干燥。MSN的合成则是省略上述第一步。
1.4 MSN特性
采用光谱仪(Shimadzu UV-2450)测定紫外-可见吸收光谱。通过粒度分析仪系统(90 Plus,Brookhaven Instruments)测量MSN的流体动力学尺寸分布特征和ζ电位。在200 kV的加速电压通过JEOL模型JEM-2010透射电子显微镜得到TEM图像。为制备TEM样品,将MSN溶液滴分散在碳涂覆的300目铜格栅(Carbon Type-B,Ted Pella,Inc)上,将乙酸铀酰溶液(2%,10 μl)滴加到网格上进行阴性染色。
1.5 TMSN与TMSN-AA的合成
将TRITC负载二氧化硅纳米颗粒(TRITC mesoporous silica nanoparticles,TMSN)(50 mg)和 AA(5 mg)加入5 ml超纯水中并搅拌24 h,然后将混合物以7 000 r/min离心10 min,弃去上清液。通过使用紫外-可见分光光度法,比较原始溶液和上清液的吸光度值,以确定装载在TMSNs内的AA的量。用超纯水超声处理载有药物的TMSN并洗涤2次以除去吸附在表面而不是孔内的AA。TMSN纳米载体的负载效率为:1 mg/ml,TMSN可负载0.12 mg/ml的AA。
1.6 细胞培养
将人胚胎干细胞(hESCs)常规培养于DMEM(Gibco)培养基与Ham's F-12培养基1∶1混合的培养基中,其中含有1.2 g/L碳酸氢钠,2.5 mmol/L L-谷氨酰胺,15 mmol/L 4-羟乙基哌嗉乙碘酸(HEPES),0.5 mmol/L丙酮酸钠,0.1 mmol/L非必需氨基酸,0.1 mmol/L 2-巯基乙醇,4 ng/ml bFGF和15%胎牛血清。将hESCs细胞接种在没有饲养层细胞的超低培养板中,37℃、5%二氧化碳CO2培养箱中培养。
1.7 RNA提取与RT-PCR检测靶基因mRNA水平
以PBS处理组作为阴性对照组,TMSNs,AA和TMSN-AA分别处理hESCs细胞14 d后,使用Trizol(Invitrogen)从hESCs细胞中提取总RNA,并用分光光度计(Nano Drop 2000)。参照说明书,使用逆转录酶试剂盒(Takara)将总RNA(2 μg)逆转录成cDNA。通过使用SYBR Green(TaKaRa)在ABI Prism 7300实时PCR系统中实时测定靶基因的mRNA水平。所用引物的序列见附表。
1.8 MTT法检测细胞活力
通过MTT测定法测量细胞活力。将hESCs细胞以5 000个/孔的密度接种在96孔板中,以PBS处理组为对照组,不同浓度的MSN纳米颗粒和TMSN纳米颗粒孵育48 h。在每个测定中,加入5 mg/ml MTT,孵育4 h。然后加入150 μl 100%二甲基亚砜(DMSO,Sigma),缓慢振荡5 min使沉淀溶解。然后用波长490 nm的酶标仪(Bio-Rad)测量吸光度。细胞活力计算为样品孔的吸光度与对照孔的吸光度之比,以百分数表示,将未处理细胞的存活率指定为100%。
1.9 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,组间比较采用方差齐性检验和单因素方差分析。两两比较,若方差齐时,采用SNK检验(Student-Newman-Keuls法);若方差不齐时,采用Games-Howell检验,P<0.05为差异有统计学意义。Western blot条带由相关软件处理后,采用Image J2x软件对免疫印迹条带扫描后进行半定量分析并用同一张膜上相应泳道的GAPDH或β-actin条带的灰度进行校正。用Graph Pad Prism 6软件做图。
2 结果
2.1 MSN的合成与特性
透射电子显微镜显示制备的MSN具有均匀的粒度和高度分散的球形(见图1A)。通过动态光散射(DLS)技术对MSN的流体动力学尺寸分布进行表征(见图1B),MSN的大小分布为(94.9±8.3)nm。为观察hESCs细胞中MSN的吸入情况,将MSN与荧光染料TRITC结合发现TMSNs的吸收光谱在580 nm附近达到峰值(见图1C)。采用TMSN-AA诱导剂诱导hESCs细胞(见图1D),TMSN-AA的ζ电位值保持正电荷(+22.7)mV,并与细胞膜具有强烈的静电相互作用。
2.2 TMSN进入hESCs细胞的体外检测结果
TRITC的荧光是橙色,与用MSN处理的细胞比较,用TMSN处理的hESCs细胞中呈橙色荧光。PBS作为阴性对照组,显示细胞无背景荧光干扰,提示TMSN可以成功靶向进入hESCs细胞中。见图2。
2.3 MSN和TMSN对hESCs存活与凋亡的影响
hESCs细胞用10~200 μg/ml的不同浓度的MSN或TMSN处理48 h(见图3A)。经处理的hESCs细胞的细胞存活率即使在最高浓度下也保持在80%以上。与PBS处理的细胞(空白组)比较,MSN和TMSN纳米颗粒处理的hESCs细胞无凋亡(见图3B、3C)。
2.4 TMSN-AA纳米复合体对hESCs向心肌细胞分化的影响
TMSN-AA纳米复合体可以有效地诱导人类胚胎干细胞分化为心肌细胞,显著下调OCT4(F=29.115,P=0.000)、SOX2(F=49.986,P=0.000)的蛋白水平以及mRNA 水平OCT4(F=42.655,F=0.000),SOX2(F=49.194,P=0.000),与空白组比较,差异有统计学意义(P<0.05);同时上调心肌标记基因cTnI(F=687.525,P=0.000) 和 FLK-1(F=512.688,P=0.000) 的 蛋白表达以及mRNA水平cTnI(F=560.089,P=0.000)和 FLK-1(F=106.881,P=0.000),与空白组比较,差异有统计学意义(P<0.05)。此外,相对于单独添加AA,由TMSN输送的AA用于诱导hESCs细胞分化成心肌细胞效果更为明显,效率更高,其跳动细胞比例和心率均优于单独添加AA,波动细胞百分率(F=386.835,P=0.000),自发搏动率(F=171.830,P=0.000)与空白组比较,差异有统计学意义(P<0.05)。
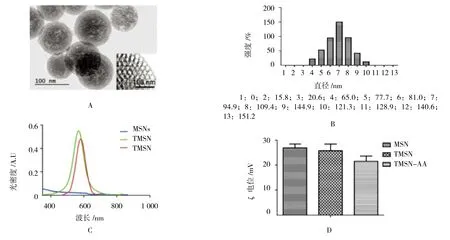
图1 MSN的形态、粒度以及3种不同MSN纳米复合物的特性表征

图2 荧光修饰的介孔二氧化硅(TMSNs)可以成功进入hESCs细胞
2.5 TMSN-AA对hESCs心肌分化影响的菌落观察

图3 MSN和荧光染料四甲基罗丹明修饰的TMSN对hESCs存活与凋亡的影响
未经诱导分化的hESC呈现紧密、并且平坦的菌落,菌落中的细胞显示出高的细胞核与细胞质的比例(见图5A1)。而单独使用AA处理后的细胞,可通过囊性腔的外观发现部分hESCs逐渐成熟(见图5A2)。使用TMSN-AA处理相同时间后,在贴壁培养条件下,hESCs细胞中心出现搏动区(见图5A3)。免疫荧光检测心脏特异性蛋白的表达。发现在跳动完整的hESCs中,cTnI和α-肌动蛋白均仅在EB的跳动区域染色阳性(见图5B)。在从hESCs的搏动区域分散的细胞中,cTnI在单细胞水平与α-actinin或α-actin共表达。此外,有组织的肌节条纹的比对模式在双重染色的分离的收缩细胞中可见(见图5C)。
对hESC衍生的心肌细胞的体外功能,笔者将该细胞的诱导作用进行药理学评价。发现随着硝苯地平(Nifedipine)剂量的增加,细胞跳动频率下降。当浓度达到10~6 mol/L时,细胞完全停止搏动。另一方面,异丙肾上腺素(Isoprenaline)处理后,细胞则是以剂量依赖的方式提高收缩频率(见图5D),上述结果表明,hESCs经TMSN-AA诱导后,可分化为功能性心肌细胞。
2.6 TMSN-AA纳米复合物在促进hESCs向心肌细胞分化的过程中ERK1/2信号通路的变化


图4 hESCs细胞中TMSN递送的抗坏血酸(AA)对其干细胞基因表达和对hESCs细胞心肌分化的影响
诱导后的hESCs采用TMSN-AA处理120 min后,检测发现ERK1/2信号通路被激活,其在TMSN-AA刺激后1 min即被激活,并持续到120 min(F=321.805,P=0.000),见图6A。采用1.5×106mol/L ERK1/2抑制剂PD98059处理后,观察hESCs细胞的搏动频率以及α-MHC的表达水平,与空白组比较,差异有统计学意义(F=444.847,P=0.000),见图6B、6C。在本过程中发现,Akt信号通路并未参与,与对照组比较差异无统计学意义(F=27.338,P=0.000),见图6D,其中处理组α-MHC的mRNA水平升高,与空白组比较,差异有统计学意义(P<0.05),而10~5 mol/L渥曼青霉素处理并不影响其表达进行20 d的处理而不变,与空白组比较,差异无统计学意义(F=11.071,P=0.0689),见图 6E、6F。

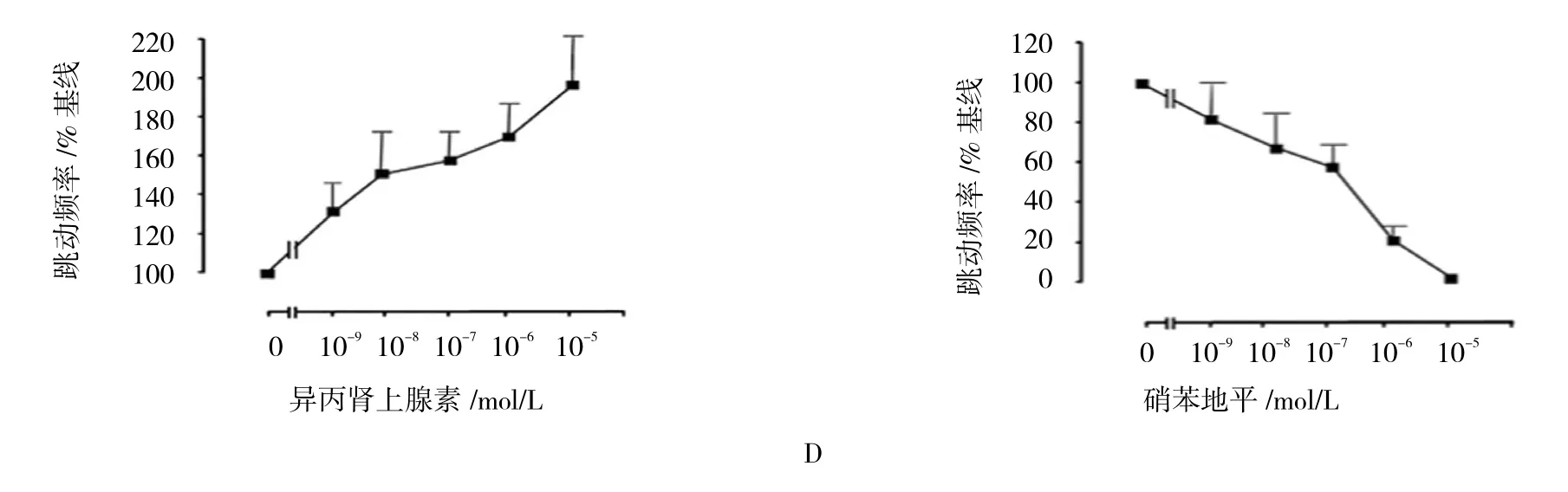
图5 功能性心肌细胞与hESCs的分化
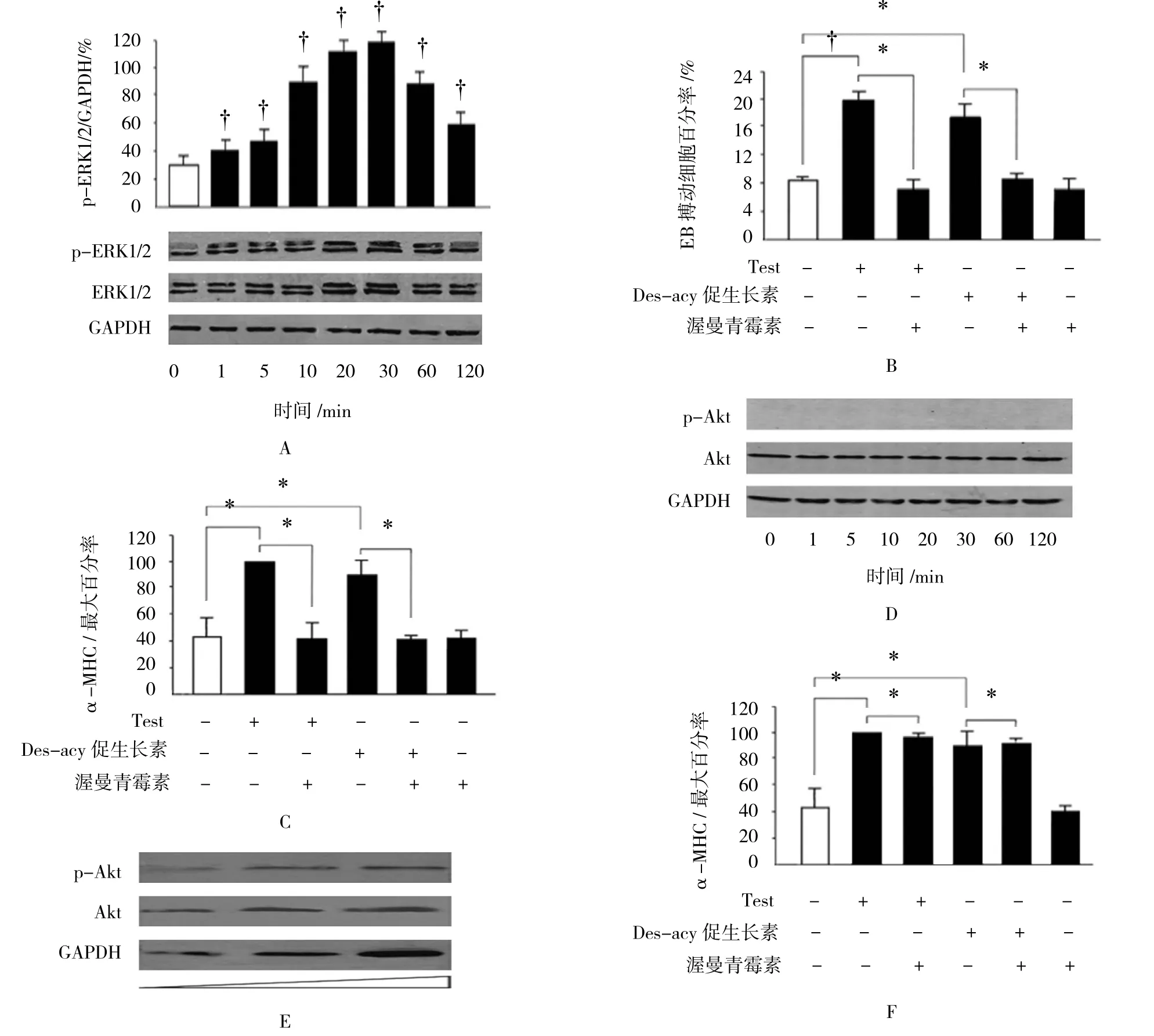
图6 TMSN-AA诱导hESCs心肌分化时ERK1/2的信号通路的变化
3 讨论
心肌细胞死亡是心肌梗死后导致心力衰竭和死亡的关键因素。心脏是终末分化的器官,再生能力十分有限,成体心脏自身无法有效补充心梗缺血区死亡的心肌细胞,而死亡的心肌细胞最终由纤维疤痕取代导致心力衰竭发生、发展[11]。迄今为止,治疗慢性心力衰竭的唯一方法就是心脏移植,但是由于供体数量的限制以及高昂的治疗费用,因而受到极大的限制[12]。因此,迫切需要发展治疗心肌梗死及继发心力衰竭的新方法,以降低心肌梗死和心力衰竭的死亡率。
hESCs是来源于早期人胚胎未分化内质网细胞的特异性干细胞,其具有在体外通过某些特定的因子诱导,无限增殖和分化成任何细胞的潜能,被认为是全能干细胞,对各类细胞的再生起重要作用[13]。根据其分化的不同细胞类型,目前已经有大量的研究用于组织修复等。到目前为止,可通过细胞移植治疗的疾病范围已经包括糖尿病、创伤性脊髓损伤、杜氏肌营养不良、心脏病或视听受损等[11,14]。但由于受分化程序繁琐且时间较长,分化效率低等限制,虽然已经证实AA、DMSO及5-Aza-2'-脱氧胞苷等具有诱导干细胞分化的能力,但该药物的诱导效率很大程度上取决于细胞摄取量以及拟胚体的形成,所以在应用方面长期裹足不前[7,15]。而干细胞,抑或是癌细胞表面所具有的独特的外排泵可以使细胞免受药物或其他物质刺激,进而产生多药耐药能力等[3,16],因此,如何精准的实现药物呈递,促进细胞摄取,进而诱导其分化成为了近年来的研究热点[17]。
作为纳米载体,具有独特和可调的介孔结构,高负载能力和无与伦比的生物相容性的MSN已经被用作广泛的治疗剂的有效药物递送平台,用于治疗各种类型的疾病。在本研究中,MSNs通过溶胶-凝胶法制备,并优化已发表的程序[18]。没有荧光染料TRITC的MSN没有吸收峰。在合成中,TEOS用作二氧化硅前体,在表面活性剂的表面凝结,并在生成的胶束表面周围形成二氧化硅壁,使MSN带正电荷(+27 mV)和具有阳性电荷的TMSN电荷(+26.2 mV)。研究发现荧光修饰的介孔二氧化硅(TMSNs)可以成功地进入hESCs,并且以荧光修饰的介孔二氧化硅(TMSNs)为载体输送抗坏血酸(AA)可以诱导hESCs的分化。更为重要的是,通过荧光修饰的介孔二氧化硅(TMSNs)输送的AA可以有效地诱导hESCs分化为心肌细胞,上调心肌标记基因cTnI和FLK-1,同时下调多能性标志物OCT4及SOX2[19]。此外,相对于单独添加AA,由荧光修饰的介孔二氧化硅(TMSNs)输送的AA用于诱导人ES细胞分化成心肌细胞更有效,上述结果证实TMSN-AA可以靶向诱导hESCs的分化。
ERK1/2信号通路在早期胚胎发育过程中具有多种重要的生物学作用[20]。有报道称,在小鼠中植入前胚体中,FGF/ERK1/2突进参与内胚层发育[21],在脊椎动物中,实验表明,ERK1/2信号通路传导对神经外胚层和中内胚层分化[22-23]。在本研究中,TMSN-AA可以激活ERK1/2促进hESCs的心肌分化,加入其特异性抑制剂PD98059后,ERK1/2信号通路被抑制,hESCs心肌分化下降,进一步证实ERK1/2信号通路在hESCs心肌分化过程中的作用。除此之外,本研究还研究另一信号通路PI3K/Akt在hESCs心肌分化过程中作用,结果发现,TMSN-AA诱导期分化过程中,PI3K/Akt信号通路为参与这一过程,进一步使用抑制剂渥曼青霉素也证实了这一结论。笔者的研究结果表明,ERK1/2信号通路对TMSN-AA诱导hESCs心肌分化起着重要作用,而PI3K/Akt信号通路在这一过程中并未被激活。
综上所述,笔者成功构建TMSN-AA纳米载体,并证实其可以通过激活ERK1/2信号通路促进hESCs的心肌分化。为今后化学药物与纳米材料联合使用构建心肌药物递送系统提供的很好的参考与思路,为再生医学领域中进一步研究体外诱导细胞分化乃至于实现临床应用提供很好的研究基础。
