OSA患者的呼吸力学特征及血清肺泡表面活性物质水平与其胃食管反流事件的关系研究
2018-09-01阿孜古丽买合买提艾力根阿不都热依木米日古丽吾木哈斯木穆叶斯尔哈斯木
阿孜古丽·买合买提 艾力根·阿不都热依木 米日古丽·吾木哈斯木 穆叶斯尔·哈斯木
睡眠时不能维持上气道正常的开放性将导致阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA),其会引发机体的一系列病理生理变化及后果[1]。人肺泡表面活性物质(pulmonary surfactant,PS)是一种由磷脂质及表面活性蛋白(包括SP-A、SP-B、SP-C及SP-D)混合而形成的复杂混合物,主要集中于肺泡液体分子层表面和周围小气道粘膜表面,其主要作用是降低毛细支气管末端及肺泡表面张力的作用,使肺泡易于扩张,增加肺顺应性,阻止肺泡毛细血管中液体向肺泡内滤出[2]。动物模型及人体中如缺乏SPs,将会引起呼吸道阻力上升、肺顺应性下降及肺功能残气量变小,而这些改变在阻塞性睡眠呼吸暂停综合征(OSAS)患者中常见[3-4]。有研究提示OSAS患者在睡眠过程中OSA发生时胸腔负压和食管内负压增加,由此可能增加其胃食管反流(gastroesophageal reflux,GER)及咽喉反流(laryngopharyngeal Reflux,LPR)的事件,并造成表面活性物质的活性受损使咽部表面张力增加并造成塌陷性增加[5-6],甚至有可能胃酸随着呼吸进入下呼吸道和肺,破坏肺泡表面活性物质的活性或使其合成障碍等;由此,不仅引起咽部气道塌陷性增加,还能使的肺的顺应性下降,弹性回缩力增加和呼吸阻力的增加等病理生理变化。本研究对OSA患者的GER及LPR状况、呼吸系统力学特征和其血清肺泡表面活性物质蛋白水平进行评价,并作各因素之间的关联研究,探讨其变化的原因。
资料与方法
一、一般资料
2013年1月至2015年1月,前瞻性收集符合以下纳入标准的患者资料:因打鼾和/或怀疑有OSAS首次就诊于新疆维吾尔自治区人民医院并要求住院治疗且无肺部疾病史的患者。本研究共纳入97例经PSG诊断为OSA患者。其中男90例,女7例;年龄为(44.9±5.6)岁,体重指数为(28.6±4.2)kg/m2。排除标准:既往有心肺疾病史的患者,入院前1周使用过抑酸药物治疗的患者;有心肺疾病史或体检结果提示有心肺疾病、及因哮喘或慢性阻塞性肺部疾病(1 s用力呼气容积FEV1/用力肺活量FVC低于预测值的80%)而提示存在呼气气流受限的。有神经肌肉疾病的患者。有11例OSA患者因FEV1/FVC≤80%提示有阻塞性呼气障碍而被排除。20例鼾症患者缺乏完整资料,未纳入本次分析。
二、方法
1. 人体学指标的测定:身高、体重、腹围并计算体质量指数。
2. 血清肺泡表面活性物质的测定:完成多导睡眠监测(PSG)的患者于次日早晨空腹抽取静脉血待测,用ELISA法测定其血清肺泡表面活性物质蛋白-A,-B,-C,-D;检测操作同试剂盒说明(武汉基因美生物科技有限公司,人肺泡表面活性物质相关蛋白JYM0339Hu,JYM0331Hu,JYM0332Hu,JYM0331Hu)。
3. 多导睡眠检查(澳大利亚,Compumedics44通道睡眠监测仪):用多通道睡眠监测仪对打鼾者象进行睡眠监测。OSA患者的睡眠监测结果用呼吸暂停低通气指数(AHI)表示。
4. 常规功能和肺容量检测(Jaeger®;CareFusion,德国):采用德国耶格肺功能仪对受检者行呼吸气流-流速描记。取3次描记中最大气流-容积环并计算1 s用力呼气容积与用力肺活量的比值(FEV1/FVC)。被检查若存在FEV1/FVC小于预计值的80%,则免测定肺容量。用体积箱行肺容积测定。受试者保持平静呼吸测定功能残气位时的气量,同时对其补呼气量、深吸气量、肺活量进行测定。
5. 脉冲振荡系统肺功能测定(Jaeger®;CareFusion,德国):用MasterScreen IOS脉冲振荡肺功能仪进行测定,被检者坐直头保持正中水平位嘴唇含住口器,并上鼻夹。在安静状态下保持自然呼吸,检测者确认稳定的自然呼吸气流信号后,测定呼吸系统总阻抗(Zrs);从5 Hz到35 Hz的呼吸系统阻力(Rrs)用Rrs5~Rrs35表示,相隔振荡频率为5 Hz;从5 Hz到35 Hz的呼吸系统电抗(Xrs)用Xrs5~Xrs35表示。受检者出现漏气及吞咽动作时进行重新测量。
6. MICC联合pH监测(Given Imaging,以色列):用多通道腔内气阻系统进行24 h食道多点的PH值,阻抗感受器分别位于上食道括约肌(UES)下方5、2 cm和下食道括约肌(LES)上方3、5、7、9 cm处,酸碱度感受器位于LES上方5 cm,UES上方2 cm。数据分析与采集包括:反流事件次数和持续的时间,当阻抗感受器记录到USE下方5 cm处有的反流事件发生为食道近端反流。根据美国胃肠学会胃食管反流诊断指南和Johnson的标准[8]:胃食管反流阳性标准定义为DeMeester≥14.7分。
三、统计学方法
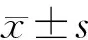
结 果
一、60例鼾症患者的多导睡眠、血清肺泡表面活性蛋白及基线资料
60例男性鼾症患者完成了研究所需的检查内容。以鼾症患者的AHI≥15次/h作为诊断OSAS的标准[7],将60例患者分组为OSAS组与非OSAS组,2组之间其体重、体质量指数、腹围、及血清肺泡表面活性蛋白-B比较,差异有统计学意义(P<0.05),见表1。
表1 60例男性鼾症临床特征和血清肺泡表面活性蛋白和多导睡眠监测结果
表2 60例鼾症患者呼吸系统力学特性测定及组间的比较
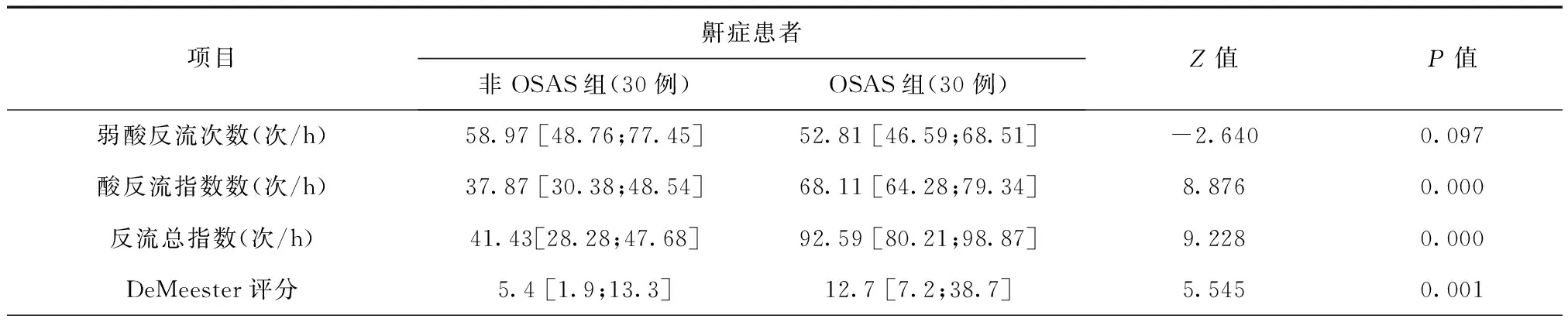
表3 60例鼾症MICC联合pH监测参数和DeMeester评分的组间比较

表4 60例鼾症患者的夜间多导睡眠监测参数与其血清SPs水平的相关性
注:1表示P<0.05,差异具有统计学意义。
二、60例鼾症患者的脉冲震荡呼吸力学特性
呼吸力学特征在2组间的比较,呼吸总阻抗Zrs5和各震荡频率处的呼吸阻力Rrs值OSAS组均高于非OSAS组,而5~20 Hz的呼吸电抗Xrs较低于非OSAS患者,见表2
三、60例OSA患者24 h MICC联合pH监测结果和DeMeester评分
非OSAS与OSAS组2组食管近端反流总指数分别为41.43[极小值;极大值=28.28;47.68]次、92.59 [80.21;98.87]次,两组比较差异有统计学意义(P<0.01)。OSAS组中酸反流指数为68.11[64.28;79.34]次,较非鼾症患者有较多的酸反流次数且有统计学意义的差义(P<0.01)。
四、相关性分析
1. 鼾症患者阻塞性睡眠呼吸暂停严重程度与其血清肺泡表面活性蛋白水平的相关性
如表4所示,随着鼾症患者OSA严重程度的增加,其血清SP-B和SP-D水平下降。
2. 鼾症患者OSA的严重程度与胃食管反流状况的相关性
表5显示,随着鼾症患者其阻塞睡眠呼吸暂停严重程度的增加,以酸性物质为主的胃食管反流及其近端反流事件增多。
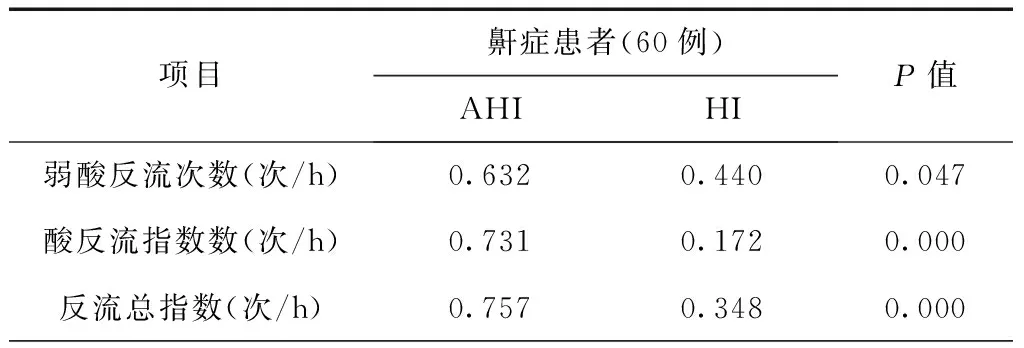
表5 OSA的严重程度与食管近端酸返指数的相关关系
3. 鼾症患者呼吸力学特征与胃食管反流状况、肺泡表面活性蛋白-B水平的关系
鼾症患者5~15 Hz震荡频率的呼吸阻力及呼吸阻抗Zrs5与血清肺泡表面活性蛋白-B不存在相关性,但与总反流指数、DeMeester评分存在正的相关性。5 Hz荡频率的呼吸电抗(Xrs)与血清SP-B水平负相关(R=0.538,P=0.021)并与反流总指数、DeMeester评分也显示呈负相关。
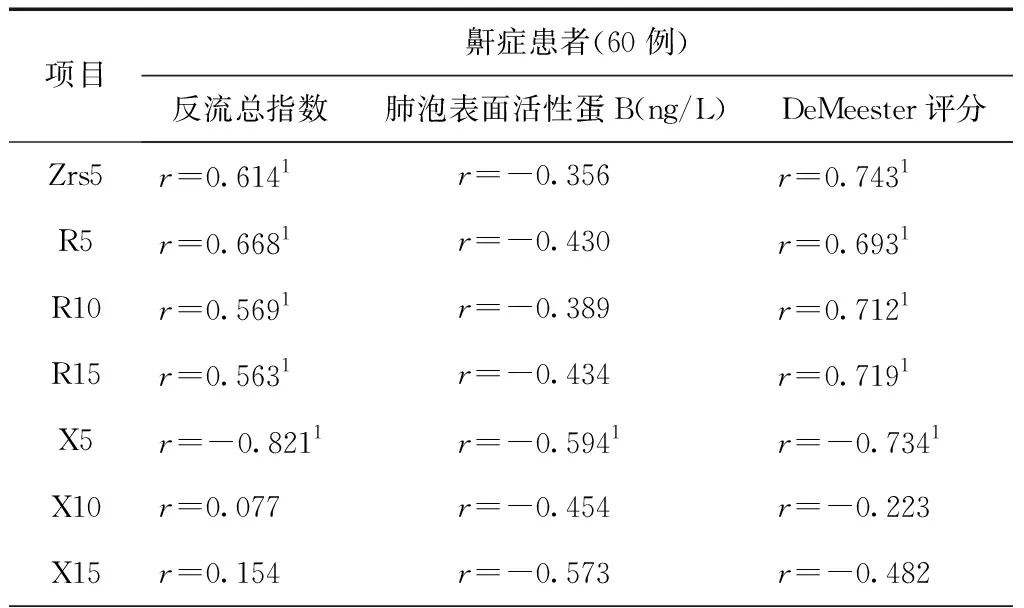
表6 鼾症患者呼吸系统力学特征与血清SP-B水平及与胃食管反流的关系
注:1表示P<0.05,差异具有统计学意义。
讨 论
此次研究表明,鼾症患者随着阻塞性睡眠呼吸暂停的加重,呼吸系统外周气道阻力增加,在IOS上的表现为5、10、15 Hz震荡频率的呼吸阻力增高及Zrs5增加,并有呼吸电抗(Xrs5)负值增大,其可能于呼吸系统顺应性下降有关。鼾症患者特有的呼吸力学特性的变化,与其胃食管及食管近端酸反流相关,且与其血清肺泡表面活性蛋白-B水平降低亦存在一定的相关性。
本研究显示,反映鼾症严重程度的AHI与胃食管病理性酸返流、食管近端酸反流事件高度正相关。推测当OSAS患者出现OSA呼吸时胸腔负压呼气末吸气初增大,连带食管内负压显著下降,导致食道括约肌跨壁压增大,该负压可能引起胃内容物反流入食道引起胃食管暴露于酸性环境,并导致其DeMeester评分增加,而且夜间频繁发生的OSA导致食管内外压力差的频繁巨大波动,及其引发醒觉和吞咽动作增加,可能使的食管括约肌的一过性松弛,食管上端黏膜不断暴露于酸环境并造成食管黏膜损害,形成恶性循环,加重OSA的严重程度,反过来加剧胃食管及咽喉返流事件的发生[6]。以往研究亦发现卧位时的GER事件可占24 h总GER事件的69.4%,由此研究者认为重度鼾症患者高发胃食管返流的机制可能在于,OSAS患者由于上气道阻塞性呼吸,胸腔内负压波动增大诱发或加重GER,由其夜间卧位睡眠是易发生GER。还有研究报道最长GER事件常发生在睡眠呼吸暂停最频繁出现时。上述证据表明OSAS与胃食管返流的关系密切[5-6]。既往研究指出,OSAS患者的OSA呼吸是夜间胃食管反流的主要,他们并认为OSA导致的反复醒觉、吞咽动作与胃食管反流事件的发生关系密切。这可能是胃食管反流时食管近端的酸性物质可能极易吸入到呼吸道引起气道损害及咽喉部的充血、水肿肥厚;吸入气道的酸性微粒可引起气道黏膜反因或支气管壁迷走性收缩,加重外周气道的阻塞,上述病理过程可能是加重夜间OSA的一个因素[9-11]。
本研究推断鼾症与GER存在高度的相关性,可能原因在于:胸腔负压波动,即食道病理性负压波动。如研究者对OSAS患者进行PSG的同时行食管测酸测压发现,胸腔负压和食管压力负压增大时,胃内容物反流事件占总事件的76%,由此该研究认为,下食管括约肌压力的下降可能是引发胃食管反流的一个必要条件;胃内容物进入食管的因素包括,下食管括约肌跨压差增大并超越其张力;而OSAS患者夜间OSA发生时胸腔负压增高,可直接引起导致食管负压增高[12]。有研究者用CPAP对鼾症并GERD患者进行治疗时发现:该治疗降低胃食管返流事件,他认为施加于鼾症患者的CPAP在呼气末的正压可对抗胸腔负压,并维持呼气末的肺容积不至于过低,由此食管内的压力主动增加或不至于形成负压,引起食道括约肌反射性的收缩并阻止胃内容物反流的可能机制起到了的抑酸治疗的效应[9]。
近期有研究提出了OSAS与GERD及LPR的恶性循环假说。假说提出上气道阻塞性呼吸时产生的努力吸气道,引起了大的胸腔负压并超出食管下括约肌的正常压力,可使胃内容物经食道反流入喉咽,产生炎症反应;可能通过一下途径导致OSAS的发展:当远端食管的迷走神经受到胃内容物的刺激,通过迷走神经反射弧可引发支气管痉挛、收缩,加重气道阻塞而引起鼾症的加重。其次反流到食道近端的酸性物质及胃蛋白酶类物,可刺激咽喉黏膜产生炎症反应,口咽部黏膜水肿肥厚,吸入到气道的酸性气溶性物质可引起气道黏膜反应,导致气道痉挛,如此同作用形成上气道阻塞因素。我们研究发现鼾症患者呼吸系统力学特性的变化与胃食管反流及食管近端酸返流显著相关验证了该假说。在此基础上,可以进一步提出鼾症患者的OSA呼吸可能是其呼吸系统力学特性发生的变化一个因素:OSA呼吸导致胸腔负压波动增大,该负压可引发胃食管及咽喉返流,甚至有可能胃酸随着呼吸进入肺,破坏肺泡表面活性物质的活性或使其合成障碍等[6]。由此,不仅引起咽部气道塌陷性增加,还能使的呼吸力学特征发生改变如本研究结果所示。
研究已表明,当肺泡表面活性蛋白减少时,会增加肺泡表面张力,直接影响肺的扩张,使肺容积下降,导致吸气阻力增高及相应的肺顺应性下,肺泡表面活性蛋白缺乏的呼吸系统病理改变的呼吸力学特征与OSA患者呼吸系统力学变化有一致性。研究证实,OSA患者上气道给予滴注人工合成的SP,可以降低咽腔内的表面张力,明显降低其AHI可下降至用SP前的30%[13]。由于肺泡内SPs可以从肺泡向血液中弥散,在病理状态下,呼吸膜状态的改变影响SPs进入血液循环中的浓度,因此,SPs的浓度已经成为多种肺脏疾病肺损伤的生物学标志物[10]。
我们发现OSA患者呼吸阻力增加,与呼吸系统弹性特征肺的弹性阻力增加有关,又与胃食管反流事件有相关性。OSA患者的血清SP-B水平下降,这与OSAS可能存在早期肺损伤有关。OSA患者由于高阻力呼吸、间断性觉醒的变化可导致胸腔压力大的波动,其可能造成的应力性肺损伤,最终气道结构和功能的发生改变,如气道内炎症和气管壁的重构[6,11]。加之,胃食管的酸性物质进入咽喉气道,甚至可能随OSA患者努力呼吸,进入下气道和外周气道,从而使肺泡通透性增加,肺泡表面活性蛋白可能由此进入血液循环。虽然,当前研究已较为清楚和明确了SP研究,但SP的分泌合成及调控及其复杂有待于大量的基础研究。因此,本研究发现的鼾症患者血清SP-B水平下降且与其阻塞性呼吸的严重程度负相关,只能提示OSAS可能存在早期肺损伤,而这一点也体现在了脉冲震荡所测定的呼吸系统力学特征的变化上。
综上,OSAS患者随着其阻塞性睡眠呼吸暂停的加重,呼吸系统外周气道阻力增加,在IOS上的表现为5、10、15 Hz震荡频率的呼吸阻力增高及Zrs5增加,并有呼吸电抗(Xrs5)负值增大,其可能与呼吸系统顺应性下降有关。鼾症患者上述呼吸力学特性的变化与胃食管及食管近端酸反流相关,且与血清肺泡表面活性蛋白-B水平降低亦存在一定的相关性。
