饮食诱导小鼠肥胖模型中胃食管黏膜的变化研究
2018-09-01买买提依斯热依力艾克拜尔艾力吾布力卡斯木吾拉木伊比提哈尔买买提艾力巴突尔艾克木王俭艾热夏提吐洪江曹正一阿布拉江米吉提赵新胜克力木阿不都热依木
买买提·依斯热依力 艾克拜尔·艾力 吾布力卡斯木·吾拉木 伊比提哈尔·买买提艾力 巴突尔·艾克木 王俭 艾热夏提·吐洪江 曹正一 阿布拉江·米吉提 赵新胜 克力木·阿不都热依木
随着人类饮食结构的变化,高能量值食物的摄取量不断提高,由饮食结构不合理引起的肥胖症逐渐引起了人们的关注。在消化系统良性疾病中,很多疾病的发生与肥胖有关,其中常见的包括胃食管反流病(gastroesophageal reflux disease,GERD)、非酒精性脂肪肝、胆囊结石及胰腺炎等[1]。同时肥胖症的患病率在全球范围内不断增长,已成为了一项世界公共健康问题。GERD同样作为常见的消化道良性疾病,其与饮食习惯间的相关性不可忽视。近年国内外许多研究者通过饮食诱导肥胖(diet-induced obesity,DIO)动物模型来探讨肥胖和相关代谢性疾病的发病机制[2-3]。然而该模型在上述领域中被广泛应用,使得模型的成功建立已基本成熟,但其在GERD研究中的应用很少见。因此本研究旨在探讨肥胖与GERD的相关性及DIO动物模型在该研究中的价值,以为今后肥胖与GERD相关性研究提供实验基础。
资料与方法
一、一般资料
1. 实验动物及分组:SPF级雄昆明小鼠20只,8周龄,购于新疆实验动物研究中心,许可证号:SCXK(新)2011-0001;饲养于新疆维吾尔自治区维吾尔医药研究所IVC系统动物中心。研究员对20只小鼠进行编号及体质量测量,并排除体重变异较大的4只。采用Microsoft Office Excel软件随机分2组(各8只),即饮食诱导肥胖组(diet-induced obesity,DIO)组和正常对照(normal control,NC)组。小鼠以4只/笼饲养在自由进食水的鼠笼内,每日给予12 h昼夜循环,光照均始于北京时间8∶30分,止于20∶30分。
2. 实验器材:电子天平(EL-5.2K),常州市天之平仪器设备有限公司;低温高速离心机(1-14K),德国Sigma公司;抗凝采血管,美国BD公司;光学显微镜(Eclipse E200),日本尼康公司;三诺安稳血糖仪及血糖试条,三诺生物传感股份有限公司;D-葡萄糖,德国Sigma公司;HE染色相关试剂,北京中杉金桥生物技术有限公司。
二、方法
1. DIO模型的建立:正式实验前,将所有小鼠在相同环境中标准饲料适应性喂养1周。9周龄时开始建立模型,DIO组小鼠给予高脂饲料(HFD,Lot:11111401,60%KJ%fat,D12492,Research Diets Inc.21.92 KJ/g),NC组给予标准饲料(STD,Lot:08101506,10%KJ%fat,D12450B,Research Diets Inc.16.11 KJ/g),饲料成分见表1,其余处理均相同。实验过程中小鼠自由饮水摄食,持续8周。每周3上午10∶00(北京时间)测量体质量与饮食量。8周的饲养结束后,DIO组小鼠中体质量超过NC组最高体质量者可被视为肥胖小鼠。
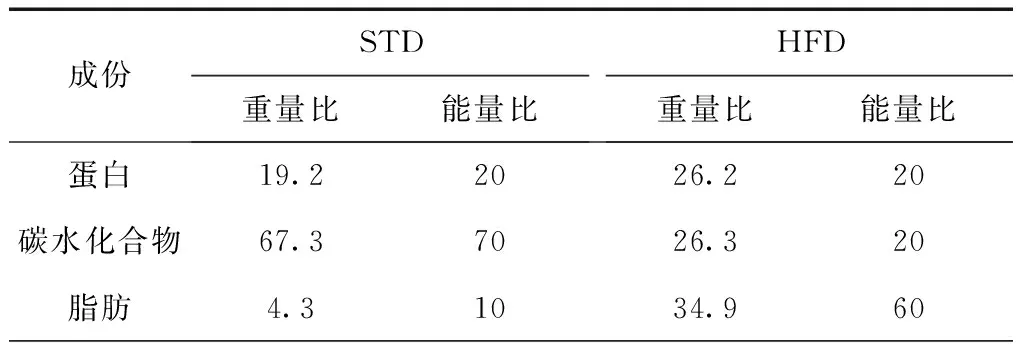
表1 HFD与STD成份及能量值(%)
注:STD为标准饲料;HFD为高脂饲料
2. 取材与标本处理:实验第8周最后1天下午17∶00(北京时间)开始对所有小鼠禁食,于次日11∶00(北京时间)进行取材。将麻醉的动物以平卧位固定,从腹部正中至剑突取3 cm切口,下腔静脉取血注入于肝素抗凝采血管中。肉眼观察皮下、腹股沟、肠系膜及各脏器周围脂肪,完整游离取材并称重;此外在距离胃食管交界处0.3和1.5 cm处剪断取下胃食管组织,置于4%中性甲醛固定。
3. 血生化指标的测定:装入采血管的血样品以3 500 rpm/min的速度低温离心5 min,取上层血清,-80 ℃保存,用于后续生化指标测定。采用ELISA法检测甘油三酯,总胆固醇,低密度脂蛋白含量。实验过程及测量指标浓度的计算严格按试剂盒说明书进行。
4. 口服葡萄糖耐量试验(OGTT)与胰岛素耐受试验(ITT):参照Uchida[4]和Yisireyili等[5]研究者的方法进行实验,步骤如下:实验第8周最后1 d下午17∶00(北京时间)开始对所有小鼠禁食,于次日11∶00(北京时间取材前进行试验。GTT:试验开始前测血糖浓度,然后腹腔内以2 g/kg的量注射D-葡萄糖,并在注射后30、60、90、120 min分别监测血糖;ITT实验:GTT试验结束后向小鼠腹腔内注射胰岛素0.75 U/kg,其后分别在15、30、45、60 min分别检测血糖并记录。参照王科等[6]的实验方法计算GTT、ITT曲线下面积(area under curve,AUC)。
5. 小鼠组织病理学检查:4%中性甲醛固定24 h后水洗、脱水、透明、浸蜡、包埋,制成5 μm厚切片行HE染色。切片质量及各组织形态学改变均由富有经验的病理科医师诊断。
三、统计学方法
结 果
一、NC组与DIO组小鼠体型、腹腔内脂肪分布、体重、进食量及血糖的比较
DIO组小鼠在体型上明显比NC组小鼠体型大,并且NC组小鼠被毛顺滑,而DIO组小鼠的被毛普遍有出油的现象(见图1A);经解剖腹腔2组进行比较发现,DIO组小鼠肠系膜、腹股沟及腹膜后等部位出现明显的脂肪堆积(见图1B,C,D)。体重为反应小鼠机体整体状况的基本指标。实验开始前DIO组小鼠体质量为(22.31±0.52)g,NC组小鼠体质量为(22.60±0.31)g,2组差异无统计学意义(P>0.05);8周的实验过程中,DIO组小鼠平均每日进食量为(2.92±0.41)g,NC组为(2.68±0.30)g,2组差异无统计学意义(P>0.05);实验结束后DIO组小鼠体质量增加量为(23.16±2.82)g,NC组小鼠体质量增加量为(13.40±1.31)g,2组差异具有统计学意义(P<0.05),见表2。
二、NC组与DIO组小鼠血生化指标的比较
DIO组小鼠血浆总胆固醇,低密度脂蛋白水平明显高于对照组,差异有统计学意义(P<0.05),甘油三酯水平略高于对照组,但差异无统计学意义(P>0.05),见表3。
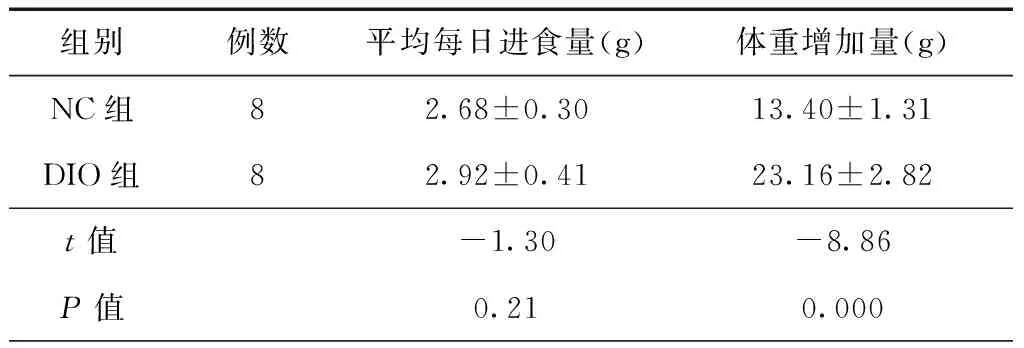
组别例数平均每日进食量(g)体重增加量(g)NC组82.68±0.3013.40±1.31DIO组82.92±0.4123.16±2.82t值-1.30-8.86P值0.210.000
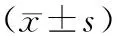
表3 血生化指标比较
三、NC组与DIO组小鼠糖耐量和胰岛素耐受的变化
GTT结果显示,试验开始之初NC组和DIO组小鼠血糖上升明显,DIO组小鼠血糖2 h内不能恢复之前浓度且维持在一个比较高的水平,而NC组2 h内能恢复到正常范围内的浓度,经过计算AUC得知,DIO组小鼠与NC组小鼠在整体水平上有差异(P<0.05),由此可见,DIO组小鼠已经出现了糖耐量异常的现象。ITT结果显示,NC组小鼠血糖浓度有一次较大幅度的下降,2 h内能够恢复之前的浓度;而CRS组小鼠的血糖只是略有下降,2 h不能恢复到原来的浓度。同样经过计算曲线下面积得知,DIO组小鼠与NC组小鼠在整体水平上有差异(P<0.05);说明胰岛素已经不能充分发挥其正常的生理功能,可以初步估计机体已经出现了胰岛素抵抗的现象,见图2。
四、NC组与DIO组小鼠胃、食管组织学及其周围脂肪的变化
经解剖发现DIO组小鼠除了腹腔内各部位脂肪严重堆积,在胃食管交界处周围同样出现了明显的脂肪堆积;HE染色及镜下观察显示,在DIO组小鼠食管胃组织可见充血,炎症细胞(单核细胞、巨噬细胞)浸润,但NC组未见明显异常,见图3。
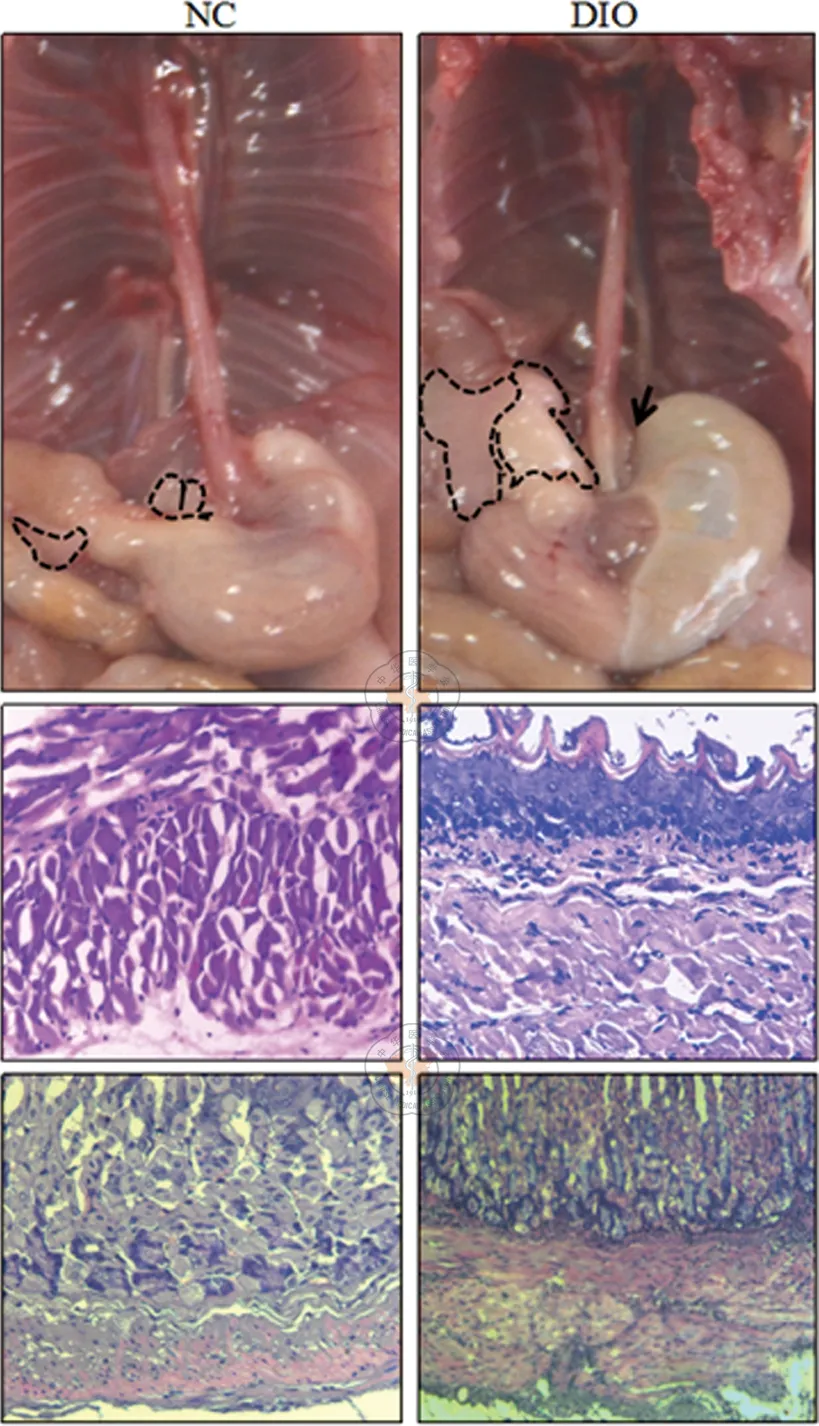
图3 2组小鼠胃食管外观及组织病理学变化
讨 论
随着经济的发展,人们生活水平的提高,肥胖及相关消化道疾病人群的数量近年来呈现一个迅速上升的趋势,对人类健康带来了不同程度的危害。其中肥胖与GERD的相关性研究引起了越来越多的研究者的注意。GERD作为影响人类健康的消化道良性疾病之一,认为肥胖是其发生发展的重要因素[1]。全世界约10%~40%的成年人饱受着胃食管反流之痛[7],同样约有30%的人处于超重或肥胖状态并呈逐年上升趋势[8]。多项横断面流行病学研究报道称,肥胖人群中GERD的发病率高于非肥胖人群[9-10]。El-Serag等[11]对453名医院职工进行调查发现,26%的人每周都会出现烧心或反流症状;其中196名职工愿意接受进一步调查并进行了胃镜检查,结果显示,不同BMI组,即BMI<25、25~30和>30 kg/cm2,存在GERD症状者所占的比例分别是23.3%、26.7%、50%,而糜烂性食管炎者所占的比例分别为12.5%、29.8%、26.9%。此外在其他研究中发现,增重>5 kg的人出现GERD症状的危险性为正常人的2.7倍[12]。故,在上述研究的基础上,本课题组通过建立DIO动物模型,观察肥胖所引起食管、胃的变化。
建模过程中,长期进食高脂饲料的模型组小鼠,体质量明显高于标准饲料喂养组,其中75%的小鼠发育为DIO。整个造模期间,模型组小鼠体质量呈缓慢增长,虽然饮食诱导的肥胖小鼠动物模型的建立耗时长达2个月,但此模型较为真实地模拟了人类肥胖症患者的病因和体重增长过程,即由长期高热量饮食和缺乏运动的生活状态所致。此肥胖模型动物伴有糖耐量异常、胰岛素抵抗和脂质代谢紊乱,符合人类肥胖症患者所具有的血液生化指标的变化,所以此模型可用于评价肥胖所诱导胃食管反流所引起的病理变化。对于该实验中肥胖引起的胃食管的变化,我们发现DIO组小鼠腹腔内各部位脂肪堆积严重,更重要的是在胃食管交界处周围同样出现了明显的脂肪堆积,这一变化初步验证了“肥胖是引起胃食管反流的病理基础”之一。进一步通过HE染色观察2组小鼠食管、胃组织形态学变化时发现,食管及胃组织上皮细胞增厚、黏膜层各类炎症细胞的浸润等变化。因为,在胃食管炎症进展和糜烂形成时,通常在镜下可见沿食管长轴有条状糜烂病变,也可见病变区域上皮坏死脱落,形成浅表性上皮缺损,其上由炎性纤维素膜覆盖,其下可见中性粒细胞及淋巴细胞,浆细胞浸润,炎症改变。因此,DIO小鼠胃食管组织出现的组织学变化,相对接近肥胖导致胃食管反流的一个重要的病理变化。
综上所述,目前关于肥胖所引起的GERD发病原因和机制尚不清楚。临床研究往往因不易获取伦理批准或患者知情同意、无法及时全面观察机体病理生理变化及各层组织形态学变化等因素而受到限制,而动物实验模型的建立解决了上述问题。然而DIO小鼠模型具有稳定性及重复性较好,操作简单、费用低等优势,并且整个造模期间,没有动物死亡。因此,本实验可以为后期进一步研究肥胖所引起GERD的机制提供较好的实验基础。
