上调Klotho基因表达对心肌梗死大鼠心功能及心肌纤维化的影响
2018-09-01张瑞萍刘福垒
张瑞萍,刘福垒
(1.洛阳市第一人民医院检验科,河南 洛阳 471002;2.泰安市中心医院,山东 泰安 271000)
心肌重构作为心脏在多种心血管疾病后的一种代偿性病理过程,是导致患者心力衰竭甚至死亡的重要因素[1],而心肌纤维化在心肌重构中扮演重要角色[2]。因此,如何有效防治心肌纤维化已成为心内科研究重点。Klotho作为一种抗衰老基因,在多种生理病理过程中扮演重要角色,Klotho表达缺失会导致一系列与衰老类似的功能紊乱,如骨质疏松、动脉粥样硬化、炎症、免疫功能异常、皮肤衰老等[3]。Corsetti等[4]研究指出,Klotho基因及表达产物与心血管疾病及其各种危险因素密切相关。田倪妮等[5]研究也认为,慢性心力衰竭患者心肌组织中Klotho基因表达减少。本研究通过构建大鼠心肌梗死模型,并转导外源性腺病毒重组Klotho基因,观察其对心肌梗死大鼠心功能及心肌纤维化的影响,以期为心肌梗死引起心肌纤维化的相关机制研究提供基础资料。
1 资料与方法
1.1资料
1.1.1实验动物 SPF级雄性SD大鼠60只,体质量(210±10)g,购自河南省实验动物中心,合格证号:SCXK(豫)2010-0002。饲养于标准环境下,自由饮水、进食,实验前预适应环境至少7 d。利用随机数字表法将大鼠分为假手术组、模型组、Klotho转染组和空白质粒组,每组15只。本研究起止时间为2016年12月至2017年1月,符合一般实验动物伦理学要求。
1.1.2主要试剂和设备 慢病毒载体、pDC316-T载体和pDC316-mCMV-EGFP载体质粒(美国Stratagene公司),总RNA提取试剂盒(Trizol法,美国Invitrogen公司),逆转录、PCR试剂盒、加A尾试剂盒、EcoR Ⅰ和XhoⅠ限制酶(日本TaKaRa公司),2,3,5-三苯基氯化四氮唑(TTC)(上海联硕生物科技有限公司), Klotho、转化生长因子-β1(TGF-β1)、结缔组织生长因子(CTGF)及内参引物序列(上海吉玛制药技术有限公司),Klotho兔多克隆抗体和兔抗大鼠TGF-β 多克隆抗体(美国Abcam公司),兔抗大鼠CTGF 多克隆抗体(美国 SantaCruz公司),免疫组织化学试剂盒(北京中衫金桥生物技术有限公司),Masson三色染色试剂盒(福州迈新生物技术公司),生物机能实验系统(北京东西仪科技有限公司),小动物呼吸机(上海玉研科学仪器有限公司),实时荧光定量PCR仪和凝胶成像系统(美国Bio-rad公司)。
1.2方法
1.2.1Klotho基因重组腺病毒载体构建 利用总RNA提取试剂盒(Trizol法)对大鼠新鲜肾脏组织中总RNA进行提取,根据GeneBank中大鼠Klotho基因序列(收录号:NM_021748.1)设计Klotho基因特异性引物:上游:5′-GGGAAGCTTGCTGCGCGGGAG-CCAGGCTCCGGGGC-3′,下游:5′-GGCCTCGAGTG-CTAATATATGCTGGCTGGAGTTGG-3′。利用逆转录试剂盒以Klotho基因特异性引物下游为模板逆转录为cDNA。以cDNA为模板,对Klotho基因序列进行RT-PCR。利用加A尾试剂盒对扩增产物进行加A尾后,与pDC316-T载体连接,利用EcoR Ⅰ 和Xho Ⅰ 限制酶进行双酶切,并进行基因测序鉴定。提取测序正确的质粒,利用EcoR Ⅰ和XhoⅠ限制酶进行双酶切后,克隆至pDC316-mCMV-EGFP载体质粒,在与慢病毒载体混合、同源重组、酶切后,制备携带Klotho基因的重组质粒。携带Klotho基因的重组质粒经包装、扩增、纯化、滴度测定均由上海闪晶分子生物科技有限公司完成。病毒半数组织细胞感染量(TCID50)法测定出病毒滴度为1.5×1010TU·mL-1。
1.2.2大鼠急性心肌梗死模型制备及处理 参考文献[6]中结扎左冠状动脉前降支的方法制备大鼠急性心肌梗死模型:利用腹腔注射戊巴比妥钠的方法将大鼠麻醉后,利用生物机能实验系统对大鼠进行检测。气管插管后连接小动物呼吸机,开胸后,利用撑胸器使胸腔中心脏充分暴露,利用8-0无创伤丝线合针于肺动脉圆锥和主动脉交界处以下约2 mm穿过左冠状动脉前降支,并进行结扎,建模成功标志:以结扎线以下心肌颜色变苍白、波动减缩、心电图示ST段抬高明显为结扎成功。假手术组仅将8-0无创伤丝线穿过左冠状动脉前降支而不结扎。10 min后,Klotho转染组取200 μL的携带Klotho基因的质粒,分别于左心室游离壁上、下、左、右四个部位进行局部注射,模型组和空白质粒组则分别将等量的生理盐水和空白质粒按照Klotho转染组的方法进行局部注射。常规胸腔滴注利多卡因以防止室性心动过速、心室颤动的发生,将胸腔积液吸尽后,断开呼吸机,负压逐层关胸。待大鼠苏醒后,拔除气管插管,同组同笼喂养。术后3 d连续腹腔注射青霉素以预防感染。术后存活大鼠51只,假手术组14只、模型组12只、Klotho转染组13只和空白质粒组12只。
1.2.3大鼠心功能检测 各组14 d后,称重,利用腹腔注射戊巴比妥钠的方法将大鼠麻醉后,利用超声心动图对大鼠心功能进行检测,检测指标包括左心室射血分数(LVEF)、左心室收缩末期内径(LVDs)、左心室舒张末期内径(LVDd)和短轴缩短率(FS)。
1.2.4各组大鼠心肌梗死面积检测 各组大鼠完成心功能检测后,处死,打开胸腔,取出心脏,用生理盐水反复冲洗,将残留血液洗净,去除表面结缔组织,放入-80 ℃冰箱冻存15 min,取出后沿心脏纵轴方向从心底向心尖对左心室切片,厚度约2 mm,置于新配置的TTC溶液中,避光恒温染色30 min,取出后,PBS冲洗3次,用4%多聚甲醛固定30~40 min,自然光下拍照,梗死区呈灰白色。利用Image-Pro Plus 6.0图像分析软件对各组大鼠心肌梗死面积占全部心肌面积比例进行分析。
1.2.5各组大鼠心肌组织病理学和纤维化检测 取各组心尖部心肌组织,PBS洗涤后,用4%多聚甲醛过夜固定,石蜡包埋,切片,利用免疫组织化学染色试剂盒检测心肌组织病理学变化,利用Masson三色染色试剂盒对间质胶原纤维染色,利用Image-Pro Plus 6.0图像分析软件对间质纤维化面积占组织切片总面积的比值进行分析。
1.2.6利用实时荧光定量PCR检测各组大鼠心肌组织中Klotho、TGF-β1和CTGF基因表达 取各组大鼠心尖部心肌组织,研磨后加入细胞裂解液,用总RNA提取试剂盒提取组织中总RNA,利用紫外分光光度计检测总RNA纯度,取A260/A280≥1.80作为合格样品。利用逆转录试剂盒进行逆转录为模板单链cDNA,利用PCR试剂盒进行PCR。引物序列分别为:Klotho引物(104 bp):上游:5′-GCTCTCAAA-GCCCACATACTG-3′,下游:5′-GCAGCATAACGATA-GAGGCC-3′;TGF-β1引物(146 bp):上游:5′-GGATACCAACTATTGCTTCAGCTCC-3′,下游:5′-AGGCT-CCAAATATAGGGGCAGGGTC-3′;CTGF引物(232 bp):上游:5′-GCAGCGGTGAGTCCTTCC-3′,下游:5′-AATGTGTCTTCCAGTCGGTAGG-3′;β-actin引物(205 bp):上游: 5′-TGACGTGGACATCCGCAAAG-3′,下游:5′-CTGGAAGGTGGACAGCGAGG-3′。PCR反应条件:95 ℃ 1 min,92 ℃ 30 s,60 ℃ 30 s,74 ℃ 30 s,连续进行40次循环,每个样品均设置3个平行反应复孔。用2-△△Ct法分析各组大鼠心肌组织中Klotho、TGF-β1和CTGF基因相对表达量。
1.2.7利用Western blot法检测各组大鼠心肌组织中Klotho、TGF-β1和CTGF蛋白表达 取各组大鼠心尖部心肌组织,研磨后加入细胞裂解液,用总蛋白提取试剂盒对组织中总蛋白进行提取,用BCA总蛋白检测试剂盒对获得的总蛋白进行检测。取20 μg总蛋白,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,电转移至聚偏氟乙烯膜,用5%脱脂奶粉室温下封闭60 min,将一抗Klotho兔多克隆抗体、兔抗大鼠TGF-β和CTGF 多克隆抗体(稀释比例分别为1 ∶800、1 ∶1 200和1 ∶600)加入,过夜孵育,用TBST冲洗3次,加入二抗,37 ℃条件下孵育4 h,用TBST冲洗3次,加入辣根过氧化物酶底物,暗室下反应30 min。拍照,利用图像分析软件按半定量法对各组大鼠心肌组织中Klotho、TGF-β1和CTGF蛋白相对表达量进行分析。
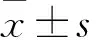
2 结果
2.1各组大鼠心功能比较与假手术组相比,模型组、Klotho转染组和空白质粒组大鼠LVEF和FS均降低,而LVDs和LVDd均升高,均差异有统计学意义(P<0.05);与模型组和空白质粒组相比,Klotho转染组大鼠LVEF和FS均升高,而LVDs和LVDd均降低,均差异有统计学意义(P<0.05),详见表1。
2.2各组大鼠心肌梗死面积比较TTC染色结果显示,假手术组大鼠心肌梗死面积为0.00%,模型组和空白质粒组大鼠心肌梗死面积分别为(39.09±4.66)%和(36.07±3.25)%,两组均高于Klotho转染组的(24.49±4.30)%,均差异有统计学意义(F=44.195,P<0.001),详见图1。
2.3各组大鼠心肌组织病理学和纤维化比较HE染色结果显示,假手术组大鼠心肌组织结构完整,可见细胞核和细胞质,以及细胞间连接,纤维整齐排列;模型组和空白质粒组大鼠心肌组织结构不完整,纤维排列稀疏杂乱,肌纤维出现断裂、间质水肿,有大量炎症细胞浸润;Klotho转染组大鼠心肌病理学改变较模型组和空白质粒组减轻,详见图2。
Masson染色结果显示,假手术组大鼠心肌细胞规整排列,散在分布有少量的蓝色胶原纤维;模型组和空白质粒组大鼠心肌细胞排列杂乱,期间可见大量的蓝色胶原纤维;Klotho转染组大鼠纤维化改变较模型组和空白质粒组减轻,详见图3。假手术组间质纤维化面积为(4.75±0.35)%,模型组和空白质粒组间质纤维化面积均增加,分别为(38.82±2.38)%和(38.50±2.91)%,与模型组和空白质粒组相比,Klotho转染组则减少,为(21.88±2.38)%,均差异有统计学意义(F=719.697,P<0.001)。
2.4各组大鼠心肌组织中Klotho、TGF-β1和CTGF基因表达比较与假手术组相比,模型组、空白质粒组和Klotho转染组大鼠心肌组织中Klotho mRNA相对表达量均降低,而TGF-β1、CTGF mRNA相对表达量均升高,均差异有统计学意义(P<0.05);与模型组和空白质粒组相比,Klotho转染组大鼠心肌组织中Klotho mRNA相对表达量升高,而TGF-β1、CTGF mRNA相对表达量均降低,均差异有统计学意义(P<0.05),详见表2。
2.5各组大鼠心肌组织中Klotho、TGF-β1和CTGF蛋白表达比较与假手术组相比,模型组、空白质粒组和Klotho转染组大鼠心肌组织中Klotho蛋白相对表达量均降低,而TGF-β1、CTGF蛋白相对表达量均升高,均差异有统计学意义(P<0.05);与模型组和空白质粒组相比,Klotho转染组大鼠心肌组织中Klotho蛋白相对表达量升高,而TGF-β1、CTGF蛋白相对表达量均降低,均差异有统计学意义(P<0.05),详见表3和图4。

表1 各组大鼠心功能比较
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与空白质粒组相比,cP<0.05

表2 各组大鼠心肌组织中Klotho、TGF-β1和CTGF基因表达比较
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与空白质粒组相比,cP<0.05

表3 各组大鼠心肌组织中Klotho、TGF-β1和CTGF蛋白表达比较
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与空白质粒组相比,cP<0.05

图4 Western blot检测各组大鼠心肌组织中
3 讨论
心肌梗死作为心内科常见的危急症,发病率居高不下,且近年来呈逐年上升趋势,是严重威胁人群生命健康的重要疾病[7]。Talman和Ruskoaho[8]研究表明,心肌纤维化所致心肌重构在心肌梗死中扮演重要角色。心肌纤维化是心肌中成纤维细胞被大量活化,细胞外基质大量产生,是多因素、多基因、多步骤共同作用的结果[9]。Klotho基因作为重要的抗衰老基因,参与了多种疾病的发生过程,在心血管疾病患者血浆中呈低表达[10],且参与了心血管疾病的相关危险因素(如糖尿病、高血压、血脂异常、肾功能异常等)的发生[11]。本研究进一步探讨了Klotho基因在心肌梗死心肌纤维化中的作用,在利用腺病毒重组传导Klotho基因对大鼠心肌处理后,PCR和Western blot检测均显示Klotho基因转染组心肌组织中Klotho表达升高,提示转染成功。
本研究采用结扎左冠状动脉前降支的方法制备大鼠心肌梗死模型,HE染色结果显示,模型组大鼠心肌组织结构出现不完整,纤维排列稀疏杂乱,肌纤维出现断裂、间质水肿,有大量炎症细胞浸润;TTC染色结果显示,模型组大鼠心肌梗死面积显著增加,这些结果均提示成功构建了大鼠心肌梗死模型。在转导了Klotho基因后,Klotho转染组大鼠心肌病理学改变较模型组和空白质粒组减轻,且心肌梗死面积缩小,说明上调Klotho基因表达可有效减轻结扎左冠状动脉前降支对心肌的损伤作用。心肌重构作为心肌梗死后重要的病理学改变,一方面可通过增加左心室心肌重量及室壁厚度而维持正常的心脏容积及LVEF,同时,随着左心室的扩张,LVEF会随之下降并表现出心力衰竭症状[12-13]。本研究显示,与假手术组相比,心肌梗死大鼠均出现LVEF和FS降低,而LVDs和LVDd升高,提示心肌梗死导致的心肌重构可影响心脏功能。在转导了Klotho基因后,与模型组和空白质粒组相比,Klotho转染组大鼠LVEF和FS均升高,而LVDs和LVDd均降低,说明上调Klotho基因表达可有效改善大鼠心脏功能。
心肌纤维化作为心肌梗死后心力衰竭的重要病理基础,是导致死亡的重要因素[14],在此过程中,胶原蛋白会大量地堆积于细胞之间及血管间隙,使心肌活动力下降,心室壁僵硬、收缩及舒张功能受损,心功能不断下降[15]。本研究Masson染色结果显示,模型组和空白质粒组大鼠心肌细胞外堆积了大量蓝染的纤维,间质纤维化面积显著增加,这也是导致大鼠心功能下降的原因,但Klotho转染组大鼠心肌组织Masson染色蓝色区域显著减少,间质纤维化面积减少,说明上调Klotho基因基因表达可有效减轻心肌纤维化。CTGF作为一种分泌性蛋白,在促进细胞外基质合成、加速纤维沉淀及抑制胶原降解中发挥重要作用,在心力衰竭后心肌纤维化进程中呈异常高表达[16];TGF-β1是心肌纤维化过程中关键性调控因子,可促进CTGF的表达,二者在加速心肌重构及纤维化过程中发挥协同作用[17]。本研究显示,模型组和空白质粒组大鼠心肌组织中TGF-β1、CTGF基因和蛋白相对表达量均升高,而Klotho转染组大鼠心肌组织中TGF-β1、CTGF基因和蛋白相对表达量均降低,说明上调Klotho基因表达可能通过抑制TGF-β1、CTGF基因表达而阻断急性心肌梗死大鼠心肌纤维化进程。
综上所述,利用重组腺病毒载体传导Klotho基因可有效改善心肌梗死大鼠心功能,减轻心肌纤维化,其机制可能与抑制TGF-β1、CTGF基因表达有关,有望为心肌梗死临床治疗提供新的靶点。
(本文图1~3见插图9-1)
