Toll样受体4重组质粒及稳转HepG2细胞株的构建
2018-09-01黄萃园张洪白瑞丹
黄萃园,张洪,白瑞丹
(武汉大学人民医院药学部,湖北 武汉 430060)
Toll样受体4(Toll-like receptor 4,TLR4)是一种能够识别病原相关模式分子和危险相关模式分子的受体[1],分布于各个细胞的表面,参与生物体内的各种炎症调节、免疫应答以及肿瘤发生的进程。而在体内经配体刺激后,TLR4主要通过2条信号通路参与调控疾病的发生和发展,一条是髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖性信号转导通路,可进一步激活核因子κB(nuclear factor-κB,NF-κB)通路和丝裂原活化蛋白激酶(MAPK)通路,从而导致前炎性细胞因子的表达;另一条是为非MyD88依赖性通路,可激活转录因子干扰素调节因子3 (interferon regulatory factor 3,IRF3)和NF-κB,调节干扰素相关基因的转录。研究表明TLR4信号通路与肝癌[2]、结直肠癌[3]、胃癌[4]、宫颈癌[5]以及心血管疾病[6]等密切相关。TLR4基因位于9号染色体,其单核苷酸的多态性(SNP)可能会对某些疾病的易感性及发展程度产生影响。而研究较多的是2个位于外显子区的单个核苷酸的变异:896 A>G(rs4986790)、1196 C>T(rs4986791);该区域的变异会导致TLR4蛋白表面性质的改变,从而影响TLR4与配体的结合[7]。临床研究[8-9]发现896 A>G、1196 C>T位点多态性与丙型肝炎病毒(Hepatitis C Virus,HCV)易感性有关,同时与肝硬化患者的发展程度以及肝癌发生发展有关,但相关机制尚未阐明。因此,本课题拟通过构建含有TLR4 1196C/T、896A/G野生型、突变型基因的真核表达系统载体,并将其转染HepG2细胞后加入嘌呤霉素筛选出稳定表达TLR4的细胞株,为体外研究TLR4基因多态性对HepG2细胞生物学功能的影响及肝癌发展影响的分子机制提供重要的实验基础。本研究起止时间为2016年10月至2017年2月。
1 材料与方法
1.1质粒及菌株pIRES2-ZsGreen1载体,感受态大肠杆菌DH5α购自武汉巴菲尔生物技术服务有限公司。
1.2试剂及仪器Taq DNA Polymerase(TIANGEN,批号:ET105-02-01),dNTP (TIANGEN,批号:CD117),pfu DNA(PolymeraseFermentas,批号:EP0572)DpnI (Fermentas,批号:ER1702),DL15000(TIANGEN,批号:MD110),DL2000(TIANGEN,货号:MD114),金牌超量无内毒素质粒大提试剂盒(康为世纪,批号:CW2104),PCR扩增仪(北京东胜创新生物科技有限公司),水平电泳仪(北京君意东方电泳设备有限公司),紫外分析仪(北京君意东方电泳设备有限公司),Western blot试剂盒(武汉谷歌生物有限公司),TLR4一抗(Affinity Biosciences,批号:AF7017),羊抗兔二抗(cell signaling technology,批号:5151)。
1.3方法
1.3.1重组质粒的构建 在NCBI基因库中查找的人类TLR4基因序列并依照引物设计原则设计引物,PCR扩增合成cDNA。双酶切连接至pIRES2-ZsGreen1 载体的 Xho I 和 BamH I 之间,获得重组质粒pIRES2-TLR4。
1.3.2单突变质粒的构建 质粒pIRES2-TLR4,896位点由A突变为G,突变后质粒命名为pIRES2-TLR4(A-G);质粒pIRES2-TLR4,1196位点由C突变为T,突变后质粒命名为pIRES2-TLR4(C-T)。引物设计:TLR4-F(A-G):CTACCTCGATGGTATTATTGACTTATTTAATTGTTTGACA;TLR4-R(A-G):AAT-AAGTCAATAATACCATCGAGGTAGTAGTCTAAGTA-TG;TLR4-F(C-T):GATTTTGGGACAATCAGCCTAAAGTATTTAGATCTGAG;TLR4-R(C-T):TA-CTTTAGGCTGATTGTCCCAAAATCACTTTGAGAAC。反应条件:95 ℃ 2 min;95 ℃ 1 min,60 ℃ 1 min,68 ℃ 12 min,18个循环;72 ℃ 30 min,4 ℃ 10 min,用1%琼脂糖凝胶电泳鉴定后,将PCR产物用Dpn I酶切并将酶切产物转化DH5α感受态细胞,加入卡那霉素进行筛选。以载体pIRES2-ZsGreen1的通用引物CMV-F和IRES-R进行PCR鉴定。扩增片段约为2 600 bp。引物序列如下:CMV-F:CGCAAATGGGCGG-TAGGCGTG;IRES-R:CCTCACATTGCCAAAAGACG。
1.3.3双突变质粒的构建 以pIRES2-TLR4(A-G)为模板,以TLR4-F(C-T),TLR4-R(C-T)为引物进行PCR扩增构建双突变质粒,质粒命名为pIRES2-TLR4(A-G,C-T)。反应条件:95 ℃ 2 min;95 ℃ 1 min,60 ℃ 1 min,68 ℃ 12 min,18个循环;72 ℃ 30 min,4 ℃ 10 min。 用1%琼脂糖凝胶电泳鉴定。将PCR产物用Dpn I酶切并将酶切产物转化DH5α感受态细胞,加入卡那霉素进行筛选。以载体pIRES2-ZsGreen1的通用引物CMV-F和IRES-R进行PCR鉴定。扩增片段约为2 600 bp。
1.3.4载体亚克隆 载体质粒pLVX-IRES-Puro和目的基因质粒pIRES2-TLR4的XhoI和BamHI 双酶切,酶切反应在37 ℃水浴反应3 h。分别回收载体pLVX-IRES-Puro酶切大片段和目的基因质粒pIRES2-TLR4酶切小片段。质粒pLVX-IRES-Puro XhoI+BamHI回收大片段与目的基因TLR4的连接,连接反应在22 ℃反应3 h。将连接产物转化JM109感受态细菌,用氨苄西林进行筛选后,用小量质粒抽提试剂盒抽提质粒,进行酶切鉴定。得到质粒pLVX-TLR4-Puro、pLVX-TLR4(A-G)-Puro、pLVX-TLR4(C-T)-Puro、pLVX-TLR4(A-G,C-T)-Puro。
1.3.5质粒转染及构建稳转细胞株 病毒感染前1 d 铺HepG2细胞于24孔细胞培养板,感染当日细胞汇合度30%~60%为宜;取10 μL病毒液加入24孔板之细胞表面,细胞培养箱中孵育至少2 h后换液(也可不换液);感染48 h后可检测到空载对照组GFP的表达(荧光显微镜镜检);病毒感染后24 h,可以换用含最优浓度(本次筛选的最佳浓度为0.2 mg·L-1)嘌呤霉素的培养基。以后每隔1 d换用新鲜含嘌呤霉素的无抗生素3%~5%血清培养基,以替换含大量死细胞的培养基。直到抗性群落能被识别出。待抗性细胞长满以后,进行传代,用含0.02% EDTA的胰酶消化约2 min,用含血清的完全培养液终止消化,离心后弃上清,加入含10%的胎牛血清、100 μ·mL-1青霉素和100 μ·mL-1链霉素RPMI-1640培养基重悬,按适当比例接种6孔板进行实验。
1.3.6Western blot检测TLR4蛋白表达水平 分别在6孔板中接种HepG2正常细胞、转染TLR4野生型及突变型基因的HepG2细胞,每孔约3×105个细胞,24 h后收集细胞加入RIPA裂解液提取细胞总蛋白,并用BCA法测定蛋白含量。将5×上样缓冲液与提取的蛋白样品按照1 ∶4的比例进行混合,煮沸10 min使蛋白变性。在8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,再电转至PVDF膜上。电转后用BSA封闭2 h,分别用一抗TLR4和GAPDH于4 ℃孵育过夜。洗涤缓冲液(TBST)洗膜3次,再于羊抗兔二抗中避光孵育2 h,在奥德赛双色红外激光成像系统进行扫描分析。
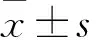
2 结果
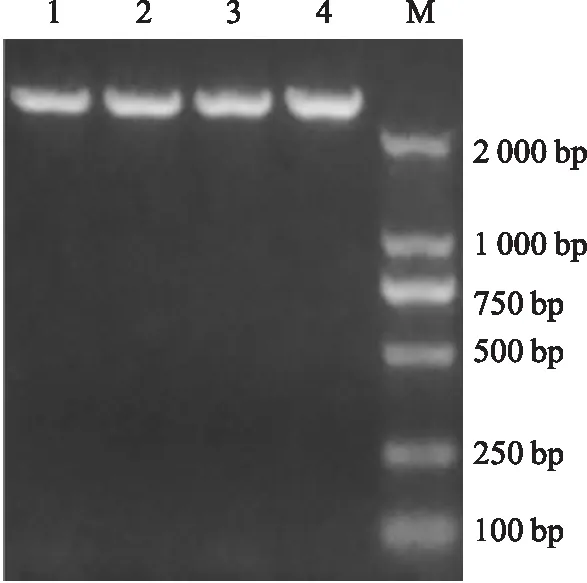
2.1TLR4单突变及双突变型重组质粒构建设计引物构建单突变质粒,PCR反应后进行1%琼脂糖凝胶电泳。酶切产物转化感受态细胞,挑取单个菌落,接种于液体培养基中,以载体pIRES2-ZsGreen1的通用引物CMV-F和IRES-R进行PCR鉴定,扩增片段约为2 600 bp,结果如图1(分别挑取了2个菌落)。PCR结果正确,进行测序鉴定。测序结果比对后正确,pIRES2-TLR4(A-G),pIRES2-TLR4(C-T)构建成功。 以pIRES2-TLR4(A-G)为模板,以TLR4-F(C-T),TLR4-R(C-T)为引物进行PCR扩增构建双突变质粒后进行1%琼脂糖凝胶电泳。同样,以通用引物CMV-F和IRES-R进行PCR鉴定,扩增片段约为2 600 bp,结果如图2(挑取了2个菌落)。PCR结果正确,送pIRES2-TLR4(A-G,C-T)-1测序,测序结果比对后正确,pIRES2-TLR4(A-G,C-T)构建成功。
注:M为DL2000;1为pIRES2-TLR4(A-G)-1;2为pIRES2-TLR4(A-G)-2;3为pIRES2-TLR4(C-T)-1;4为pIRES2-TLR4(C-T)-2
图1单突变质粒PCR鉴定图
注:M为DL2000; 1为pIRES2-TLR4(A-G,C-T)-1;2为pIRES2-TLR4(A-G,C-T)-2
图2双突变质粒PCR鉴定图
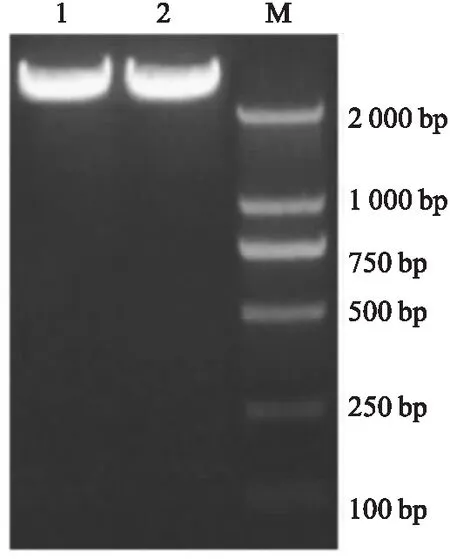
2.2pLVX-TLR4-Puro质粒构建载体质粒pLVX-IRES-Puro和目的基因质粒pIRES2-TLR4用XhoI和BamHI 双酶切,回收片段进行连接反应、转化后,各挑取4个单菌落抽提质粒进行酶切鉴定,结果如图3所示。经质粒酶切鉴定结果表明,5#、8#、11#、10#克隆为阳性克隆。进行测序后,经BLAST比对结果表明质粒pLVX-TLR4-Puro-5#、pLVX-TLR4(A-G)-Puro-8#、pLVX-TLR4 (C-T) -Puro-11#、pLVX-TLR4(A-G,C-T)-Puro-10#测序结果与设计序列一致。
注:Lane M为Trans2K plus marker
图3pLVX-TLR4-Puro质粒酶切鉴定
2.3单克隆细胞筛选结果HepG2细胞分别转染重组质粒pLVX-TLR4-Puro、pLVX-TLR4(A-G)-Puro、pLVX-TLR4(C-T)-Puro、pLVX-TLR4(A-G,C-T)-Puro,经细胞克隆后,用嘌呤霉素进行筛选,分别在加药48 h后于倒置显微镜下观察,4组细胞均生长较好、形态正常,如图4。
2.4Westernblot检测TLR4蛋白表达水平以GAPDH蛋白为内参,检测HepG2正常细胞(对照组)及4组重组TLR4过表达细胞(WT野生型;1196位点单突变型;896位点单突变型;1196、896位点双突变型)中TLR4蛋白的表达水平,结果表明4组转染了TLR4基因的HepG2细胞中TLR4蛋白表达量显著高于正常HepG2细胞(图5)。
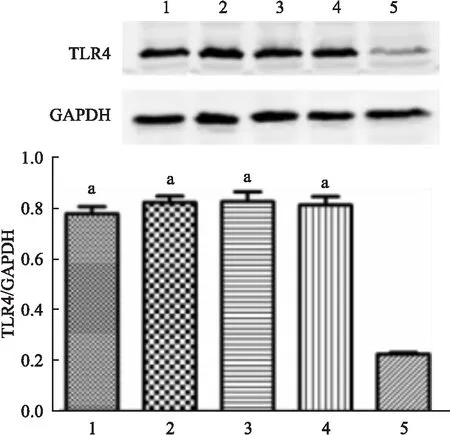
注:1为TLR4-WT;2为TLR4-1196T;3为TLR4-896G;4为TLR4-1196T,896G;5为对照组;与正常HepG2细胞相比,aP<0.01
图5Westernblot检测各组细胞中TLR4蛋白表达水平(n=3)
3 讨论
肝癌是常见的消化系统肿瘤,死亡率极高且发病率逐年上升[10]。TLR4对肝癌细胞的增殖、凋亡及侵袭等生物学功能有重要的影响[11-12]。TLR4信号通路参与肝癌发生发展主要通过MyD88依赖以及非MyD88依赖信号途径激活NF-κB和活化激活蛋白1(AP-1)等转录因子,从而促进炎症因子释放,刺激肝实质细胞、间质细胞,引起细胞突变以及活化相关免疫细胞,诱导肝癌的发生[13-14]。肝癌的发生发展是一个复杂的多因素过程,其复发率高使得治疗效果难以令人满意。
随着药物基因组学的发展,基因多态性和开展个体化治疗已成为当代的热点,研究肝癌发展影响的分子机制对评价环境危险因素以及设计个体化治疗方案具有重要的实际应用价值。肝炎病毒是肝硬化和肝癌形成的重要原因,而临床研究[15]表明896A及1196C在HCV 患者组的基因频率分布要远远高于正常组,896G及1196T可以作为防止HCV感染的保护因素。同时,Guarner-Argente 等[9]发现TLR4基因多态性不仅与HCV 易感性有关,还与肝硬化患者的发展程度有关,可用来预测HCV 引起的慢性肝病临床进展以及患肝癌的风险性。因此,研究TLR4基因多态性对肝癌发展影响的分子机制具有重要意义。
本实验通过构建TLR4-WT(野生型)、896A/G、1196C/T单突变及双突变重组质粒转染肝癌细胞HepG2,使TLR4蛋白在4组HepG2细胞中稳定的过表达。由于转染的质粒不同(野生或突变型),可能会导致TLR4表达的含量或蛋白的结构功能发生变化,从而影响HepG2细胞增殖、凋亡及侵袭等生物学功能的变化。同时,本实验采用稳定转染的方法,用嘌呤霉素筛选掉没有被成功转染的细胞,使4组细胞的转染率为100%,排除由于转染率的不同而导致导致TLR4表达含量或功能的变化。由于4组HepG2细胞除了稳定转染的质粒不同,其他生理、各种环境条件均相同,若进一步实验表明4组HepG2细胞的生物学功能不同,而影响因素极有可能是转染不同的质粒后,过表达的TLR4的含量或结构功能改变,因此可初步研究TLR4基因的多态性对肝癌发展的影响。虽然HepG2细胞本身表达少量TLR4蛋白,但进行稳转的4组细胞原本TLR4含量及功能一致,研究的是4组细胞过表达后产生的不同,同时以未转染的HepG2细胞作为对照。若要完全排除遗传背景可能对实验结果的产生干扰,需要将细胞中TLR4基因敲低或敲除。对HepG2细胞进行TLR4基因敲低或敲除的方法主要是micro RNA和siRNA,但microRNA 和 siRNA转染率很难在4组细胞中完全保持一致,同时可能会影响后转入的质粒的表达,因此这种方法的可行性较低。若对动物如小鼠进行TLR4基因敲除,进行造模后取其肝癌细胞,再将这4种质粒(TLR4-WT;TLR4-1196T;TLR4-896G;TLR4-1196T,896G)转染进行稳定表达,研究TLR4基因多态性对小鼠肝癌细胞生物功能的影响,并与TLR4基因多态性对人肝癌细胞HepG2生物学功能的影响进行比较,若结果一致则更加严谨。因此,这也是本实验室今后需要深入研究的方向。
最后,琼脂糖凝胶电泳鉴定图及基因测序结果表明成功合成了2种单突变及双突变的质粒;pLVX-TLR4-Puro质粒酶切鉴定图表明亚克隆成功,可进行稳定转染;嘌呤霉素筛选出含有抗性基因的细胞及Westernblot结果表明TLR4重组质粒已经转入细胞,TLR4在HepG2细胞中稳定过表达。因此,本实验室构建的稳转HepG2细胞将为进一步开展肝癌的临床个体化治疗奠定基因。
(本文图4见插图9-2)
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
