圈养华南虎粪便细菌总DNA提取方法比较
2018-08-31李龙显陈茂金林敏曹玲霞李雅婷邓贤才邬向东
李龙显 ,陈茂金 ,林敏 ,曹玲霞 ,李雅婷 ,邓贤才 ,邬向东
(1.江西农业大学动科院,江西 南昌 330045;2.江西农业大学兽医院)
华南虎是中国的十大濒危动物之一、国家一级保护动物,红色物种名录极度濒危,在野外已灭绝。目前南昌市动物园饲养着20多只华南虎,为了解圈养华南虎肠道细菌与腹泻的相关性,本研究拟对南昌市动物园圈养的华南虎新鲜粪便进行细菌总DNA提取,然后进行微生物多样性分析,以了解正常与腹泻时粪便中细菌群落的变化规律,为防治华南虎腹泻提供一定的科学依据。
高质量的总DNA的提取是通过高通量测序研究肠道微生物的前提,直接关系到后续实验的可行性和准确性。粪便组成复杂,不同食性动物粪便组成又有所区别,从而使得提取粪便微生物总DNA的方法通用性较差。因此,找到一种适合本实验研究的粪便样品微生物总DNA提取方法尤为重要。本文选取了常用的6种提取方法和2种提取策略组合成新的方法,分别提取肉食性动物粪便总DNA,对比其提取效果,找出最适合的提取方法,为进一步研究圈养华南虎肠道微生物提供适合的研究方法。
1 材料与方法
1.1 材料
1.1.1 主要试剂及配制。100bp DNA Lodder、Taq×2 PCR mix、λDNA/HindⅢ (北京全式金公司);Tris 平衡酚、CTAB、溶菌酶、蛋白酶、RNase A、粪便基因组DNA提取试剂盒(北京索来宝生物科技公司);琼脂糖(西班牙BIOWEST);氯仿、异戊醇(国产分析纯)。
裂 解 液 Ⅰ :1.17%NaCl、0.1 mol/L Tris-HCl(pH8.0)、1%SDS、1.86%EDTA Na2、1%Triton X-100,灭菌存放。
裂 解 液 Ⅱ :0.25 mol/L Tris-HCl(pH8.0)、0.01 mol/L EDTA(pH8.0)、0.05%SDS、0.029%NaCl,灭菌存放。
CTAB 溶液:0.4%CTAB、0.1 mol/L Tris-HCl、0.01 mol/L EDTANa2、1.4 mol/L NaCl 、1%PVP K-30,调pH至7备用。
酚、氯仿、异戊醇配比:取50%体积酚、48%体积的氯仿、2%体积的异戊醇混合,避光保存。
1.1.2 主要设备。5415R冷冻高速台式离心机(美国Eppendorf公司);960型梯度PCR仪 (杭州晶格公司);JY300C型电泳仪、JY02S型紫外分析仪 (上海君意东方公司);超净工作台(苏州净化设备公司);SPX-150B-Z型生化培养箱(上海博迅公司)。
1.1.3 相关引物。本研究采用细菌16S rDNA全长通用引物,预计扩增DNA片段长度大约为1500bp,由南京金斯瑞生物科技有限公司合成。
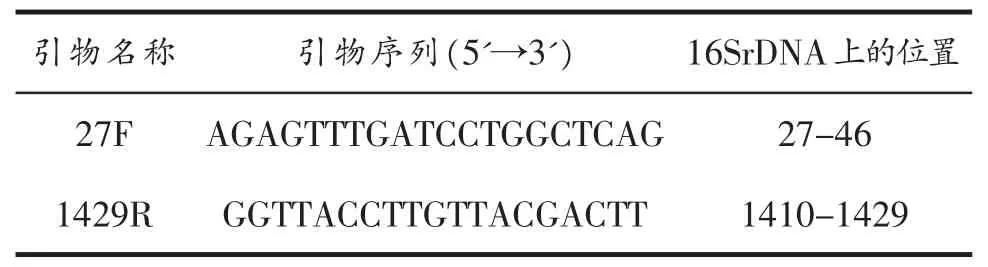
引物名称 引物序列(5'→3') 16SrDNA上的位置27F AGAGTTTGATCCTGGCTCAG 27-46 1429R GGTTACCTTGTTACGACTT 1410-1429
1.2 方法
1.2.1 样品采集。早晨8~9点气温较低时,用无菌冻存管从南昌动物园采集新鲜的华南虎粪便。用无菌烧杯称取粪便2.4 g,加入12 mL PBS溶液震荡搅拌均匀,分装12支1.5mL离心管中。
1.2.2 粪便微生物总DNA提取
取6支粪便样品直接提取DNA;另取6支粪便样品经预处理后再提取DNA,预处理方法见1.2.2.1。
1.2.2.1 样品预处理。将粪便样品震荡混匀,4℃800 rpm离心5 min取上清;取沉淀加1 mL PBS重悬,相同条件重复离心1次;弃上清,4℃12 000 rpm离心5 min取沉淀,沉淀用PBS洗涤3次,4℃ 12 000 rpm离心5 min,留沉淀备用。
②大数据技术的运算工作基于强大的计算机处理系统,数据获取和整合速度快,便捷性程度高,方便城乡规划人员与管理者进行设计与决策,且有助于资源的合理调配,可以在一定程度上减少城市规划的经费开支[1]。
1.2.2.2 总DNA提取方法。经文献查询,共选择了6种方法,分别是:
方法1(酶化学法Ⅰ):分别取未处理样品和预处理样品各 1份,加入 200 μL TE,20 μL溶菌酶(100 mg/mL),37℃处理 40 min,加入 500 μL 裂解液Ⅰ,10 μL 蛋白酶 K (20 mg/m L),55℃水浴过夜;加入 2 μL RNase A,37℃消化 30 min,4℃ 12 000 rpm离心10 min;取上清置1.5mL的离心管中,用苯酚、氯仿各抽取1次,取上清至离心管;加入50 μL 3 mol/L醋酸钠和1000μL预冷无水酒精,-20℃静置沉淀5h;4℃ 12 000rpm离心10 min,取沉淀加入500μL 70%的乙醇洗涤1次;去上清,干燥15 min,溶于 50 μL ddH2O 中,-20℃保存备用。
方法2(CTAB法):分别取未处理样品和预处理样品各1份,分别加入CTAB溶液500 μL和β-巯基乙醇2 μL,60℃水浴15min;取上清置1.5 mL离心管中;用酚和氯仿抽取2次;加1 000μL冰预的无水酒精沉淀20min;12 000rpm离心10 min,弃上清;加入预冷的500μL 70%酒精洗涤1次,沉淀于室温晾干;加50 μL ddH2O溶解;并加入终浓度为 20μg/mL的 RNA 酶 A,37℃处理 30 min,-20℃保存备用。
方法3(SDS碱裂解法):分别取未处理样品和预处理样品各1份,加入600 μL碱性裂解液Ⅱ,剧烈震荡;放入55℃水浴60 min;室温分别加入200 μL 3mol/L醋酸钠,震荡 20s,充分混匀 4℃ 12 000 rpm离心3 min;取上清加入等体积的苯酚、氯仿抽取2次;取上清加入600 μL异丙醇沉淀DNA,4℃12 000 rpm 离心 5 min;弃上清,加入 600 μL 70%乙醇溶液洗涤1次;弃上清,干燥15 min,加入50 μL ddH2O溶解,-20℃保存备用。
方法4(试剂盒法):参照试剂盒说明书,分别取未处理样品和预处理样品各1份分别提取总DNA。
方法5(酶化学法Ⅱ):分别取未处理样品和预处理样品各1份,分别加入100 mg/mL溶菌酶20 μL,37℃温浴 45 min; 再加入 50μL 10%SDS 和15μL 10 mg/mL蛋白酶K,55℃水浴1h; 用酚∶氯仿∶异戊醇抽取1次;用氯仿∶异戊醇抽取一次,取上清加入50μL醋酸钠和1 000 μL-20℃预冷无水酒精混匀,-20℃沉淀 5 h;4℃下 12 000 rpm离心 10 min,取沉淀加入500μL 70%的酒精洗涤1次;去上清液,沉淀干燥 15 min,溶于 50 μLddH2O,并加入终浓度为 20 μg/mL的 RNA 酶 A,37℃放置 30 mi,-20℃保存备用。
以上每个样品处理均重复3次,下同。
1.2.3 目测总DNA溶液颜色及洁净度。肉眼观察6种方法提取粪便样品的总DNA颜色及洁净度,初步判断总DNA质量。
1.2.4 总DNA琼脂糖凝胶电泳分析。取5μL提取的总DNA溶液, 再加入 1 μL 6×DNA Loading buffer上样缓冲液混匀;并使用λDNA/HindⅢ作为maker,1μL ddH2O做模板的扩增产物作为阴性对照,1%琼脂糖电泳35 min,电泳完毕后,将胶放入紫外分析仪内观察并拍照分析结果。
1.2.5 总DNA的得率和纯度测定分析。加2 μL提取的粪便微生物总DNA样品与Nanodrop 2 000微量紫外分光光度计上测定DNA浓度和OD260/OD280值。
1.2.6 总DNA PCR扩增分析。用6种方法分别提取粪便样品总DNA作为模板,采用16SrDNA通用引物27F/1429R对整个16SrDNA基因进行PCR扩增,引物由南京金斯瑞生物科技有限公司合成。设立以ddH2O为扩增模板的阴性对照。
PCR扩增体系为:
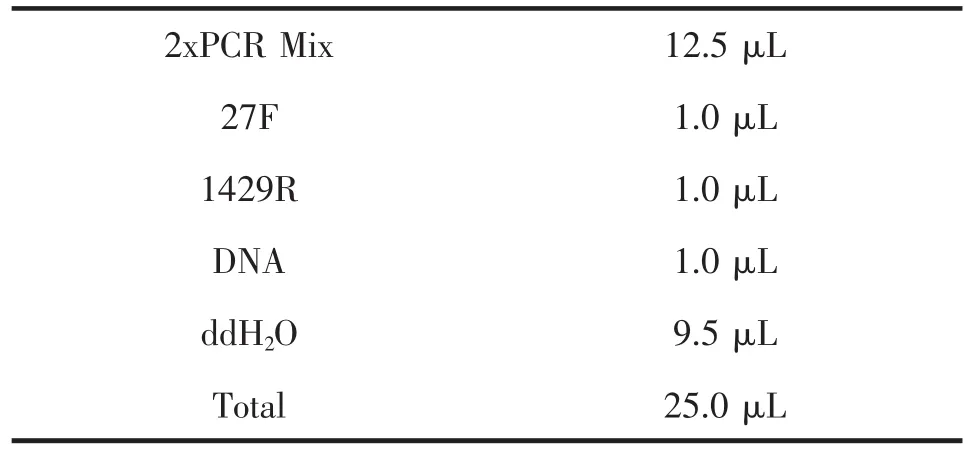
2xPCR Mix 12.5 μL 27F 1.0 μL 1429R 1.0 μL DNA 1.0 μL ddH2O 9.5 μL Total 25.0 μL
反应程序为:94℃预变性5 min;94℃变性 40s,55℃退火50s,72℃延伸50 s,进行33个循环后;最后72℃延伸10 min。取5 μL扩增产物,并使用100bp DNA Ladder作为 Maker,1 μL ddH2O 做模板的扩增产物作为阴性对照,1%琼脂糖凝胶电泳35 min,取凝胶于紫外分析仪内观察结果并拍照。
2 结果
2.1 目测总DNA溶液颜色和洁净度结果
6种方法分别提取2组粪便样品,每种方法均重复3次。结果总DNA溶液颜色和洁净度如下图1所示。可见经预处理过和未经预处理物粪便样品提取的总DNA溶液都成透明无色状态,6种方法都能除去粪便内的色素等物质。

图1 6种方法提取2组粪便样品总DNA图a~f分别为方法1、方法2、方法3、方法4、方法5、方法6;每幅图从左到右1~3为预处理后提取DNA;4~6为直接提取DNA
2.2 粪便总DNA琼脂糖电泳检测结果
6种不同方法提取2组不同组粪便的总DNA,每个样品重复处理3次,经1%琼脂糖凝胶电泳后,在紫外分析仪下观察,结果如图2。
如图可见,J1、Z1都有明显的特异性条带,条带大小约为23 kb,说明方法1提取效果较好;J2、Z2没有明显特异性条带且降解较为严重,说明方法2提取效果较差;J3没有明显的特异性条带,Z3有明显特异性条带,说明方法3中,直接法比预处理法更理想。J4、Z4没有特异性条带,说明方法4提取的不理想;J5、Z5都有特异性条带,而且亮度较大,但都伴随有较严重的拖带和降解,这说明方法5提取的DNA浓度较高,但有一定的碎片化;J6、Z6没有明显条带,但降解严重,这可是是方法6煮沸过程中太过于激烈,导致大量DNA断裂。综上我们可知对于华南虎粪便DNA提取以方法1效果最好,方法5其次。
2.3 细菌16S rDNA全长基因扩增分析
用细菌16S rDNA全长通用引物27F/1429R对6种方法提取4组粪便细菌总DNA PCR扩增,扩增产物经1%琼脂糖凝胶电泳结果如图3所示。
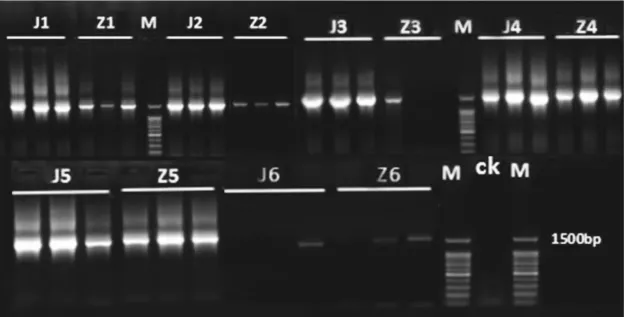
图3 6种方法提取2组粪便总DNA 27F/1429R扩增产物电泳图M:100bp DNA Ladder;CK:阴性对照;J1-J6 为 6 种方法对预处理后样品总DNA PCR扩增产物;Z1~Z6为6种方法对未处理样品直接提取DNA进行PCR扩增产物。
方法1、2、4、5都能扩增出特异性条带,但方法1、2提取预处理粪便组的总DNA扩增条带亮度比未处理粪便组总DNA扩增条带高。方法3未处理粪便组重复性差,预处理粪便组有明显特异性条带。方法4、5不受样品预提处理影响,都能扩增出较亮的条带。方法6不论是预处理或不做预处理,提取重复性均不理想。
3 小结与讨论
3.1 样品采集和保存
随着人类活动范围越来越大,对野生动物和植物大量猎杀和采伐,导致野生动物数量越来越稀少。这使得野生动物样本采集变尤为困难。特别是研究其肠道微生物群落结构组成时,采集野生动物肠道样本将损害动物健康。在此种情况下,无损伤性取样方法被学者提出,如采集粪便、血液、毛发作为研究样本。此后该方法多被广泛运用野生动物研究。有研究表明,粪便样品提取的总DNA质量受采集样品环境温度和样本保存方法的影响。环境温度较低时采集样品提取的总DNA质量高于环境较温时采集的样本提取的总DNA质量,而直接冷冻方法保存粪便样品提取总DNA质量高于其他方法保存样品。
本实验采用非损伤性的研究方法,在早上气温较低时到虎笼中采集样品作为研究样本,并迅速放入液氮保存备用。
3.2 粪便样品总DNA提取质量比较
有研究表明,粪便样品提取的总DNA质量受动物食性和提取方法的影响,并且在提取前适当的预处理能减少提取的总DNA中的PCR抑制物存在。因此一种合适的粪便总DNA提取方法就显得尤为重要。
本实验选取了6种常用的粪便DNA提取方法,采用适当预处理和不进行预处理的两组样品。比较6种方法和2种提取策略组合方法中对华南虎最优组合方法。
研究结果显示方法1直接提取粪便效果最好,提取的总DNA纯度高,片段完整度高和生物多样性好。对微生物16S rDNA扩增效果来看,方法1、2经预处理样品扩增效果和方法4、5的PCR扩增效果是最好的,方法1、2未处理粪便样品效果次之,其他方法不太理想。根据提取效果,我们将采用方法1直接提取总DNA,扩增16SrDNA进行一步研究。
