压力诱导的心力衰竭演变过程中的心脏结构、血流动力学和肺部大体观的动态改变
2018-08-30唐富琴姜云瀚朱雨孟永胜蹇朝肖颖彬
唐富琴 姜云瀚 朱雨 孟永胜 蹇朝 肖颖彬
心力衰竭(心衰)是各种心血管疾病发展的终末阶段。其发病率逐年上升,已成为世界范围内的主要公共卫生问题。我国卫生部统计信息显示,心血管疾病是我国居民第二位的死亡原因。其中,心力衰竭住院率占同期心血管疾病的20%,但死亡率却高达40%,心力衰竭患者的5年生存率甚至低于许多恶性肿瘤[1]。我国现有超过400万的心衰患者,每年医疗费用超过100亿元。随着人口老龄化进程,心力衰竭的发病率和医疗耗资必将继续增长。尽管近二十年来在心力衰竭和临床治疗技术取得重大进步,大大改善了心力衰竭的治疗现状,有效延长了患者的生存率并降低了慢性心力衰竭患者急性发作的机率,但是,这些治疗策略只是在一定程度上延缓了心力衰竭的进程,并没有对心衰进行早期干预[2-2]。而目前对于心衰的疾病进程的具体情况并不清楚,特别是心肌肥厚如何失代偿进展为心衰的具体演变的过程和分子机制尚不清楚。
主动脉弓缩窄致左室肥厚模型是能有效模拟人心脏左室肥厚病理生理过程的动物模型。本实验采用国际通用的雄性c57 小鼠主动脉弓缩窄术(Transverse aortic constriction, TAC)制备小鼠心肌肥厚模型,旨在观察从心肌肥厚向心力衰竭的疾病进展中心脏功能、心肌间质和血流动力学的动态改变。
材料和方法
一、实验材料和仪器
1. 实验动物: 8~10周龄雄性c57小鼠50只,体重22~25 g,由陆军军医大学(第三军医大学)大坪医院野战外科研究所提供。随机分为对照组10只和TAC组40只。两组按时间又分为1周组(n=9)、2周组(n=9)、4周组(n=10)和8周组(n=10)。
2. 主要试剂及仪器: 异氟烷、显微器械、荧光倒置生物显微镜(德国莱卡DMI 3000B)、呼吸机(美国肯特医疗设备公司)、小动物麻醉机(美国Matrx),小动物超声(VEV02100)、心导管仪(ADINSTRUMENTS)、氧气。
二、实验方法
1. 主动脉弓缩窄模型: c57小鼠吸入异氟烷麻醉后,然后气管插管接呼吸机(呼吸频率:120次/min,潮气量:0.2 ml/次)。可见胸廓跟随呼吸机频率规整运动。将小鼠仰卧固定在双目体视显微镜下操作,取胸前正中切开皮肤,上至胸骨上窝,下至第二肋骨水平。用显微镊分离胸腺暴露主动脉弓,用5-0丝线在右颈总动脉分出处,用27 G针结扎,结扎确实后抽出针头,逐层关胸,缝皮。关麻醉机,皮下注射0.5 ml生理盐水,待小鼠自主呼吸后脱机拔管。以标准饲料喂养。正常对照组开胸后不做结扎缝合皮肤。
2. 取材和检测: 在TAC术后第1周、第2周、第4周、第8周,用小动物超声检测TAC组和正常对照组的心脏功能和心脏结构变化,用心导管检测两组的血流动力学情况。肝素化两组小鼠,静脉注射饱和氯化钾后取出心脏,称取心脏重量,用4%多聚甲醛固定,石蜡包埋,进行HE染色和Masson染色,分别观察心肌结构改变和纤维化情况。
3. 小动物超声评价心脏功能: 用1%戊巴比妥钠(80 mg/kg)麻醉小鼠,仰卧位固定,沿胸骨旁长轴和短轴切面观察,在二尖瓣腱索乳头肌平面,取平均5个心动周期测量得出左心室后壁舒张末厚度(left ventricular posterior wall thickness of diastole, LVPWd),左心室后壁收缩末厚度(left ventricular posterior wall thickness of systole, LVPWs)以及左心室射血分数(left ventricular ejection fraction, LVEF)和左心室缩短分数(left ventricular fractional shortening, LVFS)[4]。
4. 心导管检测血流动力学变化: 用1%异氟烷吸入麻醉小鼠,取仰卧位固定,分离并暴露右颈总动脉,5~0丝线结扎远心端,眼科剪在动脉上剪一小口,Miller导管从开口处进入右颈总动脉,将导管送入左心室,固定导管。观察波形和压力-体积环的形态,记录左心室内压最大上升速率(dp/dt max)、左心室舒张末期压力(left ventricular end-diastolic pressure, LVEDP)和左心室收缩末期压力(left ventricular end-systolic pressure, LVESP)。
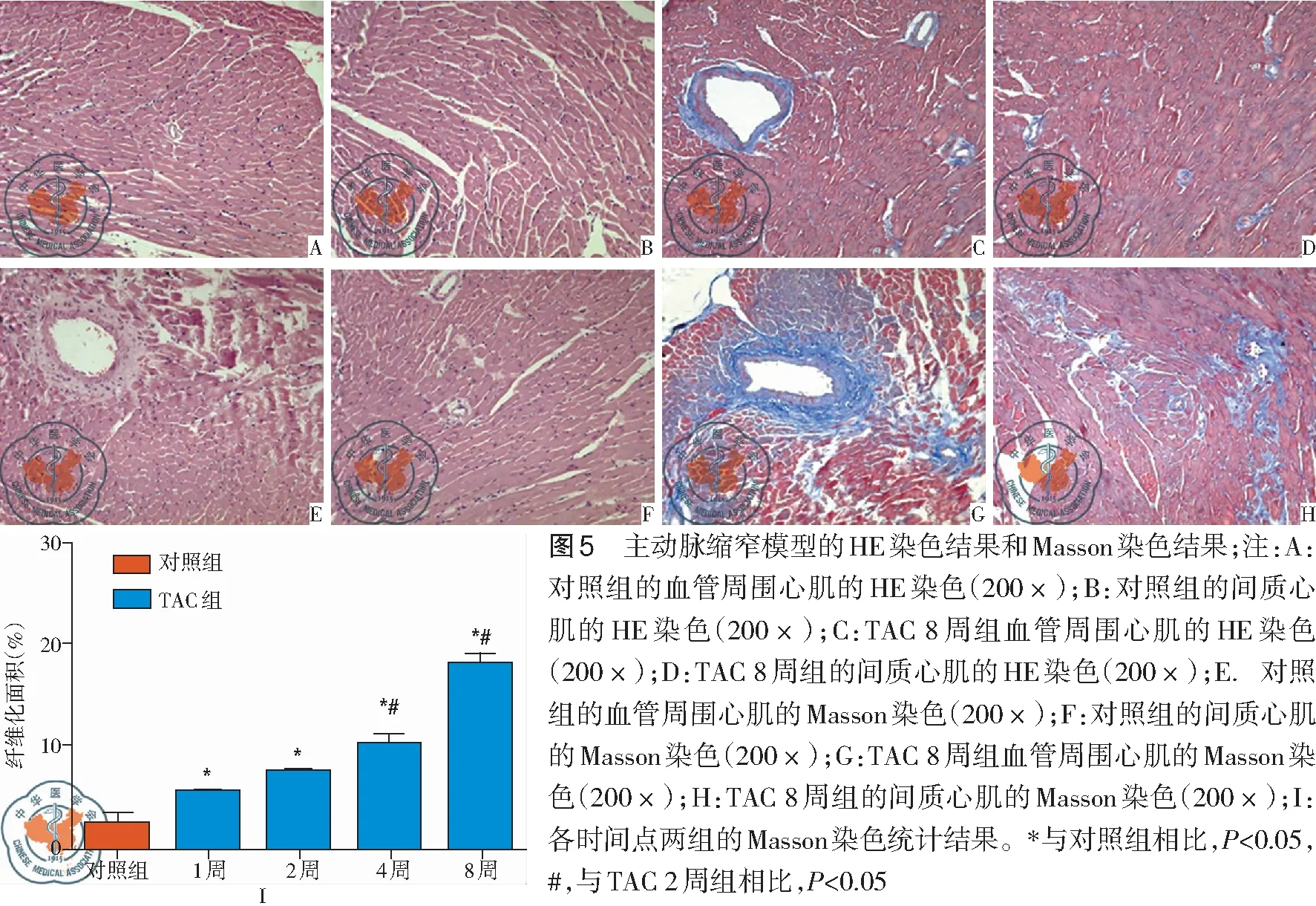
5. HE染色观察心肌结构改变: 石蜡包埋心脏后,自心底向心尖以3 μm厚度切片。进行HE染色,在普通光镜下观察心肌细胞和心肌间质的排列和结构等病理学改变并拍照。
6. Masson染色观察纤维化情况: 将石蜡切片脱蜡,用Harris′s苏木素染核10 min,用水冲洗后,用丽春红-酸性复红染色液染色10 min,用水冲洗,1%磷钼酸处理5 min,1%亮绿SF染色10 min,用水冲洗,无水乙醇脱水、透明、中性树脂封片。晾干后在光学显微镜下观察,用Image-Pro Plus 6.0图像分析系统分析胶原含量。
三、统计学方法
分析采用SPSS 20.0软件,作图使用Graphpad prism 6.0软件。计量资料采用均值±标准差表示,多组比较采用单因素方差分析,组间比较采用Tukey法。计数资料采用率表示,P<0.05为差异有统计学意义。
结 果
一、主动脉弓缩窄模型的手术情况
TAC组小鼠40只,术后存活38只,死亡2只,1只由于结扎弯钩抽离时损伤主动脉弓引起出血死亡,1只由于主动脉弓破裂引起死亡,主动脉弓缩窄手术总成功率为95%,见图1。术后一周时,用超声对TAC组所有的存活的小鼠进行主动脉狭窄处进行评价,TAC组小鼠均可见狭窄处彩色血流,血流速度增加,峰值血流500 mm/s以上,管腔直径狭窄66%左右。存活的小鼠造模成功率为100%。
二、各时间点两组小鼠心脏超声情况
与对照组比较,缩窄2周后,缩窄组小鼠左心室射血分数开始显著降低(P<0.05),左心室缩短分数开始显著降低(P<0.05)。LVPWd在缩窄2周开始明显增加(P<0.05),而在缩窄8周时降低至和对照组水平相当(P>0.05)。LVPWs在缩窄8周时明显降低(P<0.05)。超声结果提示TAC 2周开始小鼠左心室肥厚,代偿反应逐渐增强,到TAC 8周时已进入失代偿期,后壁收缩末厚度降低,收缩能力明显下降,心功能显著下降,见图2。
三、各时间点两组小鼠血流动力学情况
与对照组相比,从缩窄1周开始,LVEDP开始明显升高(P<0.05),到缩窄8周时降低至于对照相当水平(P>0.05);LVESP从缩窄1周开始明显升高(P<0.05)。dp/dt max在缩窄2周升高(P<0.05),在缩窄8周时降低(P<0.05)。血流动力学的结果提示,从缩窄2周开始,心室内压力出现明显的代偿反应, 到缩窄8周,心肌进入失代偿阶段,收缩能力明显降低,见图3。
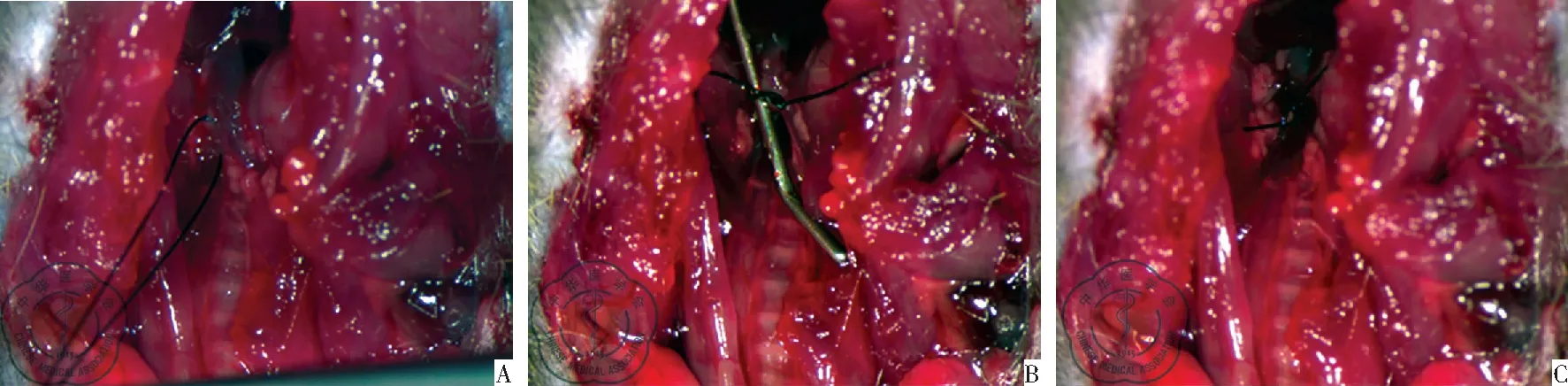
图1 主动脉缩窄模型的手术图片;注:A:暴露并分离主动脉弓(7.5×);B:结扎27G针头和主动脉弓(7.5×);C.抽离27G针头,建立主动脉弓缩窄(7.5×)

图2 手术后8周时两组的超声结果;注:A:对照组超声图;B:对照组的血流图;C:TAC 8周组的超声图;D:TAC 8周组的血流图;E:各时间点两组的射血分数;F:各时间点两组的缩短分数;G:各时间点两组的左心室后壁舒张末厚度;H:各时间点两组的左心室后壁收缩末厚度。*与对照组相比,P<0.05;#与TAC 2周组相比,P<0.05;※与TAC 4周组相比,P<0.05

图3 小鼠心导管的手术图片及心导管测量结果;注:A:暴露并分离右侧颈内动脉(7.5×);B:导管插入右侧颈内动脉并固定(7.5×);C:各时间点两组的左心室舒张末压力;D:各时间点两组的左心室收缩末压力;E:各时间点两组的左心室内压最大上升速率;*与对照组相比,P<0.05;#与TAC 2周组相比,P<0.05;※与TAC 4周组相比,P<0.05
四、各时间点两组小鼠的大体标本情况
与对照组相比,缩窄2周开始,心脏体重比和肺脏体重比明显增加(P<0.05)。从大体标本上,可观察到缩窄8周的肺水肿明显,肺脏呈粉红色,见图4。
五、病理组织学变化
HE染色发现,对照组心肌纤维排列正常,无血管扩张及血管壁增厚等表现,而缩窄8 周的心肌细胞胞浆变宽,细胞核变大,心肌细胞排列不整齐、着色不均匀,细胞间连接松散。Masson染色可见,缩窄1周开始心肌纤维化程度明显增加(P<0.05),缩窄8周时,血管周围纤维化和间质纤维化明显,以血管周围纤维化为主,见图5。
讨 论
心力衰竭是最常见的心血管疾病之一,近年发病率和病死率逐渐升高。虽然每年有大量心衰相关的研究成果发表,但目前心衰的治疗仍不理想,仅仅以延缓疾病进程的治疗为主[5-6]。而心衰疾病进展的具体机制和确切的疾病分期方法均不清楚,只有在更为精确的疾病分期方法的基础上,心衰的早期治疗才能更好实现[7-8]。
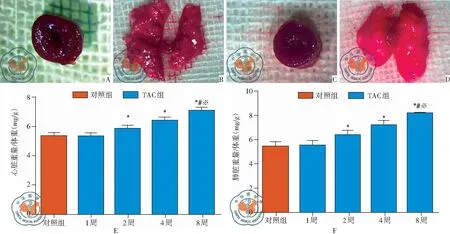
图4 小鼠主动脉缩窄模型的心脏和肺脏的大体观;注:A:对照组心脏的大体照片(10×);B:对照组肺脏的大体照片(10×);C:TAC 8周组心脏大体照片;D:TAC 8周组肺脏大体照片;E:各时间点两组的心脏体重比;F:各时间点两组的肺脏体重比;*与对照组相比,P<0.05,#与TAC 2周组相比,P<0.05;※与TAC 4周组相比,P<0.05
本研究通过建立小鼠主动脉弓缩窄模型,观察心脏超负荷引发的心肌肥厚,最终引起心衰的演变过程,来探讨心衰各时期具体改变,为进一步进行相关机制研究提供模型平台。在本实验中,缩窄1周时,长时间的压力负荷增加,最先表现为左心室收缩末压力升高,在心脏代偿反应中,逐渐出现左心室舒张末压力升高,提示心肌舒张功能逐渐受损。同时心脏逐渐出现纤维化。缩窄2周至缩窄4周时,随着压力负荷的持续存在,心肌的收缩功能逐渐出现功能不全,表现为射血分数和缩短分数逐渐降低,左心室内压最大上升速率增加,肺脏体重比明显增加。心脏开始出现结构性改变,心肌细胞肥大,心肌间质增加,表现为左心室后壁舒张末厚度逐渐增加,纤维化进一步加重,心脏体重比明显增加。缩窄8周时,长时间持续的压力负荷引起心脏功能失代偿,射血分数和缩短分数进一步降低,左心室内压最大上升速率明显降低,肺脏体重比进一步增加,左心室舒张末压力较前降低至正常值。心脏结构进一步改变,左心室后壁舒张末厚度和收缩末厚度不同程度减少,纤维化程度进一步加重,心脏体重比进一步增加。因此,本模型很好的模拟了持续压力负荷引起心衰发生和进展的整个演变过程。同时,为后续研究各阶段心衰的不同的机制提供了动物模型基础。
以往的研究一般都集中于某一个时间点,而没有观察心衰进展的各个阶段的变化。主动脉缩窄模型主要研究以大鼠为主[9-14]。由于c57小鼠与人类基因组相似程度最高,能很好反映人类疾病的病理生理学改变,因此,用小鼠作为TAC模型可更好的模拟心衰过程。而小鼠TAC模型研究中,其病变又以缩窄2周和4周改变为主,而对于心衰失代偿阶段和心衰早期的研究均非常缺乏[15-20]。
本文探讨压力负荷引起心衰的疾病演变的过程,主要关注心脏结构和血流动力学的动态改变。发现左心室舒张末压力是射血分数降低前的一个早期指标,为进一步早期诊断和干预心衰提供了基础。
