不同注射介质对ICSI后卵子受精与胚胎发育的影响*
2018-08-29何志旭赵淑云徐文杰许文方潘莉娜黄官友周从容赵孝梅王星慧
周 桦,何志旭,赵淑云,杨 朝,徐文杰,张 坤, 许文方,吕 晶,潘莉娜,黄官友,周从容,赵孝梅,王星慧
(1.贵州医科大学附属医院妇产科生殖医学中心,贵阳 550004; 2.贵州医科大学附属医院儿科,贵阳 550004;3.贵州医科大学干细胞与组织工程重点实验室,贵阳 550004)
人卵胞浆内单精子显微注射(intracytoplasmic sperm injection,ICSI)注射时,承载精子的注射介质不可避免地会随精子注入卵胞浆内。目前多数ICSI手术采用聚乙烯吡咯烷酮(PVP)作为注射介质,然而PVP本身具有化学活性,对卵母细胞受精、卵裂、胚胎发育以及对子代潜在的影响一直为学界所担忧。因此ICSI手术实施者们采用稀释的方式尽可能减少PVP的注入量,以减轻PVP的不良影响[1]。本研究比较了ICSI操作中使用PVP、人血清蛋白(HAS)和血清替代品(SPS)作为注射介质,对于ICSI效果的影响,寻求可能取代PVP进行ICSI操作的注射介质。
1 资料与方法
1.1一般资料 选取2017年9月至2018年1月,在贵州医科大学附属院接受常规体外授精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)和ICSI-ET治疗过程中患者废弃的未成熟卵母细胞,经体外成熟后按每批成熟卵母细胞统一一种注射介质进行ICSI授精,注射介质按轮次使用。据ICSI所用的注射介质不同,分为PVP组(3.5% PVP)、HSA组、SPS组。患者不孕因素为输卵管因素或男方因素。本研究经贵州医科大学附属医院伦理委员会批准,所用未成熟卵母细胞和精子均为患者知情同意后自愿捐赠所得。
1.2试剂与材料 实验所用注射介质、人输卵管液培养基、卵裂培养基、囊胚培养基以及梯度离心液均为Quinn′s产品系列,购自美国SAGE公司;所用培养皿均购自美国BD Falcon公司。
1.3卵母细胞的准备 按本中心常规对患者进行促排卵,艾泽(Merck Serono,德国)250 μg扳机,34~36 h后采集卵母细胞。回收的可疑未成熟卵母细胞于倒置显微镜下观察,未观察到第一极体的未成熟卵母细胞进行体外成熟,24 h后酶消化去除颗粒细胞[2],再次观察卵母细胞,将排出第一极体的MⅡ期成熟卵母细胞纳入实验,按轮次选择注射介质,进行ICSI授精。
1.4精子的准备 体外成熟卵母细胞行ICSI所用精子为本中心当日行IVF-ET的患者授精后剩余的拟丢弃精子。精子处理方式:液化后的精子用梯度离心液处理后再用精子洗涤培养基洗涤,受精用人输卵管液培养基上游。
1.5ICSI 取上游后的精子加入精子洗涤培养基中,选择形态正常、前向运动的精子进行制动。将制动成功的精子转移进入不同注射介质的微滴中冲洗后,将精子和尽量少的注射介质一同注入卵胞浆,注射后的卵母细胞转移至含5%HSA的卵裂培养基微滴中常规培养。
1.6胚胎培养及胚胎评级
1.6.1胚胎培养 (1)ICSI后的卵子立即放入卵裂培养基中微滴培养,受精后19~20 h更换新鲜卵裂培养基,观察受精情况,以出现原核(pronuclear,PN)或双极体(polarbody,PB)作为受精的标志;以同时出现2PN以及2PB作为正常受精的标志[3];(2)受精卵继续培养,授精后66~68 h观察胚胎卵裂情况,并将所有卵裂期胚胎转移进入新鲜的囊胚培养基内继续培养。
1.6.2胚胎评级 授精后66~68 h观察卵裂情况。将正常受精并卵裂的胚胎,根据卵裂球大小是否均匀及有无碎片等标准对胚胎进行评估[4]。本中心将卵裂球≥6-细胞且≤10-细胞,评级为Ⅰ级或Ⅱ级的胚胎定义为优质胚胎;授精后144 h观察囊胚形成情况,并根据Gardner评分标准[5]进行囊胚评估。
1.7计算方法 受精率=(1PN+2PN+多PN+2PB)受精卵数/MⅡ卵子数×100%;正常受精率=正常受精卵子数/ MⅡ卵子数×100%;卵裂率=发生卵裂的受精卵数/总受精卵数×100%;优质胚胎率=优质胚胎数/总胚胎数×100%。
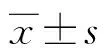
2 结 果
2.1患者一般情况 共纳入129例不孕患者捐赠的共194枚卵母细胞,3组患者年龄、不孕年限、主要基础性激素[卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteotropic hormone,LH)、雌二醇(estradiol,E2)]等参数差异无统计学意义(P>0.05),见表1。3组捐赠精子的男性患者的年龄、主要精液常规参数[精子浓度、前向运动(progressive motility,PR)的精子比例和正常形态精子比例]比较,差异无统计学意义(P>0.05),见表2。
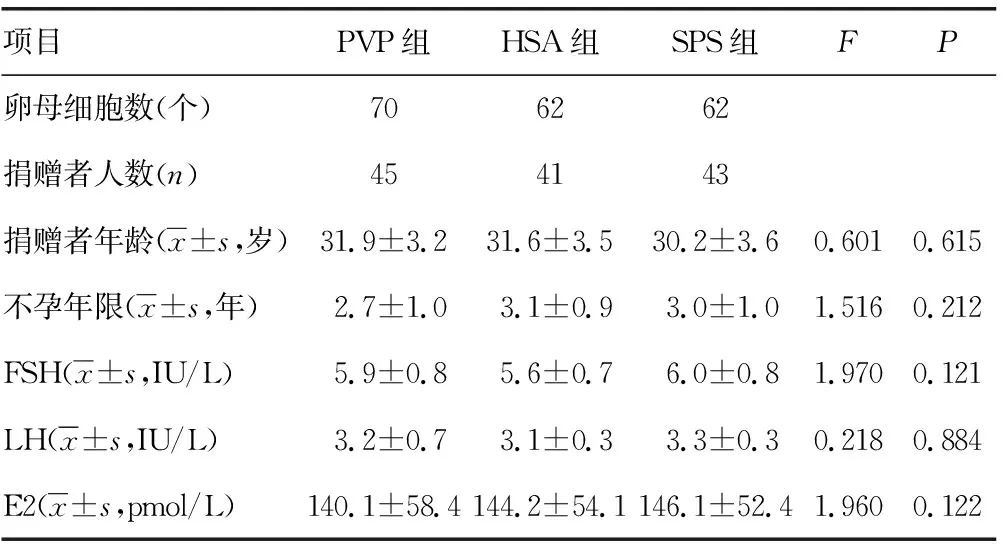
表1 捐赠卵母细胞者一般情况
表2 捐赠精子者一般情况
2.2受精率、正常受精率、卵裂率、优质胚胎率和囊胚形成情况的比较 受精率、正常受精率和卵裂率在3组间差异无统计学意义(P>0.05);HSA组和SPS组的优质胚胎率显著高于PVP组(P<0.05),但HSA组和SPS组间差异无统计学意义(P>0.05);各组均有囊胚形成,见表3。各组代表性的优质胚胎的形态学质量评估见图1;各组形成的囊胚的形态学质量评估见图2。
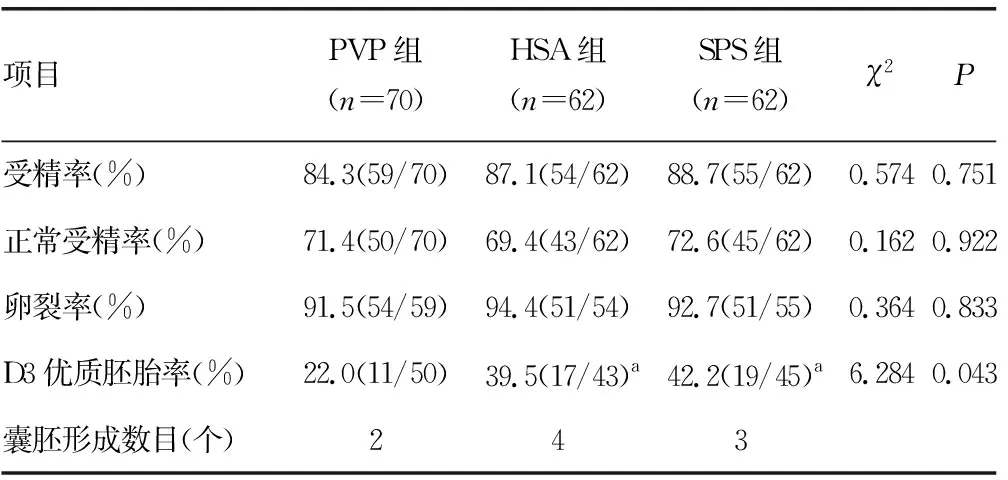
表3 3组卵母细胞行ICSI后受精、卵裂及胚胎发育情况
a:P<0.05,与PVP组比较

A:PVP组6-细胞Ⅱ级的胚胎;B:HSA组7-细胞Ⅱ级的胚胎;C:SPS组8-细胞Ⅱ级的胚胎
图1 3组优质胚胎的形态学评估(×200,10 μm)

A1:PVP组3BB期囊胚;A2:PVP组2期囊胚;B1:HSA组3BB囊胚;B2:HSA组2期囊胚;B3 和B4:HSA组1期囊胚;C1:SPS组3BB囊胚;C2:SPS组2期囊胚;C3:HSA组1期囊胚
图2 3组囊胚的形态学评估
3 讨 论
由于ICSI需要人为的把精子直接注入卵母细胞内,操作中的化学接触不可避免地对卵母细胞造成一定程度的损害,其安全性尤其为人们所关注。PVP是一种人工合成的大分子聚合物,用作ICSI注射介质时,可以明显降低因ICSI机械性损伤引起的卵子死亡,常用的PVP浓度为7%~10%。笔者的经验是可以将PVP的浓度最低降至3.5%而不影响PVP的使用效果。HSA和SPS都属于大分子物质,可以通过改变表面张力简化对配子的操作,也可以起到与PVP相似的作用。PVP具有优良的生理惰性和生物相容性,但是PVP被注射到卵胞质内后会包裹在精子周围,使精子不容易释放卵母细胞激活因子,卵母细胞使精核解聚的物质也不能作用于精核,致使精核不能解聚。而且,PVP本身的一些化学活性,可能会对ICSI后卵子受精以及受精卵的后续发育造成一定的影响。将人的精子与8.3%PVP共孵育30 min后作扫描电镜,可以看见PVP造成精子顶体、细胞膜、和线粒体的膜特征被破坏,精子的核和染色质的形状也会发生改变。在对山羊体外成熟卵母细胞的研究中发现,PVP对山羊的卵母细胞具有毒性,与牛血清清蛋白(bovine serum albumin,BSA)相比较,PVP会明显降低体外成熟卵母细胞的受精率和卵裂率[6-7]。KATO等[8]发现,10% 的PVP并不影响牛卵母细胞的受精率,但是,对受精卵的后续发育有影响,包括减少卵裂率、桑葚胚和囊胚形成率,所形成胚胎的卵裂球数目明显减少,并且胚胎中40.9%的卵裂球中仍然可以检测出PVP。YARI等[9]发现,精子暴露在PVP中可以影响受精卵的卵裂以及随后的胚胎发育,并且以时间依赖的方式产生作用。PVP可诱导细胞周期的G2/M期阻滞以及活性氧自由基的形成,并由此诱导细胞凋亡。由此可见,PVP绝对不能视为完全无毒。本研究结果提示,虽然PVP组、HSA组和SPS组3组卵母细胞的受精率和正常受精率以及卵裂率无明显差异,但HSA组和SPS组的卵裂率有高于PVP组的趋势,并且PVP组细胞的优质胚胎率显著低于HSA组和SPS组,可见PVP对ICSI后受精卵的发育仍然具有不利的影响,本研究与大多数学者的研究结果一致。然而也有学者[10]报道,当PVP的浓度降低到ICSI可以操作的范围之外时,会影响ICSI胚胎的后续发育,但是在不影响ICSI操作可控制性时,低浓度的PVP不会影响ICSI后胚胎的后续发育。可能是因为上述报道是在不同浓度的PVP试验组间的比较得出的结论,而本研究是在不影响ICSI操作可控制性时,对使用PVP和不使用PVP的结果进行比较。
目前辅助生殖技术中常用的培养基大分子物质添加剂为HSA或血清替代物[11],如SPS。ISAJI等[11]采用BSA替代PVP作为鼠核移植的注射介质,结果表明,与PVP相比,BSA可以显著提高克隆胚胎体外发育的速度,增加囊胚形成率,并且还增加了克隆小鼠后代的产量。相关机制研究发现BSA可以通过增加组蛋白H3 lysin9和组蛋白H4 lysin12的乙酰化水平来增强小鼠克隆胚胎的体外和体内发育。目前大多数的研究报道认为,人胚胎培养基内添加HSA或者SPS可以明显提高人卵母细胞的受精率、胚胎发育、优质胚胎率、囊胚形成率以及着床率[12-13]。本研究结果提示,在卵母细胞的受精率、正常受精率、卵裂率、优质胚胎率以及囊胚形成情况等方面,HSA组和SPS组之间并未显示明显差异,说明HSA和SPS均可作为人卵母细胞的ICSI注射介质。此外,与常规IVF/ICSI周期以及正常临床IVM方案获得的未成熟卵母细胞相比,本研究中囊胚形成很少(继续培养的156枚胚胎中,授精144 h时仅有9枚囊胚形成),各组间无明显的可比意义,考虑可能为本研究中采用的是常规促排卵周期中废弃的未成熟卵母细胞,其在体内时就已经被优势卵泡中的卵母细胞所启动的细胞抑制因子所作用,因此其发育潜能在采集时就已经降低,从而导致囊胚形成情况较差。
综上所述,HSA和SPS作为ICSI注射介质后,可以取得与PVP相似的受精率、卵裂率和更好质量的胚胎,或可作为人ICSI的注射介质。值得注意的是,本试验中所用到的患者捐赠的未成熟卵母细胞在常规IVF/ICSI-ET治疗周期中的去向虽然多为丢弃,患者夫妇双方也签署了将其用于医学科研的知情同意书,符合伦理原则,但是由于试验产生的胚胎未能进行人体移植,所以胚胎的体内发育潜能并未得到证实,并且本研究样本数量有限,所得结论可能具有一定的局限性,未来尚需要扩大样本量并在伦理允许的条件下进行体内研究方可推广应用。
